Część teoretyczna
Typową własnością cieczy jest ich zdolność do przechodzenia w stan pary. W dowolnej temperaturze część cząsteczek przechodzi pod wpływem ruchów cieplnych do fazy gazowej, a tendencja cieczy do parowania rośnie wraz ze wzrostem temperatury. Zależy ona również od indywidualnych własności fizykochemicznych cieczy, stąd podział na lotne (eter), średnio lotne (woda) i mało lotne (oleje)
Jeżeli dowolną ciecz umieści się w przestrzeni zamkniętej, pozostawiając wolną przestrzeń nad jej powierzchnią, to w wyniku parowania zmniejszać się będzie ilość fazy ciekłej, zwiększać natomiast ilość pary nad cieczą. W miarę wzrostu ilości pary coraz więcej jej cząsteczek będzie zderzać się z powierzchnią cieczy, przechodząc z powrotem w stan ciekły. W wyniku tego, zostaje osiągnięty stan równowagi dynamicznej w którym w dowolnym okresie czasu wyparowuje i skrapla się taka sama ilość cząsteczek. Parę współistniejącą z cieczą w stanie równowagi nazywamy nasyconą, a jej ciśnienie - prężnością pary nasyconej lub prężnością pary. Jest to niezależna od ilości obu faz, maksymalna prężność, jaką może osiągnąć para w równowadze z cieczą w danej temperaturze. Obecność gazów obojętnych w przestrzeni nad cieczą nie wpływa (w zakresie niezbyt wysokich ciśnień) na prężność jej pary i może być pominięta
Stan równowagi układu ciecz-para ulega przesunięciu w wyniku zmian temperatury. Skutkiem podwyższenia temperatury, dodatkowa ilość cieczy ulega wyparowaniu i prężność pary nasyconej wzrasta. W pewnej temperaturze, zwanej temperaturą wrzenia, prężność pary osiąga wartość ciśnienia zewnętrznego i następuje wówczas wrzenie cieczy. Zależność prężności pary od temperatury badamy mierząc temperaturę wrzenia cieczy pod różnym ciśnieniem.
Graficznym obrazem zależności p=f(t) jest tzw. Krzywa prężności pary, która wykazuje podobny, wykładniczy wzrost prężności wraz ze wzrostem temperatury w odniesieniu do wszystkich cieczy. Maksymalną wartość prężności pary osiąga ciecz w temperaturze krytycznej, której odpowiada określone ciśnienie krytyczne. Krzywa prężności pary dzieli płaszczyznę rysunku na dwie części. Są to: pole cieczy (nad krzywą) i pole pary nasyconej (nad krzywą). W tych obszarach mamy do czynienia z układami jednofazowymi, o dwóch stopniach swobody. Punkty na krzywej odpowiadają takim warunkom fizycznym, w których ciecz trwale współistnieje ze swoją parą nasyconą. Jest więc to układ dwufazowy, o jednym stopniu swobody.
Przejście cieczy w stan pary wiąże się ze zużyciem określonej energii zwanej energia wewnętrzną parowania, która doprowadona w postaci ciepła, zużywana jest na przezwyciężenie sił oddziaływania między cząsteczkami cieczy.
Opracowanie pomiarów
Wartości h' odczytane na manometrze [mm H2O] przeliczam na [mm Hg]
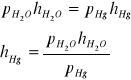
![]()
![]()
Wyniki dalszych obliczeń zawarłam tabelce
Ciśnienie w [mm Hg] przeliczam na [Pa] ze wzoru:
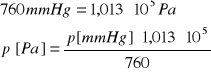
![]()
![]()
Wyniki dalszych obliczeń zawarłam tabelce
Obliczone wartości p' [Pa] dla nadciśnienia obliczam z zależności:
![]()
![]()
![]()
Wyniki dalszych obliczeń zawarłam tabelce
Obliczone wartości p' [Pa] dla podciśnienia obliczam z zależności:
![]()
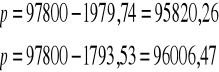
Wyniki dalszych obliczeń zawarłam tabelce
Z wykresu odczytałam temperaturę wrzenia wody Tb odpowiadającą ciśnieniu atmosferycznemu b w danych warunkach eksperymentalnych
![]()
Obliczam metodą graficzną wartość temperaturowego współczynnika prężności pary 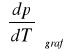
z zależności:
![]()
![]()
![]()
Obliczam metodą najmniejszych kwadratów wartość temperaturowego współczynnika prężności pary 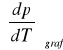
:
![]()
Wiedząc, że molowe objętości wody w stanie pary β i cieczy α wynoszą:
![]()
![]()
i znając wartości temperaturowego współczynnika prężności pary oraz temperaturę Tb odpowiadającą ciśnieniu atmosferycznemu b, obliczam molową entalpię parowania ΔHpar z równania Clausiusa-Clapeyrona:
![]()
![]()
![]()
![]()
Obliczam molową entalpię parowania wody w warunkach doświadczenia ze wzoru:
![]()
![]()
![]()
![]()
Wnioski:
Zgodnie z regułą Troutona, iloraz molowej entalpii parowania ΔHpar przez normalną temperaturę wrzenia Tnwt (pod ciśnieniem 1atm), czyli molowa entalpia parowania ∆Spar dla wody wynosi :
108,8 [J mol-1 K-1]. Natomiast molowa entalpia parowania ∆Spar wody otrzymana doświadczalnie wynosi: 105,87 [J mol-1 K-1]. Błąd pomiaru wynika z pewnej niedokładności termometru Beckmanna (±0,01°C , zaś przy użyciu lupy ±0,002°C) oraz ograniczeń ludzkiego oka.
Wyszukiwarka
Podobne podstrony:
cw 20, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, Che
Fizyczna27m, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
Sprawozdanie damiana nr 1, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i
poprawa II 25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna
Chfizyczna5, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
moje 4, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, Ch
wfizyczna9, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł
chemia fizyczna-ćwiczenie 22, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczn
fizyczna 20, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
fizyczna25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł
Wstęp teoretyczny, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i anality
poprawa, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, C
fIZYCZNA5, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł,
13 fiza word, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna
fizyczna nr 17 moja, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i anali
moje 18, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, C
iza 25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, Ch
więcej podobnych podstron