Marzena Chmielecka 1
Biotechnologia numer studenta
Wydział Biotechnologii i Nauk o Żywności
Politechniki Łódzkiej
Środa 1215 - 1600
Ćwiczenie nr 11
Wyznaczanie ciepła rozpuszczania
Data wykonania ćwiczenia: 10. 10. 2007 r.
Data oddania sprawozdania: 17. 10. 2007 r.
Wstęp teoretyczny:
1. Molowe ciepło reakcji ![]()
(lub ![]()
) jest to ilość ciepła odniesiona do 1 mola reagenta (substratu lub produktu), wymieniona przez układ z otoczeniem podczas reakcji chemicznej przebiegajacej w następujacycg warunkach:
w izobaryczno - izotermicznych P,T = const. (lub izochoryczno - izotermicznych v,T = const),
przy całkowitej przemianie substratów w produkty,
gdy praca nieobjętościowa jest równa zero.
2. Prawo Hessa
Prawo Hessa jest podstawowym prawem termochemii:
Molowe ciepło reakcji zależy tylko od rodzaju substratów i produktów, a nie zależy od drogi procesu.
Prawo Hessa umożliwia obliczanie ciepła reakcji na podstawie znanych efektów cieplnych, innych odpowiednich reakcji. Mianowicie, równania termochemiczne można traktować jak równania matematyczne np. dodawać lub odejmować stronami, mnożyć lub dzielić przez dowolną liczbę różną od zera.
Zależność pomiędzy wielkościami ![]()
i![]()
, wyraża równanie:
![]()
= ![]()
(1)
gdzie Δν = c + 1 - a - b jest różnicą sumy współczynników stechiometrycznych produktów i substratów (p. równanie (8.II))
![]()
Obliczając różnicę współczynników stechiometrycznych uwzględnia się tylko reagenty w fazie gazowej.
3. Prawo Kirchoffa
Prawo Kirchoffa podaje zależność molowego ciepła reakcji od temperatury.![]()
dla P = const: ![]()
(2)
dla v = const: ![]()
(3)
gdzie: ![]()
![]()
Wielkości ![]()
oznaczają molowe pojemności cieplne reagentów. Są to ilości ciepła potrzebne do ogrzania 1 mola substancji o 1 K w warunkach v = const. lub P = const.\
4. Ciepło rozpuszczania - efekt cieplny towarzyszący procesowi powstawania jednofazowej mieszaniny ciekłej dwóch lub kilku substancji. W procesie rozpuszczania ulega zniszczeniu sieć krystaliczna kosztem pobrania z otoczenia energii równej tzw., energii sieciowej. W drugim etapie powstałe cząsteczki lub jony ulegają procesowi solwatacji, czemu towarzyszy wydzielanie się energii zwanej energią solwatacji. Proces rozpuszczania może być:
egzotermiczny (powodujący wzrost temperatury roztworu), jeżeli wydzielana energia solwatacji jest wyższa niż eneria sieciowa,
endotermiczny (powodujący obniżenie temperatury roztworu) jeśli dominuje energia sieciowa nad energią solwatacji.
W kalorymetrach nieizotermiczno - nieadiabatycznych ilość ciepła wydzielonego lub pochłoniętego określa się na podstawie obserwacji zmian temperatury wewnętrznej części układu kalorymetrycznego
Ilość ciepła wydzielonego ( pochłoniętego ) w kalorymetrze przez 1 mol reagenta oblicza się ze wzoru
![]()
gdzie : m- odważka substratu wziętego w nadmiarze stechiometrycznym
M - masa molowa tego substratu
( Δt + Σ ν ) - wyznaczony graficznie przyrost temperatury i poprawka na promieniowanie
.W kalorymetrach omawianego typu wytworzony efekt cieplny określa się na podstawie oznaczenia przyrostu temperatury w naczyniu kalorymetrycznym ( Δ T ) , oraz obliczenia zmiany temperatury spowodowanej przez ciepło wymieniane w czasie pomiaru miedzy naczyniem kalorymetrycznym a otoczeniem ( Δt + Σ ν ) .
Pojemność cieplną kalorymetru K oznacza się wykonując pomiar procesu o znanym efekcie cieplnym , w warunkach możliwie identycznych z pomiaru procesu badanego .
( Δt + Σ ν ) wyznaczamy po sporządzeniu obrazu graficznego funkcji zmian temperatury od czasu
Temperaturę notuje się co pól minuty . Po gwałtownym skoku temperatury spowodowanym przez badany proces wskazania termometru notuje się tak długo aż kolejne pomiary dadzą praktycznie jednakowe i niezbyt duże różnice temperatur .
Pomiary:
Pomiary dokonane co pół minuty
Lp. |
Wyznaczanie pojemności cieplnej kalorymetru |
Wyznaczanie ciepła rozpuszczania soli nieorganicznej |
|
Temperatura (°C ) |
Temperatura (°C ) |
1 |
18,92 |
17,85 |
2 |
18,92 |
17,83 |
3 |
18,91 |
17,81 |
4 |
18,91 |
17,80 |
5 |
18,91 |
17,80 |
6 |
18,90 |
17,79 |
7 |
18,90 |
17,78 |
8 |
18,90 |
17,77 |
9 |
18,90 |
17,76 |
10 |
18,91 |
17,75 |
11 |
19,22 |
17,73 |
12 |
19,50 |
17,69 |
13 |
19,62 |
17,58 |
14 |
19,64 |
17,49 |
15 |
19,69 |
17,47 |
16 |
19,70 |
17,46 |
17 |
19,74 |
17,45 |
18 |
19,76 |
17,45 |
19 |
19,77 |
17,45 |
20 |
19,78 |
17,44 |
21 |
19,79 |
17,44 |
22 |
19,81 |
17,44 |
23 |
19,82 |
17,45 |
24 |
19,82 |
17,45 |
25 |
19,83 |
17,44 |
26 |
19,83 |
17,44 |
27 |
19,84 |
17,45 |
28 |
19,84 |
17,45 |
29 |
19,85 |
17,45 |
30 |
19,85 |
17,44 |
Masa kwasu siarkowego - 4,10 g
Masa tiosiarczanu sodu - 4,87 g
Opis wykonanego ćwiczenia:
Na początku ważę szklaną ampułkę. Jej waga wynosi 16,78g. Później do tej ampułki wlewam stężony kwas siarkowy. Ampułka z kwasem waży teraz 20,88 g. Stąd wynika, że masa kwasu jest równa 4,10 g (20,88 - 16,78= 4,10 g). Wlewam do termosu 600 ml wody o temperaturze zbliżonej do temperatury otoczenia. Po wykonaniu tej czynności umieszczam ampułkę z kwasem w uchwycie sprężynowym i montuję mieszadełko po czym je uruchamiam. Po upływie 5 min. Dokonuję pomiarów temperatury w odstępach trzydziestosekundowych. Między 10 a 11 pomiarem delikatnie zbijam dno ampułki i nadal odczytuję zmianę temperatury. Po skończeniu pomiarów z kwasem siarkowych szykuję urządzenie do pomiaru temperatury z tiosiarczanem sodu.
Ponownie wlewam do termosu czystej wody o temperaturze zbliżonej do temperatury otoczenia. Następnie odważam tiosiarczan sodu (21,61 - 16,74= 4,87g). dalsze czynności wykonuje tak samo jak wyżej.
Opracowanie wyników:
a) Obliczenie pojemności cieplnej kalorymetru:
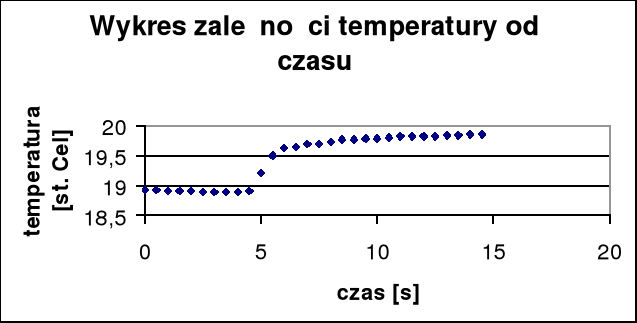
Δt + Σν= (19,69 - 18,91)= 0,78oC
Obliczam liczbę moli kwasu i wody:
Mwody=18 g/mol
Mkwasu= 98 g/mol
Mtiosiarczanu sodu= 240 g/mol
mkwasu= 4,10 g
nwody= 600/18 = 33,33 mola
nkwasu=4,10/98= 0,042 mola
nsoli= 4,87/240= 0,02 mola
nwody/nkwasu=33,33/ 0,042= 793,643
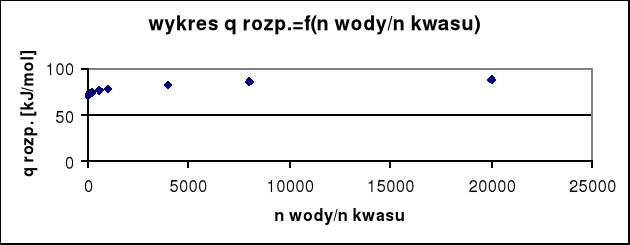
wartość qr odczytana z wykresu wynosi: qr= 77, 48 kJ/mol
Obliczam ciepło wydzielone podczas rozpuszczania:
Qkal= nkwasuqr
Qkal= 0,042*77,48= 3,254 kJ
Obliczam pojemność cieplna kalorymetru:
K= nkwasuqr/(Δt + Σν)
K=3,254/0,78= 4,172
b) Obliczenie ciepła rozpuszczania:
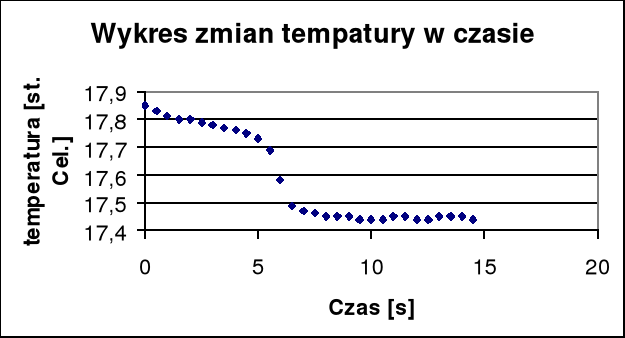
Δt + Σν= (17,69 17,47)= 0,22
qrozp.= K(Δt + Σν)/nsól
qrozp.= (4,172*0,22)/0,02= 45,89 kJ/mol
Wnioski:
Z obliczeń ciepło rozpuszczania wynosi 45,89 kJ/mol i jest ono mniejsze od ciepła rozpuszczania umieszczonego w tablicach, gdzie jego wartość wynosi 47,6 kJ/mol.
Obliczone ciepło rozpuszczania tiosiarczanu sodu różni się od ciepła podanego w tablicach. Wynika to z niedokładności pomiarów, niedokładności wykonanych wykresów i odczytanych z nich wartości. Błąd pomiaru wynika z niedokładności aparatury oraz przenikania ciepła z zewnątrz. Można go wyeliminować stosując dokładniejsza aparaturę pomiarową i dokładniejsze wagi oraz używając lepiej izolowanego zbiornika kalorymetrycznego.
8
Wyszukiwarka
Podobne podstrony:
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
15 wyznaczanie ciepła spalania(1), Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, C
monia 11, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
31 wyznaczanie izotermy mieszania trzech cieczy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, la
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr57, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
2011 info dla studentow sesja letnia OŚ, Studia PŁ, Ochrona Środowiska, Chemia, ogólna i nieorganicz
KOND41vmac, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II s
rad, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr15, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Do druku askorbinowy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczn
Elektroda szklana, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna c
Podczas wymuszonego przep+éywu p+éynu, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wsz
27 poprawa 2, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chemia fizyczna
POLSKI, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spraw
więcej podobnych podstron