1. Wstęp teoretyczny.
Układ jednoskładnikowy ciecz-para nasycona znajduje się w stanie równowagi wtedy, kiedy w danej temperaturze ustala się ściśle określone ciśnienie pary nasyconej. Wszelka zmiana temperatury pociąga za sobą zmianę ciśnienia pary nasyconej.
Przy równowagowym odparowywaniu substancji potencjał termodynamiczny układu nie ulega zmianie. Rozpatrzymy ten proces dla 1 mola substancji:
G = 0
Gciecz = Gpara (1)
gdzie: G- oznacza zmianę potencjału termodynamicznego przy odparowaniu 1 mola substancji,
Gciecz - potencjał termodynamiczny 1 mola cieczy,
Gpara- potencjał termodynamiczny 1 mola pary.
Molowy potencjał termodynamiczny G zdefiniowany jest następująco:
G =H - TS (2)
gdzie: H- entalpia 1 mola substancji,
T - temperatura bezwzględna,
S- entropia 1 mola substancji.
Łącząc równanie (2) z definicją entalpii H = U + pV otrzymujemy:
G =U+pV-TS (3)
gdzie: U- energia wewnętrzna 1 mola substancji,
p - ciśnienie,
V- objętość molowa.
Różniczkując równanie (3) otrzymamy:
dG = dU + pdV + Vdp -TdS - SdT (4)
Z pierwszej zasady termodynamiki wynika, że :
dU= Qel - pdV (5)
czyli zmiana energii wewnętrznej (dU) układu równa jest sumie ciepła przemiany (Qel) i pracy wykonanej na układzie związanej ze zmianą objętości (-pdV). Z definicji entropii wynika, że :
Qel=TdS (6)
Stąd równanie (5) można zapisać:
dU - TdS + pdV = 0 (7)
W równaniu (4) odpadają więc trzy człony, których suma jest równa 0. Pozostaje następujące równanie:
dG = Vdp - SdT (8)
uwzględniając równanie (1), dla równowagi ciecz- para nasycona można napisać:
Vcieczdp - ScieczdT = Vparadp - SparadT (9)
gdzie: Vciecz ,Vpara - objętość 1 mola cieczy i 1 mola pary,
Sciecz ,Spara - entropia 1 mola cieczy i 1 mola pary.
Przekształcenie równania (9) daje:
![]()
(10)
uwzględniając, że:
![]()
(11)
gdzie: Q - jest ciepłem przemiany, czyli ciepłem parowania 1 mola otrzymamy:
![]()
(12)
Otrzymaliśmy zależność między prężnością pary nasyconej (p), a temperatura i ciepłem parowania Q znaną jako równanie Clausiusa-Clapeyrona. W obszarze temperatur oddalonych od temperatury krytycznej i ciśnienia oddalonego od krytycznego we wzorze (12) objętość Vciecz można pominąć jako wielkość małą w stosunku do objętości Vpara , a do objętości pary zastosować równanie gazów doskonałych. Po wstawieniu do równania (12) zamiast objętości pary:
![]()
(13)
gdzie: R - stała gazowa.
otrzymujemy inną postać równania Clausiusa-Clapeyrona:
![]()
lub ![]()
(14)
Przy założeniu, że ciepło parowania w wąskim przedziale temperatur nie zależy od temperatury, po scałkowaniu (14) otrzymamy
![]()
(15)
Po zmianie na logarytm dziesiętny:
![]()
(16)
Z ostatniej zależności wynika, że wykreślenie logarytmu ciśnienia pary nasyconej w funkcji odwrotności temperatury powinno dać prostą o współczynniku kierunkowym -Q/(2,303*R).
2. Część doświadczalna.
Celem ćwiczenia jest wyznaczenie ciepła parowania cieczy na podstawie zależności temperatury wrzenia od ciśnienia.
Wykonanie ćwiczenia.
W ćwiczeniu wykorzystuje się fakt, że ciecz wrze, kiedy prężność jej pary nasyconej zrówna się z ciśnieniem pod jakim proces się odbywa. Pozwala to na wyznaczeni zależności prężności pary nasyconej od temperatury.
Rys. 1. Zestaw do przeprowadzenia doświadczenia.
Złożyć zestaw jak na rys. 1. Kolbę napełnić badaną cieczą mniej więcej do połowy objętości i wrzucić kawałek porowatej porcelany aby nie przegrzać cieczy. Wszystkie szlify posmarować apiezonem. Termometr powinien być umieszczony nad powierzchnią cieczy.
Pierwszy pomiar wykonać w temperaturze otoczenia. Przy otwartym kranie włączyć pompę wodną, a następnie powolutku zamknąć kranik. Po obniżeniu się ciśnienia odczekać aż ciecz zacznie wrzeć, następnie skorygować ciśnienie kranikiem tak aby ciecz łagodnie wrzała (Nie należy kranem manipulować zbyt gwałtownie aby nie spowodować przelania się rtęci jak i rozbicia manometru). Odczytać z manometru różnice poziomów, a także temperaturę z termometru umieszczonego nad cieczą badaną. Ogrzać ciecz łaźnie wodną o około 5C. Wykonać pomiar tak jak dla pierwszej temperatury. Przeprowadzić 6 takich pomiarów dla wyższych temperatur z zakresu 20-50C. Wyniki zanotować w tabeli.
3. Tabela wyników :
Temp. I °C [K] |
Temp. II °C [K] (śr.temp. K) |
Ciśnienie [mmHg] |
Średnie ciśnienie [mmHg] |
Ciśnienie [Pa] |
1/T * ⋅10-3 |
Log p |
35°C [308] |
45°C [318] |
407-380 (27) |
26,2 |
3 493,036 |
3,32 |
3,54 |
|
32°C [305] |
408-381 (27) |
|
|
|
|
|
38°C [311] |
408-379 (29) |
|
|
|
|
|
36°C [309] |
405-380 (25) |
|
|
|
|
|
35°C [308] |
405-382 (23) |
|
|
|
|
|
(310,2) |
|
|
|
|
|
40°C [313] |
38°C [311] |
402-383 (19) |
24,2 |
3 226,392 |
3,20 |
3,51 |
|
41°C [314] |
408-379 (29) |
|
|
|
|
|
37°C [310] |
403-384 (19) |
|
|
|
|
|
40°C [313] |
406-380 (26) |
|
|
|
|
|
41°C [314] |
408-380 (28) |
|
|
|
|
|
(312,4) |
|
|
|
|
|
45°C [318] |
44°C [317] |
404-382 (22) |
31,4 |
4 186,311 |
3,17 |
3,62 |
|
41°C [314] |
410-377 (34) |
|
|
|
|
|
39°C [312] |
410-377 (34) |
|
|
|
|
|
44°C [317] |
409-378 (31) |
|
|
|
|
|
44°C [317] |
413-377 (36) |
|
|
|
|
|
(315,4) |
|
|
|
|
|
50°C [323] |
49°C [322] |
408-381 (27) |
39,6 |
5 279,551 |
3,11 |
3,72 |
|
51°C [324] |
414-373 (41 |
|
|
|
|
|
49°C [322] |
415-375 (40) |
|
|
|
|
|
47°C [320] |
418-373 (45) |
|
|
|
|
|
47°C [320] |
417-372 (45) |
|
|
|
|
|
(321,6) |
|
|
|
|
|
4. Obliczenia :
Przeliczanie jednostek :
Temperatury :
T = t + 273 [K]
T = 45 + 273
T = 318 [K]
Ciśnienia :
1 [mmHg] = 133,322 [Pa]
26,2 [mmHg] = x [Pa]
x = 133,322 ⋅ 26,2 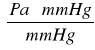
x = 3 493,036 [Pa]
Ciepło parowania :
![]()
![]()
gdzie R = 8,31447 ![]()
Dla 35°C = 308 K :
Q = 3,54 ⋅ 2,303 ⋅ 8,1447 ⋅ 308 = 20 877,69 ![]()
Q = 20,88 ![]()
Dla pozostałych temperatur obliczenia wykonano analogicznie.
5.Wnioski :
Przy wykonywaniu ćwiczenia można było zaważyć ,iż wraz ze wzrostem temperatury I, średnie ciśnienie cieczy również wzrastało.
Niestety błędy pomiarowe przy temperaturze 40°C, które są wyjątkiem mogą być spowodowane niedokładnością lub błędnym odczytaniem wartości, gdyż te ulegały ciągłym zmianą, dlatego idealne wychwycenie dokładnych wartości dla wyznaczonych temperatur sprawiało nam drobne problemy.
Wyznaczając prostą zależności odwrotności temperatury od logarytmu dziesiętnego ciśnienia możemy uzyskać wartość ciepła parowania badanej cieczy, która to wartość jest współczynnikiem kierunkowym opisanej prostej.
Wyszukiwarka
Podobne podstrony:
Ćwiczenie 7, dużo z dziedzin naukowych i nietylko, Chemia fizyczna
chemia fizyczna, dużo z dziedzin naukowych i nietylko, Chemia fizyczna
chemfizsc, dużo z dziedzin naukowych i nietylko, Chemia fizyczna
chemiahgj, dużo z dziedzin naukowych i nietylko, chemia nieorganiczna
2zad egz, dużo z dziedzin naukowych i nietylko, chemia nieorganiczna
GRUPY SPRZĘTU ELEKTRYCZNEGO I ELEKTRONICZNEGO, dużo z dziedzin naukowych i nietylko, Ekologia
Na kolosa z fabii - obowiązki prowadzających pojazdy, dużo z dziedzin naukowych i nietylko, Ekologia
Zasady mikroskopowania, dużo z dziedzin naukowych i nietylko, Biologia
ETMitulp, dużo z dziedzin naukowych i nietylko, Ekologia
Biol-11, dużo z dziedzin naukowych i nietylko, Biologia
etmtli, dużo z dziedzin naukowych i nietylko, Ekologia
ćwiczeniee 43, materiały naukowe do szkół i na studia, chemia fizyczna moja, Chemia fizyczna, Opraco
ćwiczenie 42, materiały naukowe do szkół i na studia, chemia fizyczna moja, Chemia fizyczna, Opracow
ćwiczenie 42Piotr Osuch, materiały naukowe do szkół i na studia, chemia fizyczna moja, Chemia fizycz
ćwiczeniee 43Aneta Łoboda, materiały naukowe do szkół i na studia, chemia fizyczna moja, Chemia fizy
ćwiczenie 43, materiały naukowe do szkół i na studia, chemia fizyczna moja, Chemia fizyczna, Opracow
więcej podobnych podstron