|
UNIWERSYTET ZIELONOGÓRSKI Instytut Inżynierii Sanitarnej Zakład Technologii Wody, Ścieków i Odpadów |
Ćwiczenia laboratoryjne z Technologii Ścieków
Chlorowanie ścieków.
WYKONAŁY:
ALEKSANDRA ZIELIŃSKA
MARTA JUREWICZ
GR. 36A
1. WSTĘP TEORETYCZNY
Oprócz metod biologicznych do usuwania związków azotowych stosuje się często procesy fizyczno-chemiczne. Występuje to najczęściej w nowoprojektowanych zakładach odnowy wody, w których usuwanie związków organicznych oraz fosforanów w procesach chemicznego wiązania wapnem jest powiązane z odpędzaniem azotu amonowego w wieżach stripingowych. W tego typu układach zamiast desorpcji powietrzem azotu amonowego można go również usuwać w procesach wymiany jonowej, np. na klinoptylolicie lub przez utlenianie chlorem czy ozonem.
Często zachodzi konieczność usuwania ze ścieków azotanów. Tak jest gdy ścieki są oczyszczane w mechaniczno- biologicznej oczyszczalni ścieków z pełną nitryfikacją. Odpływ z oczyszczalni charakteryzuje się wówczas podwyższoną zawartością azotanów. Usuwanie azotanów odbywać się może metodą wymiany jonowej (gdy nie można stosować lub jest nieopłacalne wprowadzenie procesów biologicznych).
Wszystkie metody usuwania związków azotowych w procesach fizyczno-chemicznych (oprócz odpędzania azotu amonowego) powinny być stosowane po wstępnym usunięciu związków organicznych.
Usuwanie azotu amonowego poprzez utlenianie chlorem i ozonem.
Utlenianie azotu amonowego chlorem jest jednym z najpowszechniej stosowanych procesów w technologii wody i ścieków. Znalazł on również uznanie w technologii odnowy wody. Opracowano kilka modyfikacji tej metody. Oprócz klasycznego utleniania azotu amonowego chlorem stosuje się utlenianie w złożu węglowym czy też klinoptylolitowym. W układach technologicznych odnowy wody ma również zastosowanie utlenianie azotu amonowego ozonem.
Właściwości chemiczne wodnych roztworów chloru.
Do utleniania i dezynfekcji stosuje się wodne roztwory chloru nazywane woda chlorową, które wytwarzana jest w chloratorach przez wymieszanie chloru gazowego z wodą. W wyniku kontaktu z wodą chlor ulega hydrolizie:
Cl2 + H2O ↔ HOCl + H+ + Cl-
W temperaturze 291 K hydroliza zachodzi w ułamku sekundy, a w temperaturze 273 K w ciągu kilku sekund. Wynika to z przebiegu reakcji chloru nie z cząsteczka wody, lecz z anionem hydroksylowym. W praktyce projektowej i eksploatacyjnej istotna jest znajomość procentowego udziału poszczególnych form chloru ze względu na konieczność określenia dopuszczalnego stężenia chloru gazowego w wodzie chlorowej oraz niezbędnej dawki środka neutralizującego w razie wymaganej korekty pH. Stężenie chloru nie przekracza zazwyczaj 3,5 g Cl/ dm3, w którym w wodzie wodociągowej o przeciętnej zasadowości pH wody chlorowej jest w granicach 3 i nie występuje wydzielanie się chloru gazowego w miejscu jej dawkowania.
Reakcje chloru z azotem amonowym.
W wyniku chlorowania zmiennymi dawkami wód lub ścieków, zawierających azot amonowy, otrzymujemy krzywe zapotrzebowania chlorowego, na której można wyróżnić kilka charakterystycznych punktów, tj. punkt maksymalny i minimalny zwany punktem przełamania. Pierwszy z nich występuje przy dawce chloru w stosunku wagowym do azotu amonowego wynoszącym 5 : 1 lub molowym 1: 1, a drugi przy tym stosunku wynoszącym teoretycznie 7,6 : 1, a praktycznie ok. 8-10 : 1. dane te dotyczą wąskiego zakresu pH w granicach 6-8. W pierwszej fazie chlorowania ( aż do punktu maksymalnego) powstają chloroaminy, a w następnej do punkty przełamania następuje ich rozkład. Poza punktem przełamania obserwuję się występowanie chloru wolnego, trójchloroazotu i dwuchloroaminy. Przebieg powstania chloroamin można przedstawić następująco:
NH3 + OCL- → NH2Cl + OH-
2 NH2Cl + H+ → NHCl2 + NH4+
3 NHCl2 + H+ → 2 NCl3 + NH4+
mogą one również wytwarzać się z bezpośredniej reakcji chloru z azotem amonowym w przypadku wysokich dawek chloru:
NH4+ + HOCl → NH2Cl + H2O + H+
NH4+ + 2 HOCl → NH2Cl + 2 H2O + H+
NH4+ + 3 HOCl → 3 H2O + H+
Rodzaj wytworzonej chloroaminy zależy przede wszystkim od odczynu. Gdy pH jest większe od 8, w roztworze występuje tylko monochloroamina, w zakresie pH 5-8 : monochloroamina, dwuchloroamina i azot amonowy równowagowy, a w zakresie pH 3-5 : dwuchloroamina i trójchloroazot, a także azot amonowy równowagowy. Gdy pH jest mniejsze od 3 występuje trójchloroazot i azot amonowy równowagowy.
Powstałe chloroaminy są we wzajemnej równowadze. Podwyższenie odczynu powoduje przejście trójchloroazotu i dwuchloroaminy w monochloroaminę. Natomiast usunięcie równowagowego azotu amonowego, np. przez wymianę jonową lub wiązanie chlorem powoduje rozkład chloroamin do azotu gazowego, gdyż chloroaminy bez obecności azotu amonowego są nietrwałe.
Wpływ zasadowości na usuwanie amoniaku.
Na stan równowagi między chloroaminami oprócz odczynu ma także wpływ zasadowość wody i stężenie chloroamin. W wodach o dużej zasadowości i dużej zawartości chloroamin równowaga jest przesunięta w kierunku dwuchloroamin, natomiast w przypadku małej zasadowości i małej zawartości chloroamin równowaga jest przesunięta w kierunku monochloroaminy.
Wpływ czynników fizycznych na proces chorowania.
W miejscu dawkowania wody chlorowej do wody lub ścieków następuje spadek pH do ok. 3. następnie w wyniku mieszania pH ustala się odpowiednio do pojemności buforowej i dawki chloru (przeważnie w zakresie pH od 6,5 do 8,5). Końcowy odczyn wody lub ścieków zostaje osiągnięty po czasie zależnym od intensywności mieszania. W czasie zmiany odczynu od 3 do pH końcowego przebiegają reakcje wytwarzania chloroamin przy chloroaminowaniu lub utlenianiu azotu amonowego, gdy chlorowanie odbywa się do punktu przełamania oraz wszystkie reakcje niekorzystne. Tym ostatnim sprzyja małe pH oraz duże stężenie chloru.
Chloroaminowanie.
W celu wyeliminowania niekorzystnych czynników na proces chlorowania, należy stosować mieszanie wstępnie zobojętnionej wody chlorowej z woda lub ściekami. Ponadto wodę chlorowa należy dawkować wielopunktowo. W przypadku braku mieszania i zobojętniania wody chlorowej stopień przemiany chloru na chlor związany wynosi 40-50 %. Stosowanie zobojętniania wody chlorowej podnosi sprawność chlorowania do średnio 55 %, mieszanie wstępne do ok.72 %, a w razie wielopunktowego dawkowania wody chlorowej wzrasta do ok. 90 %. Intensywność mieszania wyrażona przez gradient powinna wynosić ok. 4 s-1.
Chlorowanie do punktu przełamania.
Na efektywność procesu utleniania azotu amonowego chlorem ma wpływ sposób zobojętniania wody chlorowej oraz intensywność mieszania wody. Najlepsze rezultaty uzyskano, gdy dawkowano zobojętnioną wodę chlorową. Istotne znaczenie ma intensywność mieszania w czasie chlorowania. W razie braku mieszania zmniejsza się intensywność utleniania azotu amonowego o ok. 25 %, punkt przełamania występuje punktowo przy większych stosunkach wagowych chloru do azotu amonowego. Ponadto w punkcie przełamania stwierdza się duże stężenie chloru pozostałego.
Warunki stosowania procesu utleniania chlorem.
Podczas utleniania azotu amonowego są wymagane duże dawki chloru. Praktycznie na utlenianie 1 g azotu amonowego potrzeba 10 g chloru. W wyniku utleniania chlor ulega redukcji do chlorków. Tak więc utlenianie 1 g azotu amonowego powoduje przyrost ok. 10 g chlorków. Ponadto dla prawidłowego przebiegu tego procesu jest wymagane zobojętnianie wody chlorowej. Do jej neutralizacji można stosować wodorotlenek sodowy. Nie należy stosować wodorotlenku wapniowego, gdyż powstają nierozpuszczalne sole. Konieczność zobojętniania wody powoduje w wyniku utleniania 1 g azotu amonowego zwiększenie zasolenia o ok. 15 g.
Dla uzyskania dużej sprawności utleniania, należy stosować ciągły pomiar azotu amonowego oraz automatyczne sterowanie dawkowaniem chloru metodą pomiaru potencjału oksydacyjno- redukcyjnego.
Dechloracja ścieków.
Bardzo często jest wymagana końcowa dechloracja ścieków. Do tego celu stosuje się gazowy dwutlenek siarki, siarczan sodowy, pirosiarczan sodowy lub węgiel aktywny. W wyniku dawkowania dwutlenku siarki do chlorowanych ścieków przebiegają następujące reakcje:
SO2 + H2O → H2SO3 + HOCl → H2SO4 + HCl
NH2Cl + H2SO3 + H2O → NH4HSO4 + HCl
Do redukcji 1 g chloru potrzeba stechiometrycznie ok. 0,9 g SO2. Dobre rezultaty uzyskuje się stosując siarczan sodowy:
Na2SO3 + Cl2 + H2O → Na2SO4 + 2 HCl
Do zredukowania 1 g chloru potrzeba 1, 775 g czystego związku. Czas reakcji dla obu reduktorów wynosi kilka sekund. Nie zaleca się stosowania do dechloracji tiosiarczanu sodowego. W wyniku dechloracji powstają pewne ilości kwasów, które zmniejszają zasadowość ścieków.
Do dechloracji można stosować również węgiel aktywny. Proces redukcji chloru i chloroamin można opisać następująco:
C* + 2 HOCl → CO2 + 2 H+ + 2Cl-
C* + 2 NH2Cl + 2 H2O → CO2 + 2 NH4+ + 2 Cl-
C* + 4 NHCl2 + 2 H2O → CO2 + 2 N2 + 8 H+ +8 Cl-
Z przedstawionych reakcji wynika, że kwas podchlorowy utleniając węgiel złoża do dwutlenku węgla sam redukuje się do kwasu solnego. Natomiast monochloroamina redukuje się do azotu amonowego, a dwuchloroamina do azotu gazowego. W wyniku dechloracji wytwarza się dwutlenek węgla agresywny. Wymagany czas kontaktu ścieków z węglem powinien wynosić ok. 600 s. Wysokość złoża węglowego powinna mieścić się w granicach 0,4- 1,2 m.
2. WYKONANIE ĆWICZENIA.
1. Cel ćwiczenia.
Zasadniczym celem ćwiczenia jest zapoznanie się z chemizmem procesu chlorowania oraz wpływu zanieczyszczeń obecnych w ściekach na ten proces.
2. Obliczanie dawki chloru.
Ścieki chlorowano zmiennymi dawkami chloru, które obliczono na podstawie zawartości azotu amonowego. Zastosowano następujące dawki chloru: 2,5; 5,0; 7,5; 10,0; 12,5 mgCl2/dm3. Przeliczono tak wyznaczone dawki na ilość ml wody chlorowej o danym stężeniu i dawkowano do prób ścieków (miano wody chlorowej: 1718,8 mg Cl2/dm3). Po upływie 30 min. kontaktu próby ścieków z chlorem wykonano następujące oznaczenia:
chlor pozostały jodometrycznie przy pH = 6,5,
azot amonowy po 1 min. kontaktu z odczynnikiem.
Dawka chloru |
gCl2/dm3 |
mlCl2/dm3 |
ml wody chlorowej/0,5l |
2,5 |
10,75 |
6,25 |
3,13 |
5 |
21,50 |
12,51 |
6,25 |
7,5 |
32,25 |
18,76 |
9,38 |
10 |
43,00 |
25,02 |
12,51 |
12,5 |
53,75 |
31,27 |
15,64 |
3. Wykonanie ćwiczenia.
Do półlitrowych butelek wlano 0,5 dm3 ścieków, dodano obliczone ilości wody chlorowej i zamknięto szczelnie korkiem. Po dodaniu odczynnika próbę dokładnie wymieszano i odstawiono na 30 min. Po czym wykonano powyższe oznaczenia.
4. Wyniki i ich interpretacja.
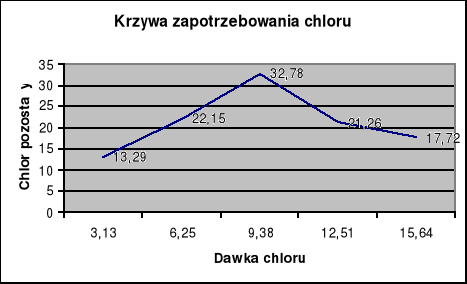
Wyniki zestawiono w tabeli poniżej. Narysowano krzywą zapotrzebowania chlorowego.
Zawartość chloru pozostałego w wodzie obliczono ze wzoru:
X = a . f . 1000/ V
gCl2/m3
a - objętość tiosiarczanu zużyta na zmiareczkowanie, cm3;
V- objętość próbki wody wziętej do badania, cm3.
f = 0,886 dla tiosiarczanu sodu 0,025
Oznaczenia |
Jednostka |
Ścieki surowe |
Dawka chloru mg Cl2/dm3 |
||||
|
|
|
2,5 |
5,0 |
7,5 |
10,0 |
12,5 |
Azot amonowy |
gN/m3 |
4,30 |
3,31 |
2,44 |
1,37 |
0,24 |
0,03 |
|
ekstynkcja |
0,688 |
0,529 |
0,391 |
0,219 |
0,038 |
0,005 |
Chlor pozostały |
gCl2/m3 |
- |
13,29 |
22,15 |
32,78 |
21,26 |
17,72 |
|
ilość tiosiarczanu |
|
1,5 |
2,5 |
3,7 |
2,4 |
2,0 |
pH |
|
7,2 |
8,0 |
8,4 |
8,5 |
8,6 |
8,8 |
3. WNIOSKI
Powyższa krzywa zapotrzebowania pokazuje nam skuteczność usuwania azotu amonowego różnymi dawkami chloru (dodawanego w postaci wody chlorowej). Najbardziej optymalną dawkę chloru określa się na podstawie punktu przełamania na krzywej. Dla uzyskanych wyników punkt ten znajduje się dla dawki 12,5 mgCl2/dm3, odpowiadającej 15,64 ml wody chlorowej. Większe dawki spowodują, że część chloru pozostaje w postaci wolnej i nie tworzy związków z azotem, powstają wtedy trójchloroazot i dwuchloroaminy.
Do punktu przełamania zachodzą reakcje, w wyniku których powstają chloroaminy:
NH3 + OCL- → NH2Cl + OH-
2 NH2Cl + H+ → NHCl2 + NH4+
3 NHCl2 + H+ → 2 NCl3 + NH4+
Stopień przemiany azotu amonowego w azot chloraminowy zależy od dawki chloru, stężenia azotu amonowego, pH i zasadowości wody. Wykres zapotrzebowania jest również wykorzystywany do dezynfekcji (chlorowania) ścieków zawierających amoniak. Punkt przełamania pokazuje wtedy moment, od którego w ściekach zaczyna pojawiać się chlor wolny posiadający właściwości dezynfekujące, (do punktu przełamania chlor zużywany jest na tworzenie związków z amoniakiem).
4
Wyszukiwarka
Podobne podstrony:
SPR, technologia wody i sciekow Jachimko
spr woda3 próbki, technologia wody i sciekow Jachimko
Chlorowanie ścieków, technologia wody i sciekow Jachimko
chlorowanie, technologia wody i sciekow Jachimko
analiza wody, technologia wody i sciekow Jachimko
KOAGULACJA1sd, technologia wody i sciekow Jachimko
adsorpcja, technologia wody i sciekow Jachimko
wody powierzchniowe opis, technologia wody i sciekow Jachimko
Kinetyka frakcji-sprawozdanie, technologia wody i sciekow Jachimko
ieje sedymentacyjne 2-nita, technologia wody i sciekow Jachimko
index osadu, technologia wody i sciekow Jachimko
spr 03, Ochrona środowiska, Technologie wody i ścieków
Odkwaszanie, technologia wody i sciekow Jachimko
CHARAKTERYSTYKA WÓD, technologia wody i sciekow Jachimko
sprawozdanie z BZT, technologia wody i sciekow Jachimko
technologia ścieków - projekt, technologia wody i sciekow Jachimko, tech wody i sciekow-Kisielewicz,
KOAGULACJA1, technologia wody i sciekow Jachimko
Sedymentacja w lejach Imhoffa - sprawozdanie, technologia wody i sciekow Jachimko
INDEKS OSADU, technologia wody i sciekow Jachimko
więcej podobnych podstron
