Wykład 1
Historia wiedzy o komórkach:
1665r. - Hook użył prymitywnego mikroskopu do opisu komórek korka; wprowadził pojęcie komórki,
1674r. - Leeuwenhoek odkrył pierwotniaki; 9 lat później zobaczył bakterie ( w późniejszym okresie zaobserwował plemniki i krwinki),
1781r. - Felix Fontana wykrył po raz pierwszy i opisał gęste ziarna rozpoznane później jako jąderko,
1831r. - Brown opisał jądro komórkowe,
1839r. - Schleiden i Schviann - współtwórcy teorii komórkowej ( wszystkie tkanki są zbudowane w analogiczny, ale zróżnicowany sposób.),
1879r. - Flemming opisał chromosomy podczas mitozy,
1881r. - Cajal i inni opisali metody barwienia komórek nerwowych i tkanki nerwowej,
1898r. - Golgi opisał aparat Golgiego,
1952r. - Palade, Pouter, Sjostraud rozwinęli metody mikroskopii elektronowej, które pozwoliły po raz pierwszy zobaczyć wiele struktur wewnętrznych,
1952r. - Robertson opisał dwuwarstwową strukturę błony komórkowej po raz pierwszy oglądanej w mikroskopie elektronowym.
MIKROSKOPY
Świetlne Elektronowe
M. w polu jasnym, 1. M. transmisyjny,
M. w polu ciemnym, 2. M. skaningowy.
M. fluorescencyjny,
M. polaryzacyjny,
M. kontrastowo - fazowy,
M. interferencyjny,
M. konfokalny (laserowy).
M. w polu ciemnym:
Kondensor w szczególny sposób oświetla badany obiekt,
Do obiektywu wpadają wyłącznie promienie ugięte na strukturach obiektu, a nie ugięte są eliminowane,
Struktury rozpraszające światło widoczne są jako jasno oświetlone obrazy.
M. fluorescencyjny:
Zmodyfikowany mikroskop świetlny,
Źródło światła - lampa rtęciowa,
Preparaty sporządza się przy użyciu odczynników dających zjawisko fluorescencji,
Struktury komórkowe znakuje się, np. przeciwciałami sprzężonymi z fluorochromami ( po naświetleniu światłem ultrafioletowym emituje światło widzialne).
M. polaryzacyjny:
Wykorzystuje się w nim zjawiska istnienia w komórkach struktur anizotropowych (mających różne współczynniki załamania światła),
Zbudowany jest z dwóch płytek - polaryzatora i analizatora - zbudowane są z przejrzystego, polaryzującego światło materiału.
M. kontrastowo - falowy:
Używany do badań żywych komórek (można zobaczyć struktury wewnętrzne, w nieutrwalonych i niebarwionych komórkach) , np. hodowanych in vitro,
W układzie optycznym o jasnym ( dodatnim) kontraście fazowym dwie wiązki fal sumując się dają rozjaśnienie obrazu. Przy ciemnym ( ujemnym) kontraście znoszą się wzajemnie, tworząc ciemniejsze obszary,
W mikroskopie tym przesunięcie fazy świetlnej przechodzącej przez obiekt uzyskuje się dzięki wyposażeniu go w specjalną przysłonę w kondensatorze oraz płytkę fazową w obiektywie.
M. interferencyjny:
Wykorzystuje się w nim nakładanie się fal świetlnych,
Pozwala na dowolny, płynny sposób zmienić wobec siebie przesunięcia fazowe promieniowania tła i promieni ugiętych przez badany obiekt,
Przy jego udziale można dokładnie zmierzyć wartość współczynnika załamania światła, którego wartość zależy od stężenia substancji wchodzących w skład żywej materii,
Za pomocą pomiaru współczynnika załamania światła można określić stężenie substancji w danych obszarach komórki i podać suchą masę materii żywej w badanych organellach.
M. laserowy (LSM):
Źródłem światła jest laser, którego cieniutki promień skanuje miejsce po miejscu w obrębie obserwowanego pola widzenia,
Średnica plamki promienia lasera definiuje zdolność rozdzielczą mikroskopu,
Rozdzielczość - 0.1 µm,
Jakość obrazów - zwłaszcza obiektów grubych, np. ok. 20 µm o wiele lepsza - obraz uzyskany nie jest zburzony nakładaniem się światła ugiętego przez struktury leżące poza płaszczyzna ostrego widzenia,
Dopuszcza do płaszczyzny obrazu te promienie, które są ugięte na strukturach widocznych, w płaszczyźnie ostrości widzenia obrazu mikroskopu,
Promienie ugięte na strukturach leżących w warstwach niżej lub wyżej od warstw w płaszczyźnie ostrego widzenia są odfiltrowane.
Za pomocą LSM :
Można tworzyć obrazy kolejnych warstw badanego obiektu o grubości 1-2 µm,
Obserwacje można prowadzić na obiektach żywych ( na pojedynczych komórkach),
Pozwala na uzyskanie obrazów w świetle przechodzącym i odbitym,
Obrazy te można zestawić ze sobą za pomocą komputera.
Wykład 2.
Metody badawcze:
Metody HE (hematoksylina - eozyna):
Hematoksylina - barwnik zasadowy, wybarwia jądro na niebiesko,
Eozyna - barwnik kwasowy, zabarwia cytoplazmę na różowo.
Barwienie metachromatyczne:
Struktury zostają zabarwione innym kolorem, niż kolor barwnika użytego do barwienia,
Używa się błękitu toluidyny - daje on różowo- fioletowe zabarwienie struktur metachromatycznych ( powstają dimery barwnika inaczej absorbujące widmo światła białego),
Zjawisko metachromatyczne występuje przy:
Barwieniu glikozaminoglikanów ( mukopolisacharydów) w chrząstce,
Barwieniu komórek tucznych, ich ziarnistość barwią metachromatycznie ze względu na zawartość heparyny.
Reakcje histoenzymatyczne:
Wykazanie obecności i lokalizacji enzymów w komórce i tkankach
Reakcje Gomoriego:
Do wykrycia zespołu enzymów nazywanych fosfatazą zasadową (hydrolizują estry fosforanowe),
Polega na jako substrat estrów fosforanowych glicerolu.
Wykrywanie hydrolaz i dehydrolaz:
Skrawki zamrożonej tkani inkubuje się w roztworze bursztynianu sodu i błękitu tetrazolowego,
Dehydrogenaza utlenia bursztynian sodu do fumaranu sodowego, a protony są przekazywane na cząsteczkę błękitu tetrazolowego, który zostaje zredukowany do formazonu i zmienia zabarwienie na niebieski,
Intensywność zabarwienia jest wskaźnikiem aktywności utleniającej mitochondrium.
Immunohistochemia:
Dziedzina, w której używa się swoistych odczynników,
Znakowane przeciwciała wiążą się z określonym białkiem w komórkach i można je wykryć za pomocą mikroskopu fluorescencyjnego ( fluorochromy), świetlnego ( peroksydaza), elektronowego ( złoto).
Istnieją 2 metody stosowania przeciwciał:
Bezpośrednia - przeciwciało bezpośrednio oznakowane, tak aby można było je wykryć,
Pośrednio - wprowadza się nieoznakowane przeciwciało, a później odpowiednio oznakowane antyprzeciwciało.
Hodowla tkanek:
Wprowadzona przez A. Corella na początku XX w. umożliwia analizę zachowań komórek i tkanek pod wpływem różnych substancji dodawanych do środowiska hodowlanego.
W celu standaryzacji powstały dobrze opisane pod względem genetycznym linie komórkowe
Komórki pozyskane z tkanek człowieka mają określoną liczbę pokoleń do przeżycia.
Nieśmiertelne linie komórek uzyskuje się przez transformacje ( np. nowotwory, wprowadzenie części genomu człowieka).
Autoradiografia:
Właściwości promieniotwórcze pierwiastków można wykorzystać do śledzenia szlaków metabolicznych niektórych cząsteczek ( makro),
Komórki nie odróżniają pierwiastków od ich promieniotwórczych izotopów, którymi są znakowane cząsteczki prekursorowe,
Do oznakowania prekursorów metabolizmu białek wykorzystuje się aminokwasy, w których jeden z węgli zostaje zastąpiony jego izotopem ( lub można też zastąpić w cysteinie jej izotopem).
Frakcjonowanie komórki:
Rozwój mikroskopii elektronowej umożliwił kontrolę morfologicznej jakości i czystości frakcji komórek badanych przez biochemików
Wirowanie, różnicowanie z coraz większym przyspieszeniem pozwala na uzyskanie oddzielnych frakcji komórki.
Etapy:
Wycinki tkanek zostaną rozdarte w homogenizatorze,
Z homogenatu po wirowaniu otrzymuje się osad i nadsącz,
Powtarzana procedura wirowania nadsączu z coraz większą szybkością pozwala otrzymać kolejne osady okładające się z oddzielonych poszczególnych składników cytoplazmy.
Wykład 3.
Mikroskopy.
Teoria de Broglie'a (1924r.) - o strukturze falowej materii i stwierdzenie Brusha (1926r.) - odpowiednio ukształtowane pole elektryczne i magnetyczne. Skupiając wiązkę elektronów może służyć jak soczewka do otrzymania wiernego i powiększonego obrazu. Źródła tych elementów przyczyniły się do wynalezienia i rozwoju mikroskopu elektronowego.
Pierwszy mikroskop elektronowy skonstruowali Marks Knall i Ernest Ruska w 1931r. w Berlinie.
1934r. - następny mikroskop elektronowy skonstruowany został przez Ruskę o zdolności rozdzielczej już 50 nm.
Ernest Ruska (1906-1988r.) - Nagroda Nobla w 1986r. za znalezienie 56 lat wcześniej mikroskopu.
1936r. - powstaje pierwszy handlowy egzemplarz elektronowego mikroskopu firmy Metropolitan Vickers.
1939r. firma Siemens zbudowała mikroskop konstrukcji Borries'a i Ruski o rozdzielczości 2,5 nm. Od tego czasu następowało ulepszanie mikroskopów przez znane firmy, np. Siemens.
1952r. - Palade Porter i Sjostrand rozwinęli metody mikroskopii elektronowej, które pozwoliły po raz pierwszy zobaczyć wiele struktur wielokomórkowych.
Robertson opisał 2-warstwową strukturę błony komórkowej po raz pierwszy oglądaną w mikroskopie elektronowym.
Konstruowanie materiału w mikroskopii elektronowej.
Octan uranylu
Cytrynian ołowiu
Czterotlenek osmu ( utrwalanie)
Podział mikroskopów
MIKROSKOPY ELEKTRONOWE
M. transmisyjny (TEM)
M. skaningowy (SEM)
M. wysokowoltażowy
M. tunelowy skanujący
M. atomowy
M. rentgenowski
W mikroskopie elektronowym wiązkę światła zastępuje wiązka elektronów, soczewki szklane zastąpione są przez soczewki magnetyczne.
Kontrast uzyskuje się stosując substancje zawierające metale ciężkie, które pochłaniają lub rozpraszają elektrony. Działo elektronowe wytwarza elektrony, które są przyspieszane przez wysokie napięcie.
Wiązka przyspieszonych elektronów jest formowana prze uzwojenia soczewek elektromagnetycznych.
M. SEM
Cienka wiązka elektronów przemiata linia po linii powierzchnię oglądanego obiektu. Wybijane z powierzchni wtórne elektrony są zbierane i wzmacniane przez fotopowielacz, a sygnały przetwarzane na monitorze.
Obraz jest trójwymiarowy.
W mikroskopii elektronowej wykonuje się również tzw. repliki : próbę badaną napyla się w napylarce próżniowej cienką warstwą metalu, np. złota, a następnie usuwa oryginalna próbkę i wykonuje obraz repliki (TEM); w SEM nie trzeba usuwać próbki właściwej.
TEM i SEM - można oglądać m.in. płaszczyzny przełomu otrzymane po zastosowaniu metody zamrażania i łamania tkanki (freeze - fracture), czy rytowania (etching)
Można badać rozmieszczenie reakcji enzymatycznych w organellach komórki.
Mikroskopię elektronową można łączyć z autoradiografią (badanie rozmieszczenia znakowanych izotopowo związków w organellach komórki).
Metoda immunocytochemii - polegająca na selektywnym i specyficznym łączeniu się przeciwciał z określonymi antygenami występującymi w komórce.
Przeciwciała ulegają związaniu w tych miejscach, które posiadają właściwy antygen. Powstaje kompleks antygen - przeciwciało uwidoczniony dzięki wyznakowaniu przeciwciał.
Enzymami - metody immunoenzymatyczne
Białkami - zawierającymi metal
Do najczęściej stosowanych znaczników enzymatycznych zaliczamy:
Peroksydazę chrzanową
Fosfatazę zasadową
Cytochrom
Oksydazę glukozową
Białka zawierające metal ciężki.
Ferrytyna - białko o masie cząsteczkowej 600 000 - 700 000 zawiera ok. 23% żelaza. Ma zastosowanie do znakowania m.in. przeciwciał lektyn i awidyny. Próbowano zastosować inne metale ciężkie, np. żelazo, srebro, uran lub rtęć, ale nie znalazły one szerszego zastosowania.
Zastosowanie w immunocytochemii znalazło złoto koloidalne.
Techniki immunocytochemiczne stosowane na poziomie ultrastrukturalnym można podzielić na techniki:
Przed zatopieniem
Po zatopieniu
T. PO ZATOPIENIU T. PRZED ZATOPIENIEM T. BEZ ZATAPIANIA
U t r w a l e n i e t k a n k i
Zatopienie w plastiku
Immunocytochemia Skrawki ultracienkie mrożone
Skrawki ultracienkie Zatopienie w plastiku Immunocytochemia
Immunocytochemia Skrawki ultracienkie
Jeżeli chcemy zachować ultrastrukturę, to przeważnie używamy 3,6 - gluta - aldehyd.
Jeżeli antygenowość - używamy 4% paraformaldehydu.
Wykład 4.
Budowa i funkcje błony komórkowej oraz transport przez błony.
Cechy błony komórkowej:
Grubość 5-7 nm.
Cienka i delikatna
Elastyczna
Model płynnej mozaiki
Półprzepuszczalna -dwie warstwy lipidów stanowią istotę błony i działają jako bariera przepuszczalna
Fosfolipidy poprzetykane cholesterolem, na zewnątrz jest glikokaliks.
Przepuszczalność błony komórkowej - im mniejsza cząsteczka i mniej polarna, tym szybciej dyfunduje (woda i małe cząsteczki niepolarne na drodze prostej dyfuzji).
Jony, cukry, aminokwasy przenoszone przez wyspecjalizowane błonowe białka transportujące.
Funkcje błony komórkowej:
Regulują transport wybranych substancji z i do komórki
Reagują na bodźce chemiczne, termiczne, mechaniczne
Funkcje enzymatyczne, katalizując różne reakcje metaboliczne
Utrzymują równowagę między ciśnieniem osmotycznym wewnątrz i na zewnątrz komórki
Ruch komórki decyduje o jej kształcie
Chronią komórkę przed działaniem czynników fizycznych i chemicznych, a także przed wnikaniem obcych organizmów.
Struktury błonowe w komórce:
ER
Jądro
Peroksysom
Lizosom
Aparat Golgiego
Budowa błony komórkowej:
Składniki błon - głównie lipidy, białka, węglowodory.
Lipidy błonowe zbudowane z hydrofilowej głowy i hydrofobowego ogona (cząsteczki amfipatyczne)
Najliczniejsze to fosfolipidy, w których hydrofilowa głowa (polarna) z resztą cząsteczki połączona jest grupą fosforanową (fosfatydylocholina).
Fosfolipidy błonowe:
Fosfatydylocholina
Fosfatydyloseryna
Fosfatydyloinozytol
Fosfatydyloetanoloamina
Sfingomielina
Ruchliwość fosfolipidów w obrębie dwóch warstw:
Dyfuzja boczna
Dyfuzja rotacyjna
Flip- flop (zachodzi rzadko)
Płynność dwuwarstwy lipidowej zależy od:
Rodzaju ogona węglowodorowego fosfolipidu:
Długość
Stopień nasycenia
Dwuwarstwa jest tym bardziej płynna, im więcej zawiera nienasyconych łańcuchów węglowodorowych
Im ściślejsze i im bardziej regularne jest upakowanie ogonów, tym jest ona bardziej lepka i mniej płynna
Obecność cholesterolu w komórce zwierzęcej (sztywne cząsteczki steroidu wypełniają wolną przestrzeń pomiędzy fosfolipidami.
Płynność błon dla komórki jest ważna cechą:
Umożliwia szybką dyfuzję białek błonowych w dwuwarstwie lipidów i wzajemne oddziaływanie, np. w sygnalizacji komórek
Dzięki płynności możliwe jest dyfuzyjne rozprowadzenie lipidów i białek błonowych, do miejsc, w których są one po swojej syntezie wbudowywane do innych obszarów komórki
Umożliwia fuzję błon ze sobą i wymieszanie ich cząsteczek - to przy podziale komórkowym zapewnia równomierne rozdzielenie tworzących błon cząsteczek pomiędzy komórki potoczne.
Cholesterol (10%) - należy do steroidów, jego rola to uszczelnienie błony w komórkach zwierzęcych, modeluje on płynność błony, brak go u roślin, drożdży i bakterii.
Asymetryczna dwuwarstwa lipidowa - glikolipidy występują tylko w pozacytozolowej części błony, jest rozcieńczony prawie równomiernie w obu warstwach cholesterolu.
Asymetria lipidów ma swój początek w miejscach ich powstawania:
Nowe cząsteczki są syntetyzowane w komórkach przez enzymy błonowe, których substratami są kwasy tłuszczowe dostępne w jednej z monowarstw i tam też zostają
Następnie, aby błona mogła rosnąć jako całość, odpowiednia część cząsteczek zostaje przeniesiona do drugiej monowarstwy ( flipazy - enzymy katalizujące przeniesienie).
Białka błonowe 25-75 % ( u zwierząt ok. 50% masy większości błon), jest ich więcej w błonach struktur aktywnych metabolicznie, większość funkcji błony przepełniona jest przez białka.
Klasyfikacja białka |
|
Funkcja |
b. transportujące |
Pompa Na+ |
Wypompowuje z komórek Na+ i wprowadza jony K+ |
b. wiążące |
Integryny |
Wiąże wewnątrzkomórkowe filamenty aktynowe z białkami substancji zewnątrzkomórkowych |
receptory |
Receptor adrenaliny |
Wiąże adrenalinę i wytwarza sygnał regulujący metabolizm komórkowy |
enzymy |
Cykloza adenylonowa |
Katalizuje wytwarzanie cyklicznego AMP |
Sposoby wiązania białek z dwuwarstwą lipidową - białka transbonowe mogą formować albo α- helisy albo zamkniętą strukturę β. Pewne z nich łącza się poprzez kowalencyjne przyłączenie lipidu lub samego łańcucha węglowodorowego lub poprzez słabe, niekowalencyje wiązanie z innymi białkami:
Każde białko błonowe - ma w błonie niepowtarzalną orientację- jest ona konsekwencją sposobu, w jaki białko jest syntetyzowane i wprowadzane do błony
Białko transbłonowe wystawia do cytozolu zawsze tę samą domenę - mogą być uwolnione z błon tylko w drodze rozerwania dwuwarstwy lipidowej przez detergenty - są to integralne białka błonowe.
Białka błonowe peryferyczne (powierzchniowe) - można je uwolnić z błon
Poprzez zastosowanie łagodnych procedur ekstrakcji - zrywają one oddziaływanie białko - białko, nie naruszając warstwy lipidowej.
Węglowodory błon:
Stanowią 2 - 10%
Występują głównie jako digosacharydy związane kowalencyjnie z białkami ( glikoproteidy) z lipidami błon ( glikolipidy)
Występują tylko na zewnętrznej powierzchni błony jako monosacharydy, galaktoza, glukoza, galaktozoamina, glukozoamina, kwas sialowy
Kwas sialowy odpowiedzialny jest za ujemny ładunek elektryczny powierzchni komórek
Węglowodory odgrywają rolę w rozpoznawaniu innych komórek przez wiązanie się ze swoistymi białkami ich powierzchni
Glikokaliks - zbudowany z bocznych łańcuchów digosacharydów przyłączonych do glikolipidów, glikoprotein błonowych, a także łańcuchów polisacharydowych, włączonych w proteoglikany błonowe; mogą wchodzić w skład, glikoproteiny i proteoglikany wydzielane przez komórki i zaobserwowane na jej powierzchni.
Właściwości glikokaliksu:
Ochrona powierzchni komórki przed uszkodzeniem mechanicznym, chemicznym, przed drobnoustrojami
Digosacharydy i polisacharydy wchłaniają wodę - zapewnia to śliskość powierzchni komórki ( zapobiega zlepianiu się krwinek)
Odgrywają rolę we wzajemnym rozpoznawaniu się komórek ( np. komórki jajowej przez plemnik)
Adhezja
Transport przez błony:
Bierny
Transport lub dyfuzja ułatwiona
Transport aktywny
Endo i egzocytoza
Transport (dyfuzja) bierny:
Ruch cząsteczek ze środowisk o większym stężeniu do środowiska o mniejszym stężeniu
Nie wymaga nakładu energii
Przykłady transportowanych cząsteczek: O2, CO2, H2O, węglowodory, mocznik, etanol, glicerol
Szybkość cząsteczek:
Naładowanych od różnicy stężeń i ładunku elektrycznego
Nienaładowanych zależy od różnicy stężeń
Transport ułatwiony:
Kanały (białka kanałowe)
Odbywa się przez przenośniki ( śródbłonowe białka nośnikowe)
Śródbłonowe białka nośnikowe:
Cząsteczka białka śródbłonowego jest podobna do enzymów
Cząsteczka białka transportującego ulega zmianie konformacji
Wiążą się przejściowo z substratem i transportuje go przez błony zgodnie z gradientem
Rodzaje białek śródbłonowych:
Antyportalne - transportują jony i cząsteczki w przeciwnych kierunkach
Symportalne - cząsteczki transportujące jednocześnie jony i cząsteczki w tym samym kierunku
Uniportalne - cząsteczki transportujące jeden rodzaj jonów lub cząsteczek w jednym kierunku
Białka kanałowe:
Mogą być otwarte stale lub zamknięte i otwierać się czasowo
Otwarte przepompowują jony i cząsteczki zgodnie z gradientem stężeń i gradientem elektrochemicznym (ładunkiem)
Przejściowe otwieranie kanałów białkowych może dokonywać się przez:
Związanie ligandów (np. neuromadiatora)
Zmiany ładunku elektrycznego błony
Odmianami białek kanałowych są połączenia typu neksus ( synapsy elektryczne)
Transport aktywny:
Odbywa się wbrew gradientowi stężeń, wymaga energii z hydrolizy ATP
Wewnątrz komórki stężenie jonów Na+ wynosi do 10 mM, a stężenie K+ ok. 140 mM
Na zewnątrz komórki stężenia te wynoszą 140 mM dla jonów Na+ i 5 mM dla jonów K+
W utrzymaniu różnicy stężeń tych jonów po obu stronach błon komórkowych biorą udział białka śródbłonowe dwóch rodzajów:
kompleks enzymatyczny nazywany pompą jonową ( pompa sodowo- potasowa jest enzymem adezynotrójfosfatazą ATP-azą) - aktywnie pompuje jony przez błonę.
Białko kanałowe dla jonów K+ - bierny przepływ jonów K+ zgodnie z ich gradientem stężeń
Na+ na zewnątrz, a K+ do wnętrza (przeciwko gradientowi stężeń)
Utrzymuje niskie stężenie Na+ w komórce i K+ na zewnątrz , co jest warunkiem istnienia potencjału elektrycznego błony ( ma to wpływ na pobudliwość komórki i przewodzenie impulsów)
Istnienie różnych stężeń Na+ i K+ między wnętrzem komórki i ich otoczeniem, jest źródłem energii dla transportu do komórki, np. glukozy z aminokwasów
Białko enzymatyczne ATP-aza Ca2+
W cytozolu ludzkim istnieje niskie stężenie Ca2+ w stosunku do otoczenia
Zwiększa stężenie Ca w cytozolu, powoduje gwałtowna aktywację kinaz oraz doprowadza do wielu czynności komórkowych, np. skurcz komórek mięśniowych
Różnica stężenia utrzymywana jest dzięki stałemu i czynnemu wypompowywaniu jonów Ca2+ z cytozolu do otoczenia komórki lub do zbiorników gładkiej siateczki śródplazmatycznej
Utrzymanie gradientów stężeń jonów ( głównie Na, K, H, Ca) między wnętrzem, a otoczeniem komórki, także cytozolem, a strukturami błoniastymi komórki
Regulacji objętości komórek
Transportu substratów przez błonę
Przewodzenia impulsów wzdłuż błony
Fagocytoza - pochłanianie stałych makrocząsteczek
Ultrafagocytoza - pochłanianie stałych cząstek submikroskopowych
Pinocytoza - pochłanianie składników płynnych
Transcytoza - transport płynów lub cząsteczek z pominięciem lizosomów
Na drodze konstytucyjnej - wydzielanie ciągłe, niezależne od bodźców zewnętrznych
Na drodze regulowanej - wydzielanie okresowe, zachodzące po wpływem stymulacji.
Cząsteczki adhezyjne - są to białka obecna na powierzchni komórek
Receptory błonowe - białka odbierające informacje ze środowiska zewnątrzkomórkowego i przekazujące je do odpowiednich faktorów w komórce
Ektoenzymy, np. ekto-ATP-aza.
Oddziaływania poszczególnych komórek ze sobą
Oddziaływania komórek macierzą zewnątrzkomórkową
Pozwalają na migracje komórek
Konstrukcja tkanek i morfologeneza
Integralność komórek w hodowli in vitro
Regeneracji tkanek
Patologii tkanek
Białka CJM - budujące wyspecjalizowane połączenia pomiędzy komórkami
Cząsteczki adhezyjne z podłożem SAM lub MAM, cząsteczki zaliczane do SAM zaangażowane są w połączenie z macierzą zewnątrzkomórkową
Cząsteczki adhezji międzykomórkowej C-CAM
Potranslacyjnych modyfikacji białek adhezyjnych (głównie ma charakter glikozylacji)
Dystrybucji tych cząsteczek między obszarami powierzchni komórek.
Kadheryny
Selektyny
Białka podobne do naskórkowego czynnika wzrostu
Integryny
Cząsteczki należące do nadrodziny immunoglobulin
Adhezji komórek do podłoża
Migracji leukocytów przez ściany naczyń krwionośnych
Agregacji płytek krwi
Fibronektyną
Lamininą
Włóknikiem
Czynnikiem von Willenbranda
Różnymi typami kolagenu
Witronektyną
Z białkami adhezyjnymi innych komórek należących do nadrodziny immunoglobulin.
E - śródbłonkowa pośredniczy w adhezji neutrofilów podczas procesu zapalnego
L - obecne na powierzchni leukocytów, granulocytów i monocytów; bierze udział w ich adhezji do śródbłonka
Q - transbłonowe białka płytek krwi regulujące sekrecje m. in. czynników krzepnięcia
L- selektyny - reszty kwasu sialowego
P - selektyny - antygen Lewis X
E - selektyny - antygen Lewis X z przyłączoną resztą kwasu sialowego.
umomorulina (E-kadheryna)- nabłonkowa
kadheryna N (neuralna)
kadheryna P (łożyskowa)
R- kadheryna
T- kadheryna
Klasyczne
Atypowe
Desmosomowe
Protokadheryny
W przylegających komórkach ich odcinki aminoterminalne odpowiadają za oddziaływania kadheryna - kadheryna
Domeny cytoplazmatyczne tych białek są zasocjowane z filamentami aktynowymi
Desmogleiny
Desmokaliny
Białka transbłonowe, zawierające powtórzenia w sekwencji podobne do EGF
Są mało poznane, uczestniczące we wczesnej embriogenezie
Funkcje tych białek dotyczą rozpoznawania powierzchni komórkowych
Podstawową ich jednostka strukturalną jest domena składająca się z ok. 100 aminokwasów, przypomina domeny immunoglobulin ( nazwano ją C2)
Białka podrodziny N - CAM - najlepiej poznanym z tej rodziny jest białko N- CAM - zawiera w obrębie części zewnątrzkomórkowej oprócz domen C2, także szeregi powtórzeń domen fibroneutyny
Białka podrodziny CEA- najbardziej znany antygen CEA ( znaczenie diagnostyczne)
Białko podrodziny L1 - uczestniczą one we wzroście i ukierunkowaniu komórek nerwowych
Białka podrodziny CD2 i podrodzina białek niesklasyfikowanych
Odkryta w latach 40-tych XX w. przez Claude'a i Porter'a. Odkryli oni złożony trójwymiarowy system błon elementarnych.
Występuje we wszystkich komórkach eukariotycznych z wyjątkiem erytrocytów ssaków.
W obrębie tej samej komórki występuje w różnych formach morfologicznych. (pęcherzyki, ryneczki, cysterny). Średnica 30 - 300 nm.
Błony siateczki śródplazmatycznej mają większą zawartość białek i fosfolipidów, niż błona komórkowa, a zawierają mniej cholesterolu i fingomieliny. Brak warstwy glikoprotein.
W błonie gładkiej jest więcej cholesterolu.
Spełnia ona zupełnie inne funkcje i ma po obu stronach identyczny ładunek.
Wzajemny stosunek siateczki ziarnistej i gładkiej jest zmienny i zależy od rodzajów procesów metabolicznych zachodzących w komórce.
Rozbudowa siateczki ziarnistej jest obserwowana w komórkach syntezujących białka przeznaczone do wydalenia.
Na rybosomach siateczki syntezowane są również białka ja budujące.
Jej składniki lipidowe syntezowane są w ścianach całej siateczki niezależnie od jej podziału na część ziarnistą i gładką.
Na terenie siateczki zachodzą procesy utleniania i hydroksylacji, a także procesy detoksykacji z udziałem cytochromu P450.
Uczestniczy w syntezie i magazynowaniu potrzebnych do życia składników. Stanowi podporę dla substancji koloidalnych cytoplazmy podstawowej.
Przyjmuje określoną formę morfologiczną w zależności od rodzaju komórek.
Włókna mięśniowe - siateczka gładka tworzy charakterystyczny układ wokół sarkomerów.
Włókna nerwowe - siateczka ziarnista występuje blisko jądra w postaci równolegle ułożonych cystern, tworząc tzw. tigroid.
Cysterny siateczki pokryte są od zewnątrz rybosomami.
Zbudowana jest z osmofilnych błon o grubości 5-6 nm. zawierających specyficzne białko - ryboforynę - odpowiedzialną przyłączenie się rybosomów.
Głównym jej zadaniem jest synteza i modyfikacja białek eksportowych.
Rybosomy łączą się z siateczką podjednostką większą. Syntezowane przez nie białko jest magazynowane w kanałach siateczki - aparat Golgiego.
Tworzy połączenia z siateczka ziarnistą. Różni się od niej budową i funkcją.
Powstaje z siateczki ziarnistej.
Zaangażowana w syntezę kwasów tłuszczowych: cholesterolu i steroidów.
W procesie glikogenolizy syntezuje i gromadzi tłuszcze obojętne, a także trigliceryny.
Jest miejscem syntezy obu warstw lipidowych błony komórkowej.
Dobrze rozwinięta jest w komórkach wątroby (zwłaszcza w miejscach magazynowania glikogenu), kory nadnerczy.
Znacznikami enzymatycznymi gładkiej siateczki są: 5- nukleotydaza i glukozo - 6 - fosfataza.
We włóknach mięśniowych jest dobrze rozwinięta. Zwana jest siateczką sarkoplzmatyczną (tzw. system T).
W przebiegu mitozy siateczka endoplazmatyczna ulega fragmentacji w stopniu zróżnicowanym w różnych typach komórek.
W komórkach o dużym nasileniu fragmentacji siateczka endoplazmatyczna rozpada się na pęcherzyki o zmiennej średnicy od 0,3 - 1,0 nm.
Powstałe z fragmentacji siateczki pęcherzyki podejmują różne funkcje, specyficzne dla mitozy.
Odkryte w 1953r. przez Robinson'a w komórkach fasoli, a wkrótce potem w komórkach zwierzęcych.
Nieobłonione.
Występują jako pojedyncze rybosomy lub w grupach - polirybosomy, obie formy związane z siateczką śródplazmatyczną.
Występują w organellach i jąderku.
Masa rybosomu określana jest w daltonach ( kilka milionów).
Wolne rybosomy (rozproszone w cytoplazmie) występują rzadko i są forma nieaktywną (ok. 10%). Około 90% tworzy polirybosomy i jest to forma aktywna.
W zależności od lokalizacji wytwarzają one określone białka. Wolne polirybosomy - białka komórkowe. Związane polirybosomy - białka sekrecyjne, np. kolagen i hormony.
Komórki o intensywnym procesie syntezy białka, np. komórki plazmatyczne trzustki i wątroby. Zawierają one ok.75% rybosomów w postaci polirybosomów.
Mniejsza podjednostka jest spłaszczona i można ją porównać do czapeczki nałożonej na podjednostkę większą. Dopasowuje ona cząstki tRNA do kodomów mRNA.
Tylko duża podjednostka łączy się z błonami siateczki śródplazmatycznej i katalizuje powstawanie wiązań peptydowych.
Spoistość podjednostek - jony magnezowe.
Przy rozpoczęciu syntezy białka obie podjednostki łączą się ze sobą obejmując mRNA zwykle w pobliżu jego końca 5'.
Pojedyncze rybosomy w ciągu 1s. w komórkach eukariotycznych przyłączają 2 aminokwasy, a w prokariotycznej ok. 20 aminokwasów.
Podczas syntezy aminokwasy są łączone w określonej kolejności w polipeptydy przy udziale rRNA, tRNA i mRNA.
Ulegają dysocjacji po syntezie.
Skład rybosomów - 75 - 90% rRNA, które tworzy rdzeń rybosomów.
Białka wchodzące w skład rybosomów są heterogenne. Większość to białka kwaśne, część zasadowa lub obojętna znajduje się na powierzchni rybosomów.
Występują lipidy i węglowodany w ilości śladowej.
Rybosom zawiera także enzym RNA-zę w postaci nieaktywnej oraz kationy Mg2+ , Ca2+.
Często występują zasady mające zmetylować grupę OH- lub NH2 oprócz typowych zasad.
Rok 2000 - ustalenie pełnej struktury rybosomów. Decyduje rRNA, a nie białka.
O całościowej strukturze rybosomów,
O zdolności umieszczania tRNA na mRNA,
O funkcjach katalitycznych.
W procesie tworzenia rybosomów biorą udział 4 kwasy nukleinowe i ponad 80 różnych białek. Proces ten wymaga współdziałania 100 różnych genów zasadniczych i szeregu genów o charakterze modularnym.
U eukariotów podjednostki powstają w jądrze przez asocjacje świeżo zsyntezowanego rRNA z białkami rybosomowymi (powstałymi w cytoplazmie).
Następnie podjednostka eksportowana jest do cytoplazmy.
Kamil Golgi (1898r.) odkrył w komórkach nerwowych.
Diktiosom - składa się z 5 -8 spłaszczonych cystern ułożonych względem siebie równolegle z zachowaniem odległości 20 -30 nm.
Licznie nagromadzone pęcherzyki 30- 50 nm.
Duże wakuole o średnicy od 500 - 3000 nm. Zawierają materiał bezstrukturalny lub ziarnisty.
Posiada kształt półksiężycowaty, po stronie wypukłej znajduje się powierzchnia formowania ( cis), a po stronie wklęsłej powierzchnia dojrzewania (trans).
W pobliżu powierzchni dojrzewania (trans) obserwuje się wakuole zagęszczające o średnicy 500 - 3000 nm. oraz mniejsze pęcherzyki okryte.
W sąsiedztwie powierzchni formowania (cis) znajdują się pęcherzyki o średnicy 30-50nm zwane pęcherzykami transportującymi.
Pod względem struktury i składu chemicznego błona aparatu Golgiego stanowi element przejściowy między błoną ER ziarnistą, a błoną komórkową.
W obrębie aparatu Golgiego zachodzi synteza glikoprotein pokrywająca powierzchnię komórek zwierzęcych, a w komórkach roślinnych synteza pektyn i hemicelulozy.
Bierze udział w wydalaniu produktów komórek wydzielniczych (wydzielina zostaje zagęszczona i upakowana w błony).
Skład enzymatyczny błon cystern układu Golgiego jest zróżnicowany, na jego powierzchni formowania występują enzymy charakterystyczne dla siateczki śródplazmatycznej (m.in. glukozo-6- fosfataza).
Następnie enzymy charakterystyczne dla aparatu Golgiego: transferazy glikozylowe.
Na powierzchni dojrzewania występują już enzymy typowe dla błony komórkowej (ATP-azy, 5-nukleozydaza).
Dużą zawartość fosfolipidów
Sfingomieliny
Cholesterolu i jego estrów
Triglicerydy
Enzymy takie jak:
Pirofosfataza tiaminowa i glikozylotransferazy
Fosfataza kwaśna i inne enzymy lizosomowe
Synteza glikoprotein glikolipoprotein
Uczestniczy w wydzielaniu białek i lipoprotein
Miejsce powstawania lizosomów pierwotnych.
Uczestniczy w wewnątrzkomórkowej regulacji wodnej.
Zagęszcza substancje, np. proteoglikany.
Zmniejszenie liczby diktiosomów (temp. powyżej 30˚C i poniżej 0˚C)
Rozproszenie aparatu Golgiego w komórce (kolchicyna i winkrystyna)
Hamowanie aktywności glikozylotransferazy (puromycyna i cyklofosfamid)
Powiększenie aparatu Golgiego (hormony- noradrenalina)
Novikoff i współpracownicy wysunęli hipotezę, że jest to sąsiadujący z aparatem Golgiego fragment siateczki gładkiej uczestniczący w produkcji lizosomów.
Stanowi gładkościenną cysternę zlokalizowaną po stronie wewnętrznej aparatu Golgiego i przedłuża się w system kanałów o szczególnym poligonalnym układzie.
Kryterium odróżniającym aparat Golgiego od GERL jest reakcja na fosfatazę kwaśną przy braku reakcji na ATP-azę.
Ostatnio uważa się, że GERL może stanowić zmodyfikowaną cysternę aparatu Golgiego.
Mechanizm działania pompy sodowo- potasowej:
Pompa Ca2+:
Znaczenie pomp jonowych:
Istnienie gradientów stężeń przyczynia się do:
Endocytoza:
Klatryna - białko uczestniczące w endocytozie - opłaszcza dołki, które wciągane są do cytoplazmy. W momencie powstawania dołków pęcherzyków, klatryna i białka wiążące powracają na powierzchnię komórki, gdzie tworzą nowe dołki.
Egzocytoza - sekrecja cząsteczek, np. białka są transportowane z ER poprzez, np. aparaty Golgiego do błon komórkowych (lub poprzez różne endosomy) do lizosomów.
Wykład 5.
Białka powierzchni komórkowej:
Cząsteczki adhezyjne regulują procesy:
Od ekspresji różnych białek adhezyjnych przez komórki nowotworowe zależy ich zdolność do inwazyjności i tworzenia przerzutów
Adhezja komórek ma kluczowe znaczenie dla takich procesów jak:
Adhezja wykazuje również ścisły związek z dynamiką cytoszkieletu. Spektryna wraz z aktyną tworzy sieć, która jest połączona z błoną komórkową przez związanie przynajmniej dwóch białek łączących (np. ankiryny i białka 4.1. z dwoma rodzajami białek transbłonowych)
Lokalizacja spektryny w błonie erytrocytu.
Do niedawna białka uczestniczące w adhezji dzielono na:
Obecnie wszystkie te białka określa się mianem CAM ze względu na znaczne podobieństwo między nimi. Jest to ważna grupa białek - zaburzenia związane z białkami CAM są podstawą wielu stanów chorobowych, np. białko ICAM-1 ma znaczenie jako receptor dla białek rhinowirusów wywołujących większość infekcji górnych dróg oddechowych.
Regulacja adhezji komórek odbywa się na drodze:
W adhezji komórkowej uczestniczą białka takich rodzin jak:
Pierwsze trzy grupy uczestniczą w oddziaływaniu pomiędzy komórkami, integryny głównie służą do wiązania się z macierzą międzykomórkową.
Integryny (białka transbłonowe) są to glikoproteiny łączące błonę komórkową z macierzą.
Pośredniczą w:
Występują one w postaci heterodimerów składających się z podjednostki α i β. Każdy z łańcuchów posiada krótką karboksylową część śródbłonkową, dużą aminotermalną, część zewnątrzkomórkową oraz część śródbłonkową.
Adhezja komórkowa mediowana przez integryny jest zależna od jonów Ca2+, które zostają związane przez specjalne domeny w obrębie części pozakomórkowej łańcucha α.
W obrębie cytoplazmatycznej części łańcucha β znajdują się domeny, które mogą oddziaływać z filamentami aktyny poprzez białka łączące (talina lub winkulina). Wykryto 14 podjednostek α i 8 β - 20 różnych kombinacji.
Każdy łańcuch α może łączyć się z łańcuchem β, jednak nie wszystkie z możliwych kombinacji występuje in vivo. W zależności od budowy łańcucha β można integryny podzielić na kilka grup tzw. rodzin. Najlepiej poznane są integryny z rodzin β1, β2, β3.
Integryny z rodziny β1 określane jako VLA- późnej aktywacji, pojawiają się na limfocytach T dopiero po 2-4 tygodniach po stymulacji tych komórek, występują przede wszystkim na leukocytach i rozpoznają sekwencję aminokwasową: arginina- glicyna- kwas asparaginowy. Sekwencja ta występuje m.in. w fibroneutynie i lamininie i umożliwia leukocytom wędrówkę po organizmie.
Integryny z rodziny β2 pełnią funkcję głównie w procesach przylegania leukocytów do komórek śródbłonka, fibroblastów, keratynocytów. Wiążą także niektóre składniki dopełniacza i fibrynogen, ułatwiając w ten sposób reakcje immunologiczne.
Integryny z rodziny β3 zaangażowane są w procesy przylegania różnych typów komórek (m.in. nowotworowych i w trakcie morfogenezy) do śródbłonka i składników macierzy pozakomórkowej.
Ligandami dla integryny P3 są: czynnik von Willenbranda, witronektyna, fibrynogen.
Wiążą się one z białkami macierzy pozakomórkowej m. in. Z:
Integryny β3 mogą stymulować funkcje cytobójcze limfocytów T i NK - przyczyniając się do eliminacji komórek zdolnych do metastazy.
Selektyny -uczestniczą w początkowym etapie adhezji. Jest to rodzina białek adhezyjnych pomiędzy leukocytami, a komórkami śródbłonka - transbłonowe białko typu lektyn wiążące reszty węglowodorowe digocukrów: glikoprotein, których funkcja zależy od jonów wapnia.
Posiadają rozbudowaną aminoterminalną część zewnątrzkomórkową i o wiele mniej poznane części transbłonową i cytoplazmatyczną.
Znane są jedynie 3 selektyny:
Ligandy dla:
Selektyny mogą zatrzymać także krążące komórki nowotworowe w tkankach docelowych, np. selektyna P wiąże się z komórkami raka płuc, sutka, okrężnicy i umożliwia ich interakcje z trombocytami i powstanie agregatów komórkowych.
Kadheryny - białka typu CAM - będące transbłonowymi glikoproteinami z wysoką zawartością kwasu sialowego. Należy do nich 12 różnych białek, np.:
Składają się z części pozakomórkowej, z pojedynczej części transbłonowej oraz z karboksyterminalnej części cytoplazmatycznej.
Region na powierzchni jest najdłuższy, domena transbłonowa - najkrótsza.
Kadheryna na powierzchni jednej komórki wiąże się z taką samą kadheryną na powierzchni drugiej komórki - wiązanie homofilowe.
Białka te są zdolne do zapewnienia adhezji komórkom nawet przy braku innych cząsteczek adhezyjnych z pozostałych rodzin.
Kadheryny poprzez białka cytoplazmatyczne kateniny (α, β,γ) łączą się z filamentami cytoszkieletu:
Podział kadheryn:
Kadheryny klasyczne:
Kadheryny desmosomowe: transbłonowe składniki desmosomów:
Zaburzenie ekspresji lub obniżenie aktywności kadheryn wiąże się ze wzrostem inwazyjności komórek nowotworowych pochodzenia nabłonkowego.
Słaba ekspresja kadheryny E w: raku żołądka, sutka, stercza.
Zmieniona aktywność kadheryny może wynikać z mutacji genów kodujących te cząsteczki.
Geny kodujące kadheryny zaliczane są do grupy tzw. supresorów inwazyjności nowotworowej.
Białka adhezyjne podobne do naskórkowego czynnika wzrostu:
Białko adhezyjne z rodziny immunoglobulin:
Na podstawie podobieństw sekwencji białek adhezyjnych z nadrodziny immunoglobulin wyróżnia się pięć podrodzin:
Wykład 6.
Organella komórkowe
Siateczka endoplazmatyczna:
Siateczka endoplazmatyczna szorstka ( RER).
Siateczka endoplazmatyczna gładka.
Dynamika przemian siateczki endoplazmatycznej ziarnistej.
Rybosomy.
Duża i mała podjednostka.
Trzy miejsca wiązania:
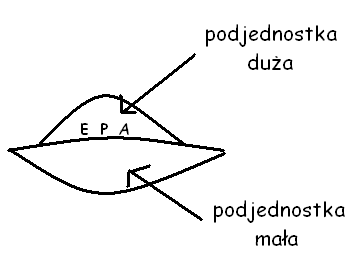
A- aminoacylotRNA
P - peptydylotRNA
E - exit - tworzone przez rRNA
Aparat Golgiego.
Budowa chemiczna aparatu Golgiego:
We frakcjach aparatu Golgiego stwierdzono 60% białek i 40% lipidów oraz wykazano:
Rola aparatu Golgiego:
Zmiany morfologiczne i czynnościowe:
GERL (Golgi endoplasmatic reticulum-lyzosom complex):
1
Wyszukiwarka
Podobne podstrony:
lekarski i rok ii sem, I rok, I rok, gieldy, II semestr, inne
Szkockość a Braveheart, I rok MGR, II semestr, Antropologia społeczna
Toffler-trzecia fala, I rok MGR, II semestr, Antropologia społeczna
Modele i obliczenia mechanizmów wciągarki, AGH WIMIR Mechanika i Budowa Maszyn, Rok III, II semestr,
Stalowe - temat 25 -wyboczenie - projekt 4, AGH WIMIR Mechanika i Budowa Maszyn, Rok III, II semest
Prawo rzeczowe, I rok prawa, II semestr, Prawo rzymskie
Zobowiązania, I rok prawa, II semestr, Prawo rzymskie
Tworzenie i funkcjonowanie europejskiej spółki akcyjnej ART, I rok MGR, II semestr, Prawo rynku wewn
tezy na egz.z rzymu, I rok prawa, II semestr, Prawo rzymskie
Kolasiński DOC, I rok MGR, II semestr, Analiza ekonomiczno-finansowa UE
Wykład 5 - Genetyka człowieka, ⇒ NOTATKI, II semestr, Biomedyczne podstawy rozwoju (wykład)
ściaga automatyka wykład, Uczelnia, Energetyka PŚK, II semestr, PODSTAWY AUTOMATYKI, sem2 Podstawy A
FINANSE WYKLADY 2012, WZR UG, II semestr, Finanse - dr Sebastian Susmarski, dr Kamila Bielawska, Wyk
Wyklad 9-10, Studia Mgr, II semestr mgr, Mechanistyczne metody wymiarowania nawierzchni
wejściówki II semestr histo
GF w3 2.03, Geologia GZMiW UAM 2010-2013, I rok, Geologia fizyczna, Geologia fizyczna - wykłady, 01,
więcej podobnych podstron