Rok akademicki: 2003/2004 Rok studiów: II Kierunek studiów: Metalurgia Nr grupy: 4 |
Temat: Przewodnictwo elektryczne roztworów elektrolitów |
Data wykonania ćwiczenia: 2003.12.12
|
Nr zespołu: 11 |
Pastucha Krzysztof Papierz Grzegorz |
Ocena |
Cel ćwiczenia:
Celem ćwiczenia jest poznanie podstawowych pojęć i zależności dotyczących przewodnictwa elektrycznego wodnych roztworów elektrolitów, metod pomiaru przewodnictwa oraz zastosowania wyników pomiarów przewodnictwa.
Wykonanie ćwiczenia:
Wyznaczanie stopnia dysocjacji i stałej dysocjacji kwasu octowego (CH3COOH). Sporządzamy po 5 roztworów, z których każdy następny jest dwukrotnie rozcieńczony w stosunku do poprzedniego:(NaCl, HCl, CH3COOH, CH3COONa). Mierzymy następnie ich przewodnictwo za pomocą konduktometru CC-311.
Miareczkowanie konduktometryczne.
Do zlewki odmierza się zadaną przez prowadzącego ilość CH3COOH . Dokonujemy pomiarów każdorazowo po dodaniu 0,5 cm3 NaOH, po przekroczeniu punktu równoważnikowego miareczkowania wykonujemy jeszcze 3 pomiary.
Opracowanie wyników pomiarów:
Stopień dysocjacji i stała dysocjacji kwasu octowego:
1. Wyniki pomiarów przewodnictwa właściwego wpisujemy do tabeli:
Stężenie |
NaCl |
HCl |
CH3COONa |
CH3COOH |
||||
[mol/dm3] |
[S/m] |
[Sm2/wal] |
[S/m] |
[Sm2/wal] |
[S/m] |
[Sm2/wal] |
[S/m] |
[Sm2/wal] |
0,1 |
1,036 |
0,01036 |
3,913 |
0,0391 |
0,713 |
0,00713 |
0,052 |
0,00052 |
0,05 |
0,553 |
0,0112 |
2,010 |
0,0402 |
0,395 |
0,00792 |
0,039 |
0,00077 |
0,025 |
0,289 |
0,0117 |
0,983 |
0,0393 |
0,209 |
0,00835 |
0,027 |
0,00107 |
0,0125 |
0,147 |
0,0118 |
0,540 |
0,0432 |
0,105 |
0,00843 |
0,018 |
0,00147 |
0,00625 |
0,076 |
0,0121 |
0,257 |
0,0411 |
0,055 |
0,00885 |
0,014 |
0,00219 |
2. Dla każdego z roztworów obliczamy przewodnictwo równoważnikowe wg wzoru:
![]()
; ![]()
gdzie:
Λr - przewodnictwo równoważnikowe [Sm2/wal]
κ - przewodnictwo właściwe [S/m]
cr - stężenie równoważnikowe roztworów [wal/dm3], (cr=cm.)
Wyniki obliczeń przewodnictwa równoważnikowego wpisujemy do powyższej tabeli.
3. Na podstawie otrzymanych wyników rysujemy wykresy zależności κ=f(c) oraz Λr=f(c).
4.Dla roztworów HCl, NaCl, CH3COONa obliczamy metodą najmniejszych kwadratów równanie prostych Λr=f(![]()
), sporządzamy wykresy zależności Λr=f(![]()
) i zaznaczamy na wykresie graniczne przewodnictwa równoważnikowe.
Roztwory NaCl:
Roztwory CH3COONa:
NaCl |
|
c0,5 |
[Sm2/wal] |
0,316 |
0,01036 |
0,224 |
0,0112 |
0,158 |
0,0117 |
0,112 |
0,0118 |
0,079 |
0,0121 |
Równanie prostej regresji:
y = -0,0071x + 0,0127
współczynnik b=0,0127 zatem Λ°NaCl=0,0127 Sm2/wal;
b) Roztwory HCl:
HCl |
|
c0,5 |
[Sm2/wal] |
0,316 |
0,0391 |
0,224 |
0,0402 |
0,158 |
0,0393 |
0,112 |
0,0432 |
0,079 |
0,04112 |
Równanie prostej regresji:
y = -0,0118x + 0,0427
współczynnik b=0,0427 zatem Λ°HCl=0,0427 Sm2/wal;
CH3COONa |
|
c0,5 |
[Sm2/wal] |
0,316 |
0,00713 |
0,224 |
0,00792 |
0,158 |
0,00835 |
0,112 |
0,00843 |
0,079 |
0,00885 |
Równanie prostej regresji:
y = -0,0068x + 0,0093
współczynnik b=0,0093 zatem Λ°CH3COONa=0,0093 Sm2/wal;
5.Na podstawie otrzymanych Λ° oraz reguły Kohlrauscha obliczamy graniczne przewodnictwo równoważnikowe kwasu octowego.
Λ°CH3COOH=Λ°HCl +Λ°NaCl -Λ°CH3COONa
Λ°CH3COOH=0,0427 +0,0127 -0,0093=0,0461 Sm2/wal;
6.Korzystając z danych zawartych w tabeli (λ°+ oraz λ°−) obliczamy teoretyczne wartości granicznych przewodnictw równoważnikowych roztworów.
λ°+Na=0,00501 Sm2/wal;
λ°+H=0,03498 Sm2/wal;
λ°−Cl=0,007635 Sm2/wal;
λ°−CH3COO=0,00409 Sm2/wal;
Λ°HCl=λ°+H + λ°−Cl =0,0426 Sm2/wal;
Λ°NaCl =λ°−Cl + λ°+Na =0,0126 Sm2/wal;
Λ°CH3COONa=λ°+Na + λ°−CH3COO =0,0091 Sm2/wal;
Λ°CH3COOH=λ°+H + λ°−CH3COO =0,0391 Sm2/wal;.
Na podstawie uzyskanych wartości obliczamy stopień dysocjacji i stałą dysocjacji kwasu octowego dla badanych stężeń, sporządzamy wykres zależności stopnia dysocjacji od stężenia kwasu.
Stopień dysocjacji i stałą dysocjacji obliczamy ze wzorów:
![]()
; ![]()
Wyniki obliczeń wpisujemy do tabeli: Λ°CH3COOH=0,0461 Sm2/wal;
![]()
; ![]()
[…]
Stężenie |
CH3COOH |
|
Kdys |
[mol/dm3] |
[Sm2/wal] |
|
|
0,1 |
0,00052 |
0,01128 |
0,00001272 |
0,05 |
0,00077 |
0,016703 |
0,00001395 |
0,025 |
0,00107 |
0,02321 |
0,00001347 |
0,0125 |
0,00147 |
0,031887 |
0,00001271 |
0,00625 |
0,00219 |
0,047505 |
0,00001410 |
8.Na podstawie zależności:
![]()
wyznaczamy graficznie wartość stałej dysocjacji, prowadząc przez punkty prostą regresji;
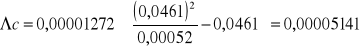
; ![]()
*c |
1/ |
0,00005141 |
1923,077 |
0,00003786 |
1298,701 |
0,00002613 |
934,5794 |
0,00001779 |
680,2721 |
0,00001304 |
456,621 |
Równanie prostej regresji jest następujące:
y=3*10-8x+7*10-7
a=Kdys*Λ°2=3*10-8
b=-Kdys*Λ°=-7*10-7
a więc:
Kdys=b2/a =1,63*10-5; ΛCH3COOH=b/-Kdys=0,0429 Sm2/wal
9.Wnioski:
Wzrost stężenia powoduje wzrost przewodnictwa właściwego roztworów. Natomiast w przypadku przewodnictwa równoważnikowego jest odwrotnie, wzrost stężenia powoduje spadek przewodnictwa równoważnikowego. Stopień dysocjacji kwasu zależy od stężenia.
Jak widać na wykresach zależność Λr=f(![]()
) jest prostoliniowa tylko dla mocnych roztworów elektrolitów, natomiast w przypadku roztworu słabego kwasu przy małych stężeniach, niewielki spadek stężenia powoduje nagły wzrost przewodnictwa. Wiąże się to z faktem wzrostu stopnia dysocjacji kwasu octowego ze spadkiem stężenia, co jest widoczne na odpowiednim wykresie. Stała dysocjacji kwasu octowego wynosi ok. 2*10-6.
Błędy wyznaczonych przez nas wartości mogą być wynikiem niedokładnych pomiarów, lub nieustalonych warunków w laboratorium.
Miareczkowanie konduktometryczne.
1.Na podstawie dokonanych pomiarów przewodnictwa wykonanych dla roztworu HCl wykonujemy wykres zależności przewodnictwa od objętości dodawanego roztworu miareczkującego NaOH.
Z wykresu odczytujemy objętość zużytej podczas miareczkowania NaOH (punkt równoważnikowy).
Dane dla HCl
V NAOH [ml] |
K[S/m] |
0 |
, |
0,5 |
1,725 |
1 |
1,657 |
1,5 |
1,548 |
2 |
1,447 |
2,5 |
1,342 |
3 |
1,208 |
3,5 |
1,091 |
4 |
1,036 |
4,5 |
0,962 |
5 |
0,883 |
5,5 |
0,826 |
6 |
0,777 |
6,5 |
0,716 |
7 |
0,675 |
7,5 |
0,568 |
8 |
0,546 |
8,5 |
0,503 |
9 |
0,441 |
9,5 |
0,392 |
10 |
0,337 |
10,5 |
0,297 |
11 |
0,319 |
11,5 |
0,359 |
12 |
0,386 |
2. Dla roztworu kwasu solnego punkt równoważnikowy jest dla 10,5 cm3 NaOH.
Na podstawie podanych objętości obliczamy stężenie badanego roztworów ze wzoru:
![]()
Vx=20 ml
Dla HCl:
![]()
Wnioski:
Na podstawie wykresów zależności przewodnictwa od objętości roztworu miareczkującego, odczytując objętość w punkcie minimum lub przegięciu możemy obliczyć stężenie badanego roztworu.
1
Wyszukiwarka
Podobne podstrony:
Chemia fizyczna - Ćw. 18 - Elektroliza, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Chemia a ochrona środowiska - referat, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Katalizatory - referat, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Ogniwagal.wzor, Chemia Fizyczna, chemia fizyczna- laborki rozne, Ogniwa
wielkości molowe-odp na pytania, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Ściąga z chemii (Na, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Ściąga na zaliczenie laboratorium u mgr. Pacławskiego, Chemia Fizyczna, chemia fizyczna- laborki roz
Grupy główne i podgrupy układu okresowego pierwiastków, Chemia Fizyczna, chemia fizyczna- laborki ro
Ściąga do metali z hutnictwa i nie tylko, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Wodorotlenosole, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
ogniwa chemiczne, Chemia Fizyczna, chemia fizyczna- laborki rozne, Ogniwa
Napięcie powierzchniowe1, Chemia Fizyczna, chemia fizyczna- laborki rozne, NAPIĘCIE POWIERZCHNIOWE
Ściąga z chemii (C, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Liczby przenoszenia, Chemia Fizyczna, chemia fizyczna- laborki rozne, Liczby przenoszenia
okładka-sb lab 15, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
oddana, Chemia Fizyczna, chemia fizyczna- laborki rozne, pH
!!!!!!!!destylacja, Chemia Fizyczna, chemia fizyczna- laborki rozne, destylacja
więcej podobnych podstron