Sprawozdanie z ćw. III
PRZEWODNICTWO
ELEKTROLITÓW
CEL: Wykorzystanie przewodnictwa elektrolitów
do wyznaczenia parametrów chemicznych
substancji.
Zespół III gr. A:
Anna Dziubczyńska
Beata Dzięcioł
Paweł Celmer
Tomasz Biczysko
Wrocław, dnia 11-10-2006
I: Wyznaczanie stałej naczynka konduktometrycznego
MHCl = 39,102 +35,453 = 74,555 k=![]()
Cm = 0,01 mol/dm3![]()
![]()
Cm = m/ MxV
V = 0,1 dm3 ![]()
![]()
= 0,1413 S/m m= CmxMxV
m= 0,01 mol/dm3x 74,555gx 0,1 dm3 = 0,074555g
![]()
KCl - zmierzona konduktometrycznie wynosi 2,74 mS
k=![]()
k=![]()
k = 51,5693 m
II: pomiar przewodnictwa wody wodociągowej i wody destylowanej przy pomocy konduktometru
κdestylowana woda = 31,3 μS
κwodociągowa woda = 1356 μS
Ćwiczenie I:
Pomiar przewodnictwa równoważnikowego słabego elektrolitu:
λ = κ/k κ = kxλ
Λ= κ/1000xC
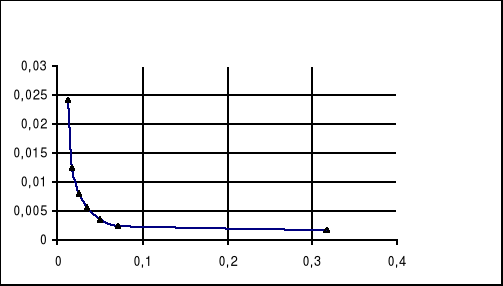
Tabela 1. Pomiary przewodnictwa równoważnikowego słabego elektrolitu.
C [mol/dm3] |
λ [S] x10-4 |
κ [S/m] |
Λ [Sm2/mol] |
|
C |
0,01007 |
3,27 |
0,0169 |
0,00168 |
C/2 |
5,035x10-3 |
2,27 |
0,0117 |
0,00233 |
C/4 |
2,518x10-3 |
1,75 |
0,00903 |
0,00357 |
C/8 |
1,259x10-3 |
1,35 |
0,00696 |
0,00550 |
C/16 |
6,294x10-4 |
0,970 |
0,00500 |
0,00794 |
C/32 |
3,147x10-4 |
0,760 |
0,00392 |
0,0125 |
C/64 |
1,573x10-4 |
0,730 |
0,00377 |
0,0240 |
Wykres 1.
Ćwiczenie II
Wyznaczanie przewodnictwa równoważnikowego mocnego elektrolitu
λ = κ/k κ = kxλ
Λ= κ/1000xC
Tabela 2. Pomiary przewodnictwa równoważnikowego mocnego elektrolitu.
C [mol/dm3] |
λ [S] x10-4 |
κ [S/m] |
Λ [Sm2/mol] |
|
C |
0,006 |
5,03 |
0,0259 |
0,00432 |
C/2 |
0,003 |
2,63 |
0,0136 |
0,00453 |
C/4 |
0,0015 |
1,63 |
0,00841 |
0,00561 |
C/8 |
0,00075 |
1,00 |
0,00516 |
0,00688 |
C/16 |
0,000375 |
0,710 |
0,00366 |
0,00976 |
Metodą najmniejszych kwadratów wyznaczamy graniczne przewodnictwo równoważnikowe badanego mocnego elektrolitu.
Wykres zależności Λ = f(C1/2)
WYNIK OBLICZEŃ
a = 0,0824
b = 0,0098 b=Λ0 = 0,00984 [Sm2/mol]
Λ = - axc1/2 +Λ0
Cwiczenie III
Wyznacznie iloczynu rozpuszczalności soli trudno rozpuszczalnej
Λ0 = 208x10-4 [Sm2/mol] podane przez asystenta
λH20 9 μS
Pomiary przewodnictwa roztworu soli trudno rozpuszczalnej ( odstępy 3 minuty)
1 - 165μS
2 - 170μS średnia 169,33μS
3 - 173μS
Tabela 3. Pomiary w wyznaczaniu iloczynu rozpuszczalności
λ [S] |
κroztwór [S/m] |
κwoda [S/m] |
κsól [S/m] |
C [mol/l] |
L [mol2/l2] |
1,6933x10-4 |
8,7322 x10-3 |
4,6412 x10-4 |
8,2681x10-3 |
3,975x10-4 |
1,580x10-7 |
Przewodnictwo właściwee roztworu
κ = kxλ κ = 51,5693m x (1,6933x10-4 ) = 8,7322 x10-3
przewodnictwo właściwe wody destylowanej
λ = 9x10-6
κ = kxλ κ = 51,5693 x 9x10-6 = 4,6412 x10-4
Przewodnictwo właściwe soli to różnica między przewodnictwem całego roztworu a przewodnictwem właściwym wody destylowanej
κ = κr-ru - κH2O
κ = 8,7322x10-3 - 4,6412x10-4 = 8,2681x10-3
Stężenie soli wyznacza się z wzoru:
Λ= κ/1000xC C =κ/Λx1000
C = 8,2681x10-3/208x10-4 x1000
C = 3,975x10-4
Iloczyn rozpuszczalności wyznacza się z wzoru
L = C2
L= (3,975x10-4)2 = 1,580x10-7
Cwiczenie IV
Wyznaczanie stałej dysocjacji słabego elektrolitu metoda konduktometryczną i przewodnictwa granicznego
λ = κ/K κ = Kxλ
Λ= κ/1000xC
Tabela 4. Pomiary przewodnictw słabego elektrolitu.
C [mol/dm3] |
λ [S] x10-4 |
κ [S/m] |
Λ [Sm2/mol] |
|
C |
0,01005 |
2,92 |
0,0151 |
0,00150 |
C/2 |
0,005025 |
2,06 |
0,0106 |
0,00211 |
C/4 |
0,0025125 |
1,55 |
0,00800 |
0,00318 |
C/8 |
0,00125625 |
1,22 |
0,00629 |
0,00501 |
C/16 |
0,000628125 |
0,920 |
0,00474 |
0,00755 |
Wykres zależności 1/Λ=f(CxΛ)
1/Λ = [(CxΛ)/(KxΛ0)]+ 1/Λ0
A= 1/( KxΛ0) K= 1/(a x Λ0) K=1/(52,992867,25x0,00859) K=2,1968x10-6
B = 1/Λ0 Λ0= 1/b Λ0=-0,00859
Zespół III gr. A
1
κ - przewodnictwo właściwe.
λ - przewodnictwo
k - stała naczynka
κ - przewodnictwo wł.
λ - przewodnictwo
k - stała naczynka
C - stężenie molowe elektrolitu
Λ - przewodnictwo równoważnikowe
κ - przewodnictwo wł.
λ - przewodnictwo
k - stała naczynka
C - stężenie molowe elektrolitu
Λ - przewodnictwo równoważnikowe
κ - przewodnictwo wł.
λ - przewodnictwo
k - stała naczynka
C - stężenie molowe elektrolitu
Λ - przewodnictwo równoważn
Λ0 - przew graniczne
L - iloczyn rozpuszczalności
κ - przewodnictwo właściwe.
λ - przewodnictwo
k - stała naczynka
C - stężenie molowe elektrolitu
Λ - przewodnictwo równoważnikowe
Λ0 - przewodnictwo graniczne
L - iloczyn rozpuszczalności
C1/2
Λ
y = -0,0824x + 0,0098
0
0,002
0,004
0,006
0,008
0,01
0,012
0
0,02
0,04
0,06
0,08
0,1
y =52992867,25 x - 116,37
0
100
200
300
400
500
600
700
800
0
0,000005
0,00001
0,000015
0,00002
Wyszukiwarka
Podobne podstrony:
sprawko z przewodnictwa poprawione, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawoz
sprawozdanie z ćw.7, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyczn
SPRAWOZDANIE Z farmako, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizy
sprawko z ćwiczenia 11, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizy
Napiecie powierzchniowe, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fiz
janka, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizycznej 1, Sprawozd
Wspolczynnik podzialu, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyc
SPRAWOZDANIE Z ĆWICZENIA NR 2, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania
sprawozdanie cw.8 do parafiny, far, II rok III sem, biochemia, lab
Farmakokinetyka, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizycznej 1
Adsorpcja, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizycznej 1, Spra
inwersja sacharozy, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyczne
sprawko z refraktometrii, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fi
SPRAWOZDANIE Z ĆWICZENIA 4, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z
Przewodnictwo elektrolitów, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z
Ogniwa galwaniczne, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyczne
więcej podobnych podstron