Numer ćwiczenia : 3 |
Temat ćwiczenia : Liczby przenoszenia |
Data wykonania : 17.03.2003 |
Grupa : 4 Zespół : B |
Wykonawcy ćwiczenia : Szymon Kowalski Tomasz Pierzyński |
Ocena : |
Cel ćwiczenia
Celem ćwiczenia jest teoretyczne i praktyczne opanowanie metody pomiaru liczb przenoszenia oraz poznanie zasad działania kulometrów. Wprowadzenie
Przepływ prądu przez elektrolit polega na wędrówce w polu elektrycznym jonów obydwu znaków, które niosą ładunek dodatni w stronę katody zaś ujemny w stronę anody. Szybkość poruszania się jonów zależy przede wszystkim od spadku potencjału elektrycznego przeliczonego na jednostkę odległości między elektrodami (gradient potencjału), sił wzajemnego oddziaływania elektrycznego jonów, mas i średnic jonów, stopnia ich solwatacji oraz od temperatury i lepkości cieczy.
Ładunek elektryczny q przenoszony przez jony jednego rodzaju w danej objętości elektrolitu jest proporcjonalny do liczby jonów w jednostce objętości (czyli stężenia c), ładunku jonu z oraz ruchliwości u definiowanej jako prędkość jonu w polu o jednostkowym gradiencie potencjału, czyli:
![]()
gdzie: k - współczynnik proporcjonalności.
Całkowity ładunek elektryczny Q przenoszony przez wszystkie jony obecne w roztworze jest równy:
![]()
![]()
Współczynnik proporcjonalności k jest jednakowy dla wszystkich jonów. Część ładunku przenoszona przez jony i-tego rodzaju wynosi zatem:
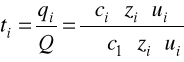
Ułamek ten nazywany jest liczbą przenoszenia jonów danego rodzaju w danym elektrolicie i oznaczany symbolem t.
Suma liczb przenoszenia wszystkich jonów obecnych w roztworze jest równa jedności. W najprostszym przypadku, gdy w roztworze elektrolitu znajdują się kationy K+ i aniony A¯ pochodzące z dysocjacji jednej tylko substancji, odpowiednie liczby przenoszenia wynoszą:
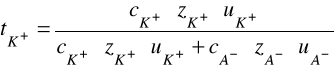
oraz
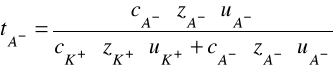
Wartości iloczynów ![]()
i ![]()
dla tego typu elektrolitu są jednakowe, zatem:
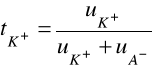
oraz
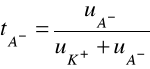
![]()
W celu doświadczalnego wyznaczenia wartości liczb przenoszenia stosuje się metodę zaproponowaną przez Hittorfa, w której oznacza się zmiany stężenia elektrolitu w pobliżu elektrod. Badania tego typu dają dobre wyniki w przypadku roztworów rozcieńczonych, w których zaniedbywalne są takie zjawiska, jak wzajemne oddziaływanie jonów oraz zmiany stężeń wywołane np. konwekcją, dyfuzją czy mechanicznym mieszaniem.
Rozpatrzmy przykład elektrolizy roztworu azotanu(V) srebra AgNO3 pomiędzy elektrodami srebrnymi:
anoda Ag / roztwór AgNO3 / katoda Ag.
Na elektrodach zachodzą reakcje:
Anoda (+): Ag0 →Ag+(aq)+ e- (utlenianie)
Katoda (-): Ag+ (aq) + e-→ Ag0 (redukcja)
Liczba przenoszenia jonów srebra w tym roztworze wynosi 0.45 zaś jonów azotanowych 0.55. Jeżeli przez roztwór przepłynie ładunek równy stałej Faraday'a to w przestrzeni anodowej pojawi się 1 gramorównoważnik jonów srebra wskutek rozpuszczania się (utleniania) anody a jednocześnie wywędruje 0.45 gramorównoważnika tych jonów do przestrzeni katodowej. W tym samym czasie do przestrzeni anodowej przywędruje 0.55 gramorównoważnika jonów azotanowych. Sumarycznie ilość azotanu srebra w przestrzeni anodowej wzrasta o 0.55 gramorównoważnika.
W przestrzeni katodowej ubywa na skutek reakcji elektrodowej (redukcji) 1 gramorównoważnik jonów srebra oraz przybywa 0.45 gramorównoważnika tych jonów. Ilość jonów azotanowych zmniejsza się wskutek migracji o 0.55 gramorównoważnika. W związku z tym w przestrzeni katodowej ilość azotanu srebra zmniejsza się o 0.55 gramorównoważnika.
W celu oznaczenia liczb przenoszenia jonów niezbędna jest znajomość całkowitego ładunku przepływającego przez elektrolit. Ładunek ten mierzymy przy użyciu prostych przyrządów zwanych kulometrami połączonych szeregowo z elektrolizerem. Pomiar polega na oznaczeniu produktów elektrolizy zachodzącej w kulometrze. Do najpopularniejszych i najdokładniejszych można zaliczyć kulometry jodkowy oraz srebrowy. W pierwszym przypadku oznacza się produkty reakcji wydzielania jodu z jodku potasu KI na elektrodzie platynowej poprzez zmiareczkowanie tio(II)siarczanem(VI) sodu Na2S2O3. W drugim oznacza się ilość srebra, która przeszła do roztworu w trakcie elektrolizy azotanu(V) potasu KNO3 przy użyciu anody ze srebra.
Część praktyczna
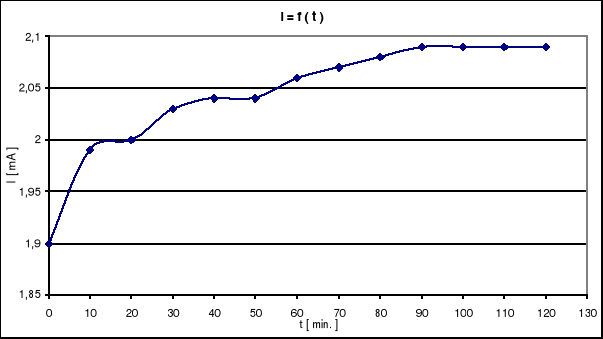
Wykreślam wykres zależności natężenia prądu od czasu podczas elektrolizy
t [ min. ] |
I [ mA ] |
0 10 20 30 40 50 60 70 80 90 100 110 120 |
1,9 1,99 2,00 2,03 2,04 2,04 2,06 2,07 2,08 2,09 2,09 2,09 2,09 |
Wyznaczam liczby przenoszenia
Analizowany roztwór |
Objętość zużytego 0,02 M NH4SCN |
|||
|
V1 [ ml ] |
V2 [ ml ] |
V3 [ ml ] |
Vśr [ ml ] |
Wyjściowy roztwór AgNO3 ( 10 ml ) |
6,4 |
6,5 |
6,2 |
6,366 |
Katolit ( 10 ml ) |
5,9 |
5,8 |
5,8 |
5,833 |
Anolit ( 10 ml ) |
6,6 |
6,6 |
6,7 |
6,633 |
Roztwór AgNO3 z kulometru ( 10 ml ) |
1,6 |
1,5 |
1,4 |
1,5 |
Całkowita objętość anolitu : 101,6 ml
Całkowita objętość katolitu : 101,3 ml
Całkowita objętość roztworu z kulometru : 61 ml
Obliczam objętość NH4SCN potrzebną do zmiareczkowania całości anolitu :
- przed elektrolizą , b = 6,366 * 10,16 = 64,67856 ml - wartość średnia
- po elektrolizie , c = 6,633 * 10,16 = 67,39128 ml - wartość średnia
a - objętość NH4SCN zużyta do zmiareczkowania roztworu z kulometru
a = 1,5 * 6,1 = 9,15 ml - wartość średnia
A ) wyznaczam liczby przenoszenia jonów na podstawie wyników miareczkowania anolitu
tAg+ = qAg+ / ( qAg+ + qNO3- ) = ( b + a - c ) / a
tAg+ = ( 64,67856 + 9,15 - 67,39128 ) / 9,15 = 0,70
tNO3- = 1 - tAg+
tNO3- = 1 - 0,70 = 0,30
Obliczam błędy standardowe średnich wartości objętości NH4SCN zużytego do zmiareczkowania :
a) całego roztworu z kulometru :
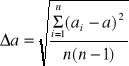
= 0,352
b) całości anolitu przed elektrolizą :
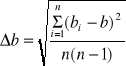
= 0,896
c) całości anolitu po elektrolizie :
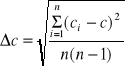
= 0,339
n= 3 - liczba pomiarów ( ilość miareczkowań )
Obliczam niepewności pomiarowe( na podstawie wyników miareczkowania anolitu ) metodą różniczki zupełnej:
![]()
![]()
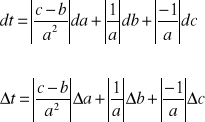
- błąd bezwzględny
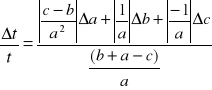
- błąd względny
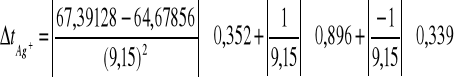
tAg+ = 0,146 = tNO3- - błąd bezwzględny
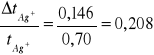
- błąd względny
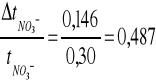
- błąd względny
B ) wyznaczam liczby przenoszenia jonów na podstawie wyników miareczkowania katolitu
Obliczam objętość NH4SCN potrzebną do zmiareczkowania całości katolitu :
- przed elektrolizą , b = 6,366 * 10,13 = 64,48758 ml
- po elektrolizie , c = 5,833 * 10,13 = 59,08829 ml
tAg+ = qAg+ / ( qAg+ + qNO3- ) = ( c - b + a ) / a
tAg+ = ( 59,08829 - 64,48758 + 9,15 ) / 9,15 = 0,41
tNO3- = 1 - tAg+
tNO3- = 1 - 0,41 = 0,59
Obliczam błędy standardowe średnich wartości objętości NH4SCN zużytego do zmiareczkowania :
całego roztworu z kulometru :
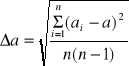
= 0,352
całości katolitu przed elektrolizą :
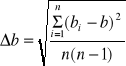
= 0,893
całości katolitu po elektrolizie :
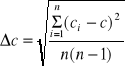
= 0,338
Obliczam niepewności pomiarowe( na podstawie wyników miareczkowania katolitu ) metodą różniczki zupełnej :
![]()
![]()
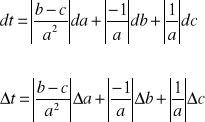
- błąd bezwzględny
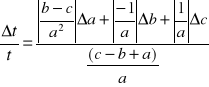
- błąd względny
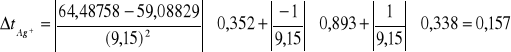
tAg+ = 0,157 = tNO3- - błąd bezwzględny
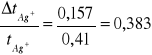
- błąd względny
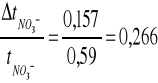
- błąd względny
WNIOSKI :
Wyznaczone doświadczalnie liczby przenoszenia różnią się od liczb przenoszenia zawartych w tablicach ( wartości tablicowe : tAg+ = 0,472 , tNO3- = 0,528 ) .
W przypadku anolitu różnica ta jest spowodowana niedokładnym sposobem miareczkowania anolitu .
Natomiast w przypadku katolitu wpływ na wyznaczenie liczb przenoszenia miał fakt , że większość igiełek srebra , które się wydzieliły na katodzie wpadły do katolitu podczas spuszczania tego roztworu z naczynia elektrolitycznego do zlewki . To spowodowało , że wyznaczone doświadczalnie liczby przenoszenia różnią się od wartości tablicowych .
Wyszukiwarka
Podobne podstrony:
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Chemia a ochrona środowiska - referat, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Katalizatory - referat, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Ogniwagal.wzor, Chemia Fizyczna, chemia fizyczna- laborki rozne, Ogniwa
wielkości molowe-odp na pytania, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Ściąga z chemii (Na, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Ściąga na zaliczenie laboratorium u mgr. Pacławskiego, Chemia Fizyczna, chemia fizyczna- laborki roz
Grupy główne i podgrupy układu okresowego pierwiastków, Chemia Fizyczna, chemia fizyczna- laborki ro
Ściąga do metali z hutnictwa i nie tylko, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Wodorotlenosole, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
ogniwa chemiczne, Chemia Fizyczna, chemia fizyczna- laborki rozne, Ogniwa
Napięcie powierzchniowe1, Chemia Fizyczna, chemia fizyczna- laborki rozne, NAPIĘCIE POWIERZCHNIOWE
elektrolity, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Ściąga z chemii (C, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
okładka-sb lab 15, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
oddana, Chemia Fizyczna, chemia fizyczna- laborki rozne, pH
!!!!!!!!destylacja, Chemia Fizyczna, chemia fizyczna- laborki rozne, destylacja
Wodorosole, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
więcej podobnych podstron