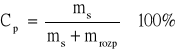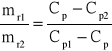1.SPORZĄDZANIE ROZTWORÓW O OKREŚLONYM STĘŻENIU
Roztwory są to układy jednofazowe (fizycznie jednorodne) dwu- lub wielo-składnikowe, których składniki nie reagują ze sobą, a ich stężenia nie podlegają prawom stosunków stałych i wielokrotnych i mogą zmieniać się w sposób ciągły. Umownie rozpuszczalnikiem nazywa się ten składnik roztworu, który w porównaniu z pozostałymi jest w dużym nadmiarze.
1.1. STĘŻENIA ROZTWORÓW
Najczęściej stosowane są dwa sposoby określania stężeń roztworów: stężenie procentowe i molowe.
Stężenie procentowe
Stężenie procentowe określa ilość gramów substancji rozpuszczonej, zawartej w 100 gramach roztworu. Stężenie procentowe (Cp) jest stosunkiem (w procentach) masy substancji rozpuszczonej (ms) do masy całego roztworu (m), którą przyjmuje się za 100% .
|
(1) |
lub
|
(2) |
gdzie: mrozp - masa rozpuszczalnika.
Stężenie molowe
Stężenie molowe roztworu określa liczbę moli substancji rozpuszczonej w 1dm3 roztworu. Stężenie molowe (Cm.) jest stosunkiem liczby moli substancji rozpuszczonej (n) do ogólnej objętości roztworu (Vr), wyrażonej w dm3.
Zależność tą przedstawia wzór
![]()
(4)
liczbę moli substancji rozpuszczonej n można obliczyć wg wzoru:
![]()
(5)
gdzie: ms - masa substancji rozpuszczonej, M - masa molowa substancji rozpusz- czonej.
Zatem
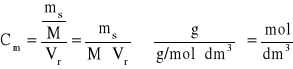
(6)
Przeliczanie stężeń
Aby przeliczyć stężenie molowe (Cm) na procentowe (Cp) i odwrotnie, konieczna jest znajomość gęstości roztworu (dr) i wzór substancji rozpuszczonej w celu obliczenia jej masy molowej (M).
Korzystając ze wzorów definiujących stężenia procentowe (1) i molowe (4):
![]()
do wzoru (4) podstawia się wzór (5) i przekształcony wzór (3)
![]()
otrzymując zależność:
![]()
do którego podstawia się masę substancji (ms) ze wzoru (1) otrzymując:
|
(7) |
Wzór ten umożliwia obliczenie stężenia molowego przy znanym stężeniu procentowym. Po przekształceniu otrzymuje się wzór (8), umożliwiający obliczenie stężenia procentowego przy znanym stężeniu molowym:
|
(8) |
Mieszanie roztworów
Po rozcieńczeniu roztworu czystym rozpuszczalnikiem albo po zmieszaniu roztworów tej samej substancji o różnych stężeniach otrzymuje się nowy roztwór, w którym ilość substancji rozpuszczonej jest sumą jej ilości w roztworach wyjściowych o stężeniach Cp1 i Cp2 , natomiast stężenie wypadkowe roztworu będzie inne. Masę substancji obliczmy korzystając ze wzoru (1):
![]()
Jeżeli masa roztworu o stężeniu Cp1 wynosi mr1 , a roztworu o stężeniu Cp2 mr2 to wówczas mamy:
![]()
(9)
Masa roztworu końcowego jest równa sumie mas roztworów wyjściowych:
mr = mr1 + mr2
stąd
mr1 ⋅ Cp1 + mr2 ⋅ Cp2 = (mr1 + mr2) Cp. (10)
Z tej zależności można obliczyć stężenie roztworu otrzymanego po zmieszaniu, masy roztworów oraz ich objętości (po uwzględnieniu gęstości). Można również obliczyć stosunek wagowy w jakim należy zmieszać roztwory o stężeniach Cp1 i Cp2 aby otrzymać roztwór o stężeniu Cp:
|
(11) |
Jest to tzw. reguła mieszania, którą można przedstawić w postaci „schematu krzyżowego”:
Cp1 Cp. - Cp2 - części wagowych roztworu o stężeniu Cp1
Cp (12)
Cp2 Cp1 - Cp - części wagowych roztworu o stężeniu Cp2
Po lewej stronie schematu wpisuje się stężenia roztworów wyjściowych (Cp1 i Cp2), w środku stężenie sporządzanego roztworu (Cp), zaś po prawej stronie różnice stężeń (odejmuje się wartość niższą od wyższej) jako liczby określające stosunek wagowy roztworów. Przy sporządzaniu określonej ilości gramów roztworu, należy tę ilość podzielić na części pozostające do siebie w stosunku określonym różnicą stężeń.
Regułę mieszania i schemat krzyżowy można również wykorzystać do obliczania stężeń roztworów o znanych stężeniach molowych (Cm1 i Cm2) i ich objętościach (V1 i V2). Liczba moli substancji w roztworze końcowym, zgodnie ze wzorem (4):
n = Cm ⋅ V
jest równa sumie liczb moli w poszczególnych roztworach:
n = n1 + n2
Cm1 ⋅ V1 + Cm2 ⋅ V2 = Cm ⋅ V
Zakładając, że V1 + V2 = V, otrzymuje się:
Cm1 ⋅ V1 + Cm2 ⋅ V2 = Cm (V1 + V2)
oraz
|
(13) |
Powyższą regułę mieszania dla roztworów o stężeniach molowych można również przedstawić w postaci „schematu krzyżowego”:
Cm1 Cm1 - Cm2 - części objętościowych roztworu o stężeniu Cm1
Cm (14)
Cm2 Cm1 - Cm - części objętościowych roztworu o stężeniu Cm2
WYKONANIE ĆWICZENIA
1. Przygotowanie roztworu o określonym stężeniu procentowym
W otrzymanym zadaniu należy obliczyć masę substancji i masę rozpuszczalnika, koniecznych do przygotowania danego roztworu. Po sprawdzeniu obliczeń przez prowadzącego zajęcia, należy odważyć obliczoną masę substancji i rozpuścić ją w określonej objętości rozpuszczalnika (wody destylowanej).
3. Przygotowanie roztworu o określonym stężeniu molowym
W otrzymanym zadaniu należy obliczyć masę substancji konieczną do sporządzenia roztworu. Po sprawdzeniu obliczeń przez prowadzącego zajęcia, należy odważyć obliczoną masę substancji, rozpuścić ją w niewielkiej ilości wody destylowanej w zlewce, przelać roztwór do kolby miarowej o odpowiedniej objętości i dopełnić roztwór wodą destylowaną do kreski.
4. Rozcieńczanie roztworów
W otrzymanym zadaniu należy obliczyć objętość kwasu i wody, koniecznych do przygotowania roztworu kwasu o danym stężeniu. Po sprawdzeniu obliczeń przez prowadzącego zajęcia, należy do obliczonej objętości wody wlewać obliczoną objętość kwasu.
UWAGA! Kwas należy dodawać ostrożnie, małymi porcjami, pod wyciągiem |
Przykładowe obliczenia:
Przykład 1
Ile gramów wodorotlenku sodu potrzeba do przygotowania 3 dm3 10% roztworu NaOH? Gęstość tego roztworu wynosi 1,11 g/ cm3.
R o z w i ą z a n i e
I sposób
Masę roztworu można obliczyć, korzystając z definicji gęstości (d):
|
(3) |
mr = Vr ⋅ dr = 3000 cm3 ⋅ 1,11 g/cm3 = 3330 g
10 % obliczonej masy roztworu stanowi wodorotlenek sodu. Stąd ilość wodorotlenku sodu potrzebna do przygotowania 3 dm3 10% roztworu wynosi: ![]()
II sposób
Ze wzoru (1) można wyznaczyć masę substancji (ms)
![]()
![]()
Odpowiedź: Do przygotowania roztworu potrzeba 333g NaOH.
Przykład 2
Ile gramów siarczanu (VI) miedzi (II) CuSO4 ⋅ 5 H2O należy odważyć, aby przygo-tować l kg 8% roztworu?
R o z w i ą z a n i e
Ze wzoru (l) można wyznaczyć masę substancji (ms)
![]()
![]()
Ta masa substancji będzie potrzebna do przygotowania roztworu z soli bezwodnej (CuSO4). W przypadku korzystania z soli uwodnionych, należy uwzględnić cząsteczki wody, korzystając z mas molowych związków: M![]()
= 160 g/mol, M![]()
= 250g/mol. Ilość uwodnionego siarczanu (VI) miedzi (II) zawierającą odpowiednią ilość soli bezwodnej (80 g) można obliczyć z proporcji:
![]()
![]()
Odpowiedź: Do przygotowania l kg 8% roztworu CuSO4, należy odważyć 125 g CuSO4 ⋅ 5 H2O .
Przykład 3.
Sporządzić 100 cm3 roztworu węglanu sodowego (Na2CO3) o stężeniu 0,5 mol/dm3.
R o z w i ą z a n i e
Masa molowa Na2CO3 wynosi ![]()
korzystając ze wzoru
![]()
obliczamy ms:
ms = cm⋅M⋅Vr = 0,5 mol/dm3⋅106 g/mol⋅0,1 dm3 = 5,3 g
Odpowiedź: Do sporządzenia roztworu należy odważyć 5,3 g węglanu sodowego.
Przykład 4
Jaką objętość 96% kwasu siarkowego(VI) o gęstości dr = 1,84 g/cm3 należy użyć do przygotowania 1 dm3 roztworu o stężeniu 0,5 mol/dm3.
R o z w i ą z a n i e
Masa molowa M![]()
= 98 g/mol korzystając ze wzoru:
![]()
obliczamy ms:
ms = cm⋅M⋅Vr = 0,5 mol/dm3⋅98 g/mol⋅1 dm3 = 49 g
Ponieważ dysponujemy 96% roztworem kwasu siarkowego(VI), a nie czysta substancją należy obliczyć w ilu gramach tego kwasu znajduje się 49 g H2SO4.
m r96% = ![]()
Objętość roztworu H2SO4 o stężeniu 96% oblicza się uwzględniając jego gęstość
Vr 96% =![]()
Odpowiedź: Do sporządzenia roztworu należy użyć 27,74 cm3 96% kwasu H2SO4
1
7
Wyszukiwarka
Podobne podstrony:
Sporządzanie roztworów o określonym stężeniu molowym i procentowym, Studia, Semestr II, Chemia, Labo
SPORZĄDZANIE ROZTWORÓW O ZNANYCH STĘŻENIACH
Sporządzenie roztworów o zadanym stężeniu molowym z soli uwodnionych posiadających intensywne zabar
Stężenia roztworów, UWM Weterynaria, Chemia
Wykład 2. Roztwory i stężenia, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
R.Rodzaje stężeń roztworów, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
Określenie stężenia roztworu metodą kolorymetryczną (‘’kroplową’’)
R.Sporządzanie roztworów molowych, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
Jakie jest stężenie jonów wodorotlenkowych w roztworze jeżeli wiadomo, Chemia nieorganiczna zadania
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
Równowaga w roztworach elektrolitów, NAUKA, chemia, lab
stezen2, chemia
reakcje w roztworach wodnych, Nauka, CHEMIA, Szkoła, Chemia ogólna
ISE powtorka z chemii, ISE ZADANIA Przeliczanie stezen roztworow, Przeliczanie stężeń roztworów
3 Sporzadzanie roztworow o zna Nieznany (2)
stezen1, chemia
sporządzanie roztworów
Rozdział mieszanin i roztworów, Biotechnologia, Semestr 1, Chemia ogólna, Egzamin
więcej podobnych podstron