
UNIWERSYTET ZIELONOGÓRSKI
WYDZIAŁ INŻYNIERII LĄDOWEJ I ŚRODOWISKA
INSTYTUT INŻYNIERII ŚRODOWISKA
Zakład Technologii Wody, Ścieków i Odpadów
Ćwiczenia laboratoryjne
z Odnowy Wody
USUWANIE FOSFORANÓW PRZEZ
KOAGULACJĘ WAPNEM
Marta Żukowska
Adam Pluta
Sławomir Ławniczak
Gr.45 b
1. PODSTAWY TEORETYCZNE
W procesie koagulacji ścieków są usuwane zanieczyszczenia organiczne i
nieorganiczne, o rozdrobnieniu koloidalnym, oraz zawiesiny, a także częściowo
substancje rozpuszczone. Koagulację w procesach odnowy wody stosuje się w celu
zmniejszenia mętności oraz zawartości związków fosforowych, a także związków
organicznych mierzonych wskaźnikami ChZT, BZT5, OWO.
W procesie koagulacji występują dwie fazy: destabilizacji i flokulacji.
Faza destabilizacji występuje bezpośrednio po dodaniu czynnika koagulującego.
Mechanizm destabilizacji polega na:
Obniżeniu potencjału elektrokinetycznego,
Dehydratacji,
Utlenieniu koloidów ochronnych.
Faza flokulacji obejmuje reakcje fizyczne, które pod wpływem ruchów Browna
powodują powstawanie kłaczków. Trudne jest ustalenie momentu rozpoczęcia
flokulacji po dodaniu koagulanta. Część chemiczna procesu jest zakończona po czasie
0,1 s a wielkość kłaczka wynosi wówczas ok. 10-6 m. Podczas flokulacji dochodzi do
zwiększenia rozmiarów kłaczka do 10-3 m. Wapno jest najpopularniejszym koagulantem stosowanym w odnowie wody, jego zaletą jest dokładność dawkowania oraz to, że nie zwiększa zasolenia ścieków (przeciwnie do soli glinu i żelaza). Dobre efekty usuwania zanieczyszczeń ze ścieków daje także koagulant dolomitowy.
W zależności od pH wyróżniamy:
koagulację małymi dawkami wapna (LLP) dla pH 9.5 - 10.5,
koagulację dużymi dawkami wapna (HLP) dla pH 11.0 - 11.5.
Idea oczyszczania ścieków polega na wykorzystaniu koagulacyjnych i adsorpcyjnych właściwości wodorotlenku magnezowego Mg(OH)2.
Podczas koagulacji wapno reaguje ze związkami wapnia i magnezu:
Ca(OH)2 + CO2 = CaCO3¯ + H2O
Ca(OH)2 + Ca(HCO3)2 = 2CaCO3¯ + 2H2O LLP
Ca(OH)2 + Mg(HCO3)2 = MgCO3¯ + CaCO3¯ + 2H2O
Ca(OH)2 + MgCO3 = Mg(OH)2¯ + CaCO3¯ HLP
Gdy magnez wchodzi w skład twardości niewęglanowej, wówczas zachodzi jego
wymiana na wapń:
Ca(OH)2 + Mg2+ = Mg(OH)2¯ + Ca2+¯
Znaczące wytrącanie Mg(OH)2 występuje przy pH>10,5 i wraz ze wzrostem pH oraz
temperatury maleje jego rozpuszczalność.
Koagulacja wapnem z wytrąceniem magnezu składa się z dwóch etapów:
- do pH~10.5 - wiązanie CO2, dawka wapna zależna jest od kwasowości i
zasadowości ogólnej,
- pH>10.5 - wzrost jonów OH-, wytrącenie Mg(OH)2 do galaretowatego osadu,
całkowite wytrącenie następuje przy pH 11.2 - 11.5
5 Ca(OH)2 + 3PO4-3 = Ca5OH(PO4)3¯ + 9OH-
3 Ca(OH)2 + 2PO4-3 = Ca3(PO4)2¯ + 6OH-
4 Ca(OH)2 + 3PO4-3 + H2O = Ca4H(PO4)3¯ + 9OH
Procesy towarzyszące koagulacji wapnem:
usuwanie fosforanów - na drodze chemicznego strącania a także przez
koagulację i adsorbcję,
ortofosforany - wytrącają się w postaci Ca3(PO4)2 lub Ca5OH(PO4)3 rzadziej w
postaci Ca4H(PO4)3,
polifosforany - usuwa się przez adsorpcję i strącanie wapnem,
fosforany w postaci koloidów - usuwa się przez koagulację (HLP),
klarowanie ścieków - zależy od zasadowości oraz ilości CaCO3 i Mg(OH)2,
usuwanie związków organicznych - poprzez adsorpcję na CaCO3 i Mg(OH)2,
dezynfekcja wirusów i bakterii - koagulacja dużymi dawkami wapna,
usuwanie metali - całkowite wytrącenie.
2. CEL ĆWICZENIA
Celem przeprowadzonego ćwiczenia było określenie optymalnej dawki wapna w oparciu o obliczony stopień obniżenia zawartości fosforanów.
3. WYKONANIA ĆWICZENIA
Wykonane ćwiczenie laboratoryjne polegało na dawkowaniu wapna do wcześniej przygotowanych 1-litrowych prób ścieków tak by pH roztworów było odpowiednio równe:
9,5
10,5
11,5
Przygotowane w ten sposób próby wstawiliśmy do koagulatora i poddaliśmy wolnemu mieszaniu z prędkością 18 obrotów na minutę w czasie 20 minut. Mieszanie szybkie zostało pominięte by uniknąć rozbicia kłaczków .
Po przeprowadzeniu procesu koagulacji próby zostały odstawione na około 30 minut celem sedymentacji zawiesin.
W sklarowanych cieczach oznaczyliśmy odczyn, zasadowość, utlenialność oraz fosforany. Te same oznaczenia wykonaliśmy dla ścieków surowych.
4. WYNIKI
Miano wody wapiennej
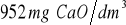
pH wody wapiennej
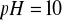
Na doprowadzenie prób do odpowiedniego
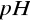
zużyto:
Nr próby |
Ilość |
Ilość
|
Wartość |
Ścieki surowe |
- |
- |
7,7 |
1 |
60,0 |
- |
9,5 |
2 |
140,0 |
- |
10,5 |
3 |
200,0 |
5 |
11,5 |
Dawka wapna:
Nr próby |
Dawka wapna |
pH przed koagulacją |
pH po koagulacji |
1 |
54,0 |
9,5 |
9,2 |
2 |
126,0 |
10,5 |
10,1 |
3 |
2530,0 |
11,5 |
11,2 |
- w 1 dm3 wody wapiennej jest 952 mg CaO
1 ml= 0,9 mg CaO
-NaOH ( 320g/680 ml H2O)
→ I próba:
1 ml → 0,9 mgCaO
60,0→ x [mgCaO]
x= 54,0 mgCaO/dm3
→ II próba:
1 ml → 0,9 mgCaO
140,0 ml→ x [mgCaO]![]()
x= 126 mgCaO/dm3
→ III próba:
1 ml → 0,9 mgCaO
200,0 ml→ x [mgCaO]![]()
x= 180,0 mgCaO/dm3
- po dodaniu NaOH (1,6 ml)
1 ml= [320:680=0,47 g]
1 ml= 0,47 g= 470 mg
![]()
mgNaOH
Razem:
180,0+2350,0=2530,0 mg(CaO,NaOH)/dm3
Zestawienie wyników:
|
|
Próba zerowa |
Rozcieńczenie |
Ilość ml KMnO4 zużyta na zmiareczkowanie |
Utlenialność [mgO2/dm3] |
||||
Utlenialność |
Ścieki surowe |
0,4 |
1:1 |
2,2 |
1,8 |
||||
|
Po procesie |
1. |
0,4 |
1:2 |
1,4 |
2,0 |
|||
|
|
2. |
0,4 |
1:5 |
0,7 |
1,5 |
|||
|
|
3. |
0,4 |
1:5 |
0,5 |
0,5 |
|||
Zasadowość |
|
Ilość ml HCl zużyta na zmiareczkowanie |
Zasadowość [mval/dm3] |
||||||
|
Ścieki surowe |
3,5 |
3,5 |
||||||
|
Po procesie |
1. |
3,6 |
3,6 |
|||||
|
|
2. |
3,9 |
3,9 |
|||||
|
|
3. |
9,7(1:5) |
48,5 |
|||||
Fosforany |
|
Rozcieńczenie |
Ekstynkcja |
Fosforany [mg/dm3] |
|||||
|
Ścieki surowe |
1:5 |
0,303 |
4,92 |
|||||
|
Po procesie |
1. |
1:5 |
0,088 |
1,43 |
||||
|
|
2. |
1:5 |
0,059 |
0,96 |
||||
|
|
3. |
1:5 |
0,049 |
0,79 |
||||
5. WNIOSKI.
Po przeprowadzonym ćwiczeniu laboratoryjnym potwierdziły się nasze założenia teoretyczne. Dodając do ścieków wapno w postaci wody wapiennej podnieśliśmy ich pH i zasadowość. Zauważyliśmy, że wraz ze wzrostem dawki wapna dodawanej do poszczególnych prób (54,0 ; 126,0 ; 2530 mgCaO) rośnie ich pH i zasadowość (im wyższe pH, tym wyższa zasadowość). Zauważyliśmy również, że po przeprowadzeniu procesu koagulacji w przypadku każdej próby nastąpiło nieznaczne obniżenie pH w stosunku do wartości początkowej.
Wytrącenie znacznej większości fosforanów ze ścieków następuje już przy pH w granicach 9.5 - 10, lecz najwyższy stopień usunięcia fosforanów jest możliwy dopiero w przedziale pH od 11 do 11.5. Wzrost stopnia usuwania fosforanów przy pH powyżej 11 wynika z koagulacyjnych i adsorpcyjnych właściwości wytrącanego wodorotlenku magnezu.
W przypadku fosforanów otrzymaliśmy dobre wyniki, gdyż usuwana ich ilość regularnie spadała wraz ze wzrostem wartości pH w badanych próbach. Za optymalną dawkę wapna uznaliśmy 2530 mgCaO ( III próba), która spowodowała wzrost pH do 11.5 przed koagulacją i 11,2 po koagulacji. W tej próbie zostało usuniętych najwięcej fosforanów w ilości 0,79 mg/dm3. W przypadku oznaczenia utlenialności, jej wartość malała wraz ze zwiększaniem wartości pH . W III próbie również otrzymaliśmy najmniejszą wartość utlenialności.

Wyszukiwarka
Podobne podstrony:
1 Usuwanie fosforanow przez koagulacje wapnem
1 Usuwanie fosforanow przez koagulacje wapnem
usuwanie N amonowego prze odpędzanie, odnowa wody-instrukcje
Koagulacja wapnem w odnowie wody, pytania dyplomowe
Dechloracja sciekow[1], odnowa wody-instrukcje
Usuwanie fosforu ze ścieków metodą osadu czynnego polega na pobieraniu fosforanów z wody osadowej pr
Podgrzewacz wody, Instrukcje-Bezpiecznej Pracy
ćw 7 usuwanie fosforu ze ścieków
Usuwanie fosforu
1 Usuwanie fosforanow Tabela
OPIS TECHNICZNO - ODNOWA WODY, Ochrona Środowiska
Oczyszczanie wody instrukcja do ćwiczeń laboratoryjnych
CHEMICZNE USUWANIE FOSFORU ZE ŚCIEKÓW
CHEMICZNE USUWANIE FOSFORU
Usuwanie fosforu ze ścieków przemysłowych, Studia, Studia II-stopień, Ochrona środowiska, Laboratori
CHEMICZNE USUWANIE FOSFORU ZE ŚCIEKÓW
usuwanie fosforu
Lab 2 Elektroliza wody Instru Elektroliza wody id 749463
ODNOWA WODY, Ochrona Środowiska
więcej podobnych podstron