Temat: Szybkość reakcji chemicznych.
Doświadczenie 4.1. Badanie wpływu stężenia na szybkość reakcji chemicznych.
Najpierw przygotowałam roztwór H2S2O3 o różnych stężeniach. Do tak przygotowanych roztworów dodałam kolejno po 3 cm3 roztworu kwasu siarkowego o stężeniu równym 0,25mol/dm3. W momencie dodania kwasu zmierzyłam czas do momentu pojawienia się opalescencji. Wyniki umieściłam w tabelce.
Wyznaczenie wpływu stężenia na szybkość reakcji.
Nr |
Objętość roztworu |
Objętość |
stężenie |
czas |
szybkość reakcji |
|
H2S2O3 |
wody |
CHSO=CNaSO |
reakcji |
|
|
|
|
|
|
|
1 |
10 |
0 |
0,5 |
7 |
0,07 |
2 |
8 |
2 |
0,4 |
9 |
0,04 |
3 |
6 |
4 |
0,3 |
10 |
0,03 |
4 |
4 |
6 |
0,2 |
15 |
0,013 |
5 |
2 |
8 |
0,1 |
29 |
0,003 |
6 |
1 |
9 |
0,05 |
35 |
0,001 |
Obliczam stężenie H2S2O3: Szukane:
1.Dane: n = ?
V = 10 cm3 = 0,01 dm3 C H2S2O3 = ?
C = 0,5 mol/dm3
C = ![]()
n = C * V
n = 0,5 mol/dm3 * 0,01 dm3 = 0,005 mol
C H2S2O3 =![]()
C H2S2O3 = ![]()
= 0,5 mol/dm3
2. Dane: Szukane:
V1= 0,008 dm3 n =?
C1= 0,5 mol/dm3 C2 =?
V2 =0,01 dm3
n = C * V
n = 0,5 * 0,008 =0,004 mol
C2 =![]()
= 0,4 mol/dm3
3.Dane: Szukane:
V1= 0,006 dm3 n = ?
C1 = 0,5 mol/dm3 C2 = ?
V2 =0,01 dm3
n = 0,5 * 0,006 =0,003 mol
C2 =![]()
=0,3 mol/dm3
4.Dane: Szukane:
V1= 0,004 dm3 n = ?
C1= 0,5 mol/dm3 C2 =?
V2=0,01 dm3
n = 0,5 * 0,004 = 0,002 mol
C2 = ![]()
=0,2 mol/dm3
5. Dane: Szukane:
V1 = 0,002 dm3 n = ?
C1= 0,5 mol/dm3 C2 =?
V2=0,01 dm3
n = 0,5 * 0,002 = 0,001 mol
C2 =![]()
= 0,1 mol/dm3
6. Dane: Szukane:
V1 =0,001 dm3 n = ?
C1= 0,5 mol/dm3 C2 =?
V2=0,01 dm3
n = 0,5 * 0,001 = 0,0005 mol
C2 =![]()
=0,05 mol/dm3
B) Obliczam szybkość zachodzącej reakcji:
1.Dane:
t = 7s
C2 = 0,5 mol/dm3
Założenie: C H2S2O3 = C Na2S2O3
V =![]()
V = ![]()
= 0,07 mol/dm3 * s-1
2.Dane:
t = 9 s
C2 = 0,4 mol/dm3
V=![]()
= 0,04 mol/dm3 * s-1
3.Dane:
t = 10 s
C2 = 0,3 mol/dm3
V =![]()
= 0,03 mol/dm3 * s-1
4.Dane:
t = 15 s
C2 = 0,2 mol/dm3
V =![]()
= 0,013 mol/dm3 * s-1
5.Dane:
t = 15 s
C2 = 0,2 mol/dm3
V =![]()
= 0,013 mol/dm3 * s-1
6.Dane:
t = 35 s
C2 = 0,05 mol/dm3
V =![]()
= 0,001 mol/dm3 * s-1
Jak widać na wykresie wraz ze spadkiem wartości stężenia H2S2O3 maleje wartość szybkości reakcji.
Doświadczenie 4.2. Wpływ temperatury na szybkość reakcji.
Przygotowałam 5 par probówek; jedna probówka z pary zawierała 5cm3 tiosiarczanu(VI) sodu o c = 0,5mol/dm3, a druga 5 cm3 kwasu siarkowego(VI) o c = 0,25 mol/dm3.10 probówek podgrzałam do temperatury 60oC, dodałam kwas siarkowy do tiosiarczanu i zmierzyłam czas do pojawienia się pierwszego osadu. Następnie ochłodziłam probówki do 50oC i powtórzyłam wszystkie czynności. Tak samo postępowałam aż do ochłodzenia do 20oC.
Badanie wpływu temperatury na szybkość reakcji.
Nr pary |
stężenie |
temperatura |
czas reakcji |
szybkość reakcji |
współczynnik |
|
CHSO=CNaSO |
|
|
|
temperaturowy |
|
|
|
|
|
|
1 |
0,25 |
60 |
4 |
0,062 |
2,58 |
2 |
0,25 |
50 |
5 |
0,05 |
1,24 |
3 |
0,25 |
40 |
7 |
0,035 |
1,42 |
4 |
0,25 |
30 |
8 |
0,031 |
1,13 |
5 |
0,25 |
20 |
13 |
0,019 |
1,63 |
B)Obliczam stężenie H2S2O3: Szukane:
1.Dane: n = ?
V = 5 cm3 = 0,005 dm3 C H2S2O3 = ?
C = 0,5 mol/dm3
V2 = 0,01 dm3
C = ![]()
n = C * V
n = 0,5 mol/dm3 * 0,005 dm3 = 0,0025 mol
C H2S2O3 =![]()
C H2S2O3 = 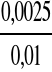
= 0,25 mol/dm3
B) Obliczam szybkość zachodzącej reakcji:
1.Dane:
t = 4s
C2 = 0,25 mol/dm3
Założenie: C H2S2O3 = C Na2S2O3
V =![]()
V = ![]()
= 0,062 mol/dm3 * s-1
2.Dane:
t = 5 s
C2 = 0,25 mol/dm3
V=![]()
= 0,05 mol/dm3 * s-1
3.Dane:
t = 7 s
C2 = 0,25 mol/dm3
V =![]()
= 0,035 mol/dm3 * s-1
4.Dane:
t = 8 s
C2 = 0,25 mol/dm3
V =![]()
= 0,031 mol/dm3 * s-1
5.Dane:
t = 13 s
C2 = 0,25 mol/dm3
V =![]()
= 0,019 mol/dm3 * s-1
C)Obliczam współczynnik temperaturowy:
![]()
1.Dane:
V70=0,16 mol/dm3 * s-1
V60=0,062 mol/dm3 * s-1
O =![]()
= ![]()
= 2,58
2.Dane:
V50=0,05 mol/dm3 * s-1
V60=0,062 mol/dm3 * s-1
O =![]()
= ![]()
= 1,24
3.Dane:
V50=0,05 mol/dm3 * s-1
V40=0,035 mol/dm3 * s-1
O =![]()
= 1,42
4.Dane:
V40=0,035 mol/dm3 * s-1
V30=0,031 mol/dm3 * s-1
O = ![]()
=1,13
5.Dane:
V20=0,019 mol/dm3 * s-1
V30=0,031 mol/dm3 * s-1
O = ![]()
=1,63
Jak widać na wykresie im wyższa temperatura tym wyższą wartość przyjmuje szybkość reakcji.
Doświadczenie 4.3. Badanie wpływu stężenia katalizatora na szybkość reakcji
manganianu(VII) potasu w środowisku kwaśnym.
Przygotowałam 6 kolb stożkowych. Do każdej z nich odmierzyłam 25 cm3 szczawianu potasu o c = 0,1 mol/dm3, 25 cm3 kwasu siarkowego(VI) 0 c = 2 mol/ dm3oraz do każdej z probówek kolejno0,0; 1,0; 2,0; 3,0; 4,0; 5,0; 6,0 cm3siarczanu(VI) manganu(II) o c = 0,02 mol/dm3. Następnie do każdej kolby dodawałem kolejno po 1 cm3 roztworu manganu(VII) potasu o c = 0,02 mol/dm3. Przy każdej kolbie należało zmierzyć czas do momentu odbarwienia się roztworu.
Badanie wpływu stężenia katalizatora na szybkość reakcji.
Nr |
Objętość roztworu |
Objętość końcowa |
stężenie |
czas |
szybkość reakcji |
kolbki |
MnSO4 |
mieszaniny reakcyjnej |
KMnO4 |
reakcji |
|
|
|
|
w mieszaninie |
|
|
1 |
0 |
51 |
0,000196 |
74 |
0,0000026 |
2 |
1 |
52 |
0,000192 |
43 |
0,0000044 |
3 |
2 |
53 |
0,000187 |
30 |
0,0000048 |
4 |
3 |
54 |
0,000185 |
22 |
0,0000084 |
5 |
4 |
55 |
0,000182 |
17 |
0,000010 |
6 |
5 |
56 |
0,000178 |
15 |
0,000012 |
7 |
6 |
57 |
0,000175 |
12 |
0,000014 |
A)Obliczam KMnO4: szukane:
1.Dane: n = ?
V = 0,5 cm3 = 0,0005 dm3 C H2S2O3 = ?
C = 0,02 mol/dm3
V2= 0,051 dm3
C = ![]()
n = C * V
n = 0,02 mol/dm3 * 0,0005 dm3 = 0,00001 mol
C H2S2O3 =![]()
C H2S2O3 = ![]()
= 0,000196 mol/dm3
2. Dane: Szukane:
V1= 0,0005 dm3 n =?
C1= 0,02 mol/dm3 C2 =?
V2 =0,052 dm3
n = C * V
n = 0,02 * 0,0005 =0,00001 mol
C2 =![]()
= 0,000192 mol/dm3
3.Dane: Szukane:
V1= 0,0005 dm3 n = ?
C1 = 0,02 mol/dm3 C2 = ?
V2 =0,053 dm3
n = 0,02 * 0,0005 =0,00001 mol
C2 =![]()
=0,000187 mol/dm3
4.Dane: Szukane:
V1= 0,0005 dm3 n = ?
C1= 0,02 mol/dm3 C2 =?
V2=0,054 dm3
n = 0,02 * 0,0005 =0,00001 mol
C2 = ![]()
=0,000185 mol/dm3
5. Dane: Szukane:
V1= 0,0005 dm3 n = ?
C1 = 0,02 mol/dm3 C2 = ?
V2 =0,055 dm3
n = 0,02 * 0,0005 =0,00001 mol
C2 =![]()
=0,000182 mol/dm3
6.Dane: Szukane:
V1= 0,0005 dm3 n = ?
C1= 0,02 mol/dm3 C2 =?
V2=0,056 dm3
n = 0,02 * 0,0005 =0,00001 mol
C2 = ![]()
=0,000178 mol/dm3
7.Dane: Szukane:
V1= 0,0005 dm3 n = ?
C1= 0,02 mol/dm3 C2 =?
V2=0,057 dm3
n = 0,02 * 0,0005 =0,00001 mol
C2 = ![]()
=0,000175 mol/dm3
B)Obliczam stężenie katalizatora:
2. Dane: Szukane:
V1= 0,001 dm3 n =?
C1= 0,02 mol/dm3 C2 =?
V2 =0,052 dm3
n = C * V
n = 0,02 * 0,001 =0,00002 mol
C2 =![]()
= 0,00038 mol/dm3
3.Dane: Szukane:
V1= 0,002 dm3 n = ?
C1 = 0,02 mol/dm3 C2 = ?
V2 =0,053 dm3
n = 0,02 * 0,002 =0,00004 mol
C2 =![]()
=0,00075 mol/dm3
4.Dane: Szukane:
V1= 0,003 dm3 n = ?
C1= 0,02 mol/dm3 C2 =?
V2=0,054 dm3
n = 0,02 * 0,003 =0,00006 mol
C2 = ![]()
=0,00111 mol/dm3
5. Dane: Szukane:
V1= 0,004 dm3 n = ?
C1 = 0,02 mol/dm3 C2 = ?
V2 =0,055 dm3
n = 0,02 * 0,004 =0,00008 mol
C2 =![]()
=0,00145 mol/dm3
6.Dane: Szukane:
V1= 0,005 dm3 n = ?
C1= 0,02 mol/dm3 C2 =?
V2=0,056 dm3
n = 0,02 * 0,005 =0,0001 mol
C2 =![]()
=0,001785 mol/dm3
7.Dane: Szukane:
V1= 0,006 dm3 n = ?
C1= 0,02 mol/dm3 C2 =?
V2=0,057 dm3
n = 0,02 * 0,006 =0,00012 mol
C2 = ![]()
=0,00210 mol/dm3
B) Obliczam szybkość zachodzącej reakcji:
1.Dane:
t = 74s
C2 = 0,000196 mol/dm3
V =![]()
V = ![]()
= 0,00000264 mol/dm3 * s-1
2.Dane:
t = 43 s
C2 = 0,000192 mol/dm3
V=![]()
= 0,0000044 mol/dm3 * s-1
3.Dane:
t = 30 s
C2 = 0,000187 mol/dm3
V =![]()
= 0,0000048 mol/dm3 * s-1
4.Dane:
t = 22 s
C2 = 0,000185 mol/dm3
V =![]()
= 0,0000084 mol/dm3 * s-1
5.Dane:
t = 17 s
C2 = 0,000182 mol/dm3
V =![]()
= 0,000010 mol/dm3 * s-1
6.Dane:
t = 15 s
C2 = 0,000178 mol/dm3
V =![]()
= 0,000012 mol/dm3 * s-1
7.Dane:
t = 12 s
C2 = 0,000175 mol/dm3
V =![]()
= 0,000014 mol/dm3 * s-1
Doświadczenie 4.4. Wpływ katalizatora na szybkość reakcji rozkładu nadtlenku wodoru.
Do 3 probówek odmierzyłam po 3 cm3 10% roztworu nadtlenku wodoru (H2O2). Do jednej dodałam kilka kropel ditlenku manganu (MnO2), do drugiej jedną kroplę FeCl3 o
c = 0,5 mol/dm3, do trzeciej 1 kroplę H3PO4 o c = 1 mol/dm3.
Reakcja w pierwszej probówce zaszła błyskawicznie i burzliwie. MnO2 jest w tej reakcji katalizatorem kontaktowym, który przyspiesza rozkład nadtlenku wodoru. Nieco wolniej, ale też bardzo szybko zaszła reakcja w drugiej probówce. W probówce tej wydziela się ciepło. FeCl3 w tej reakcji jest katalizatorem homogenicznym dodatnim, który przyspiesza rozkład H2O2. W probówce 3 nie zaobserwowałam większych zmian; obserwuje się brak reakcji. H3PO4 - katalizator homogeniczny ujemny opóźniający rozkład H2O2.
Wyszukiwarka
Podobne podstrony:
Sprawozdanie - Kinetyka chemiczna. Wyznaczenie stałej szybkości, Studia, Chemia
Stała szybkości reakcji jodowania acetonu, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Zestaw nr 6, Studia, chemia
Zestaw 7, Studia, chemia
tos2-2013d, Studia, chemia egzaminy
wapno, Budownictwo-studia, chemia
2 kationy, Studia, Chemia, chemia7
Reakcje jądrowe-podstawowe pojęcia, Studia, chemia jądrowa
chf wykład 6, Studia, Chemia, fizyczna, wykłady
ćw7 - Refrakcja i wyznaczanie momentu dipolowego, studia, chemia fizyczna
I Pracownia - zakres materiału, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA ORGANICZN
KOLOS kwasy tłuszcze 5, STUDIA, Chemia
nieorgany-pytania2, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA labora
pytania z examinu, Studia, Chemia, ogólna, examin
Doc 12, Studia, Chemia, chemia7
tos2-2014a, Studia, chemia egzaminy
ligandy, Studia POLSL, STUDIA, Chemia nieorganiczna, teoria
Spr.nr 10, Studia, Chemia, chemia7
zagadnienia do egzaminu z Podstaw chemicznych, Studia, Chemia, Podstawy chemiczne nauk o Ziemi - dla
więcej podobnych podstron