Zadanko 10.1 z BEKASA
Ile cm![]()
40% roztworu NaOH o gęstości ![]()
cm![]()
należy zużyć w celu przygotowania 1,50 dm![]()
roztworu o stężeniu 0,20 ![]()
dm![]()
?Masa molowa NaOH=40 g![]()
Rozwiązanie:
a)obliczanie ilości moli „n” NaOH w przygotowanym roztworze:
n=![]()
v=0,20 ![]()
dm![]()
![]()
![]()
=0,3 mol
b)obliczanie masy NaOH w roztworze końcowym: m=![]()
=0,30 mola ![]()
=12,00g
c)obliczanie masy 40% roztworu NaOH,w której znajduje się 12 g NaOH:
![]()
=![]()
![]()
=![]()
![]()
=30,00g
d)Obliczanie objętości jaką zajmuje 30 g roztworu: V=![]()
=![]()
=20,8 cm![]()
Odp 20,8 cm![]()
Zadanko 10,2
20,0 cm![]()
36,5% kwasu solnego o gęstości 1,18![]()
rozcieńczono wodą do objętości 2,0 dm![]()
.Jakie jest stężenie molowe powstałego roztworu?Masa molowa HCL=36,5![]()
Rozwiązanie:
a)Obliczanie masy wyjściowego roztworu HCL: m![]()
=d![]()
=1,18![]()
![]()
=23,6 g
b)Obliczanie masy substancji (HCL):
![]()
=8,614g
c)Przeliczanie masy kwasu solnego na liczbę moli: n=![]()
=0,2360 mola
d)Obliczanie stężenia molowego końcowego roztworu:
![]()
=0,118 mol![]()
Odp.0,118 mol![]()
Zadanko 10,7 BEKAS
Ile gramów dwuwodnego kwasu szczawiowego zużyto do przygotowania 200![]()
roztworu,jeśli jego 18 cm![]()
zobojętnia 25 cm![]()
roztworu NaOH o stężeniu 0,15![]()
? Masa molowa H![]()
![]()
![]()
Rozwiązanie:
a)Reakcja przebiega zgodnie z równaniem:![]()
wynika z tego że kwas szczawiowy reaguje z zasadą sodową w stosunku molowym 1:2
b)Obliczanie stężenia molowego (C![]()
:
![]()
czyli ![]()
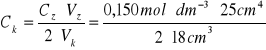
=0,1042![]()
![]()
c)Obliczanie masy kwasu szczawiowego zużytego do przygotowania 200 cm![]()
roztworu:
![]()
to ![]()
m![]()
=0,1042mol![]()
=2,6271g
Odp.2,6271g
Zadanko 10,22
Na miareczkowanie odważki krystalicznego boraksu (Na![]()
) o masie 0,3820g,zużyto20 cm![]()
roztworu kwasu solnego.Jakie było jego stężenie molowe? Masa molowa Na![]()
=381,37 g![]()
Rozwiązanie:
a)Reakcja przebiega zgodnie z równaniem:![]()
O![]()
baroks reaguje z kwasem w stosunku 1:2
b)przeliczenie odważki baroksu na liczbę moli (![]()
) ![]()
c)Obliczanie stężenia molowego roztworu HCL:
![]()
czyli ![]()
![]()
Odp.0,0934 g![]()
Zadanko 10,14
20cm![]()
roztworu NaOH miareczkowano za pomocą 26,8 cm![]()
roztworu HCL o stężeniu 0,1124![]()
dm![]()
.Oblicz stężenie molowe roztworu zasady oraz masę NaOH w kolbie miarowej na 200 cm![]()
.Masa molowa NaOH=40 g![]()
Rozwiązanie:
a)reakcja: NaOH+HCL![]()
NaCl+H![]()
O
b)obliczanie stężenia molowego zasady sodowej (C![]()
)
![]()
czyli ![]()
czyli ![]()
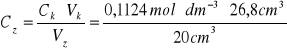
=0,1506![]()
dm![]()
c)Obliczanie masy NaOH w kolbie miarowej na 200 cm![]()
:
![]()
=0,1506![]()
dm![]()
![]()
Odp.1,2048g
Zadanko 10,31
Ile % zanieczyszczeń zawiera krystaliczny boraks,jeśli z próbką o masie 0,2850g reaguje 25,5 cm![]()
roztworu HCL o pH=1,30?Masa molowa boraksu=381,37 g![]()
Rozwiązanie:
a)przeliczenie pH na stężenie molowe jonów H![]()
, które równa się stężeniu molowemu HCL(![]()
=1):
![]()
b)Obliczanie ilości moli baroksu,które przereagowały z HCL(w oparciu o równanie zachodzącej reakcji patrz przykład 4):
![]()
![]()
c)przeliczenie liczby moli na masę baroksu: ![]()
=![]()
0,2441g
d)obliczanie masy i stężenia procentowego zanieczyszczeń zanieczyszczeń próbce krystalicznego baroksu:
![]()
![]()
Odp.14,35%
Wyszukiwarka
Podobne podstrony:
8560
8560
1 konspekt lekcji 2cid 8560 Nieznany (2)
8560
8560
8560
8560
8560
LM 8560
więcej podobnych podstron