ROZTWORY BUFOROWE O ZNANYM pH
Sposoby przygotowania:
Obliczenie dokładnych objętości kwasu i sprzężonej z nim zasady o określonych stężeniach i zmieszanie ich ze sobą.
Zmieszanie roztworu i sprzężonej z nim zasady , a następnie doprowadzenie do właściwego pH poprzez dodawanie roztworu mocnego kwasu lub mocnej zasady i dopełnienie do okeslonej objętości.
Wykorzystanie gotowych przepisów.
Wybór najlepszego buforu do doświadczenia :
pk jest równe pożądanej wartości pH. Im bardziej zbliżone są te wartości , tym większą pojemność buforową będzie miał ten bufor.
Dla największej efektywności działania buforu stosunek sprzężonej zasady i kwasu w roztworze powinien się mieścić się granicach 0,1-10
Bufory najlepiej buforują w przedziale pH
od wartości pk buforuBufor powinien utrzymywać pH na właściwym poziomie , ale jednocześnie nie powinien zmieniać warunków doświadczenia .
Należy wybrać bufor nie reagujący z rządnym z użytych odczynników w reakcji.
Pka pomiędzy 6-8 . to kryterium jest bardziej przydatne dla systemów biochemicznych niż do badania żywności . Goods założył , że lepiej używać buforów mających pH w tym zakresie niż konkretnego buforu o wartości pKa=7
Dobra rozpuszczalność w wodzie :
Minimalny efekt solny. Ważne jest, aby jony i inne cząsteczki obecne w roztworze nie oddziaływały z jonami i cząsteczkami tworzącymi bufor ( w obie strony)
Mały wpływ stężenia , temperatury czy siły jonowej roztworu na stopień dysocjacji. Bufor powinien utrzymywać pH bez względu na warunki przechowywania, czy dodanie innych soli lub innych związków do systemu, w praktyce dopuszcza się minimalne zmiany.
Dobrze zdefiniowane lub brak oddziaływać z kationami. Wiele buforów tworzy kompleks z jonami metali iw ten sposób wpływa na ich funkcjonalność w danym układzie.
Stabilność chemiczna polega na tym, że bufor nie może się rozkładać po wpływem np. światła lub w czasie.
Minimalna wartość absorpcji światła z zakresu widzialnego, jest to szczególnie w doświadczeniach, w których, w których planuje się pomiary spektrometryczne
Zadanie 1
100 ml 0,2 M roztworu buforowego, będącego mieszaniną roztworu kwasu octowego o st. 0,16 M i roztworu octanu sodu o st. 0,4 M dodano:
a) 1 l HCl o c=0,9 mol/l
b) 1ml NaOH o c = 0,9 mol/l
Oblicz pojemność buforową roztworu wobec kwasu i zasady .
W 1000 ml znajduje się 0,9 mola HCl , to w 1ml jest :
1000ml----0,9
1ml--------x
X=0,0009
Do 100ml buforu dodano 0,0009 mola kwasu lub zasady.
W 100ml buforu jest 0,004 mola soli i 0,016 mola kwasu octowego
pH buforu przed dodaniem kwasu wynosi :
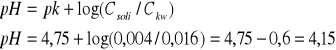
w roztworze jest 0,004 mola soli i 0,016 mola kwasu, po dodaniu 0,0009 mola HCl :
0,004-0,0009=0,0031 mola ![]()
i 0,0009+0,016=0,0169mola ![]()
A stężenia wynoszą:
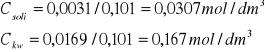

Stężenie roztworu mocnego kwasu dodanego do buforu ,który spowodował zmianę pH wynosi 0,0089 mol/dm ponieważ :
0,0009mola-101 cm
Xmola--------1000cm
X=0,0089mola
![]()
doany 1 cm zawiera 0,0009 mola NaOH
0,004+0,0009=0,0049mola ![]()
i 0,016-0,0009=0,0151mola ![]()
Odpowiednie stężenia wynoszą:
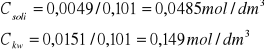

![]()
Woda i roztwór doskonały
Model idealnego kryształu- absolutne regularne rozmieszczenie atomów, jonów, lub molekuł w ściśle w węzłach sieci krystalicznej o zadanej z góry nigdzie nienaruszonej symetrii.
Model idealnego gazu-brak jakiegokolwiek porządku i oddziaływań między molekułami , poza zderzeniami sprężystymi .
Cechy roztworu idealnego :
stan pośredni pomiędzy fazą stałą i gazową
energia potencjalna oddziaływań międzymolekularnych jest na tyle duża , że nie pozwala na pełne oderwanie od siebie molekuł cieczy.
energia potencjalna oddziaływań międzymolekularnych jest zbyt mała , aby temperaturze odpowiadającej istnieniu fazy ciekłej mogło się wytworzyć uporządkowanie dalekozasięgowe.
Położenie cząsteczek w cieczy najlepiej opisuje krzywa rozkładu radialnego
Wzrost temperatury powoduje zwiększanie się odległości pomiędzy pikami na krzywej rozkładu (termiczne rozszerzanie cieczy).
Fizykochemiczne właściwości wody
VI |
związek |
wzór |
Masa cz. |
Temp. wrzenia |
Temp. topn. |
|
tellurowodór |
|
130 |
-4 |
-51 |
|
selenowodór |
|
81 |
-42 |
-61 |
|
siarkowodór |
|
34 |
-60 |
-82 |
|
Tlenowodór |
|
18 |
+100, oczek. -70 |
0, oczekiw. -90 |
Forma cyklicznego Pentametru :
Stosunkowo stabilna
Powstającego cząsteczek wody tworzących wiązania wodorowe
Rozbudowa pentametru prowadzi do powstania trójwymiarowych cyklicznych oktamerów
Właściwości wody:
Wysoki punkt topnienia ( 0C , por.
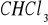
-63 C)Wysoka temperatura wrzenia (100 C por.
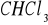
61)Wysoki punkt krytyczny (374 C por.
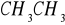
32 C)Wysokie napięcie powierzchniowe (72,75 mJ/m2 por.
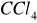
26,6 mJ/m2 przy 20 C)Wysoka lepkość (0,89 cP , por. pentan 0,22 cP przy 20C)
Wysokie ciepło parowania (40,7 kJ/kg por.
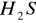
18,7 kJ/kg)Woda kurczy się przy topnieniu
Ruchliwość jonów
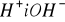
w polach elektrycznych są anomalnie duże, odpowiednio 362 i 206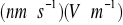
at 25 C w porównaniu z wartościami dla innych małych jonów, jak jon litu 40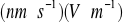
i jon fluoru 57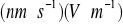
.Ciepło topnienie przechłodzonej wody ma wartość maksymalną przy -17 C
Względna przenikalność elektryczna (stałą dielektryczna ) jest wysoka.
Woda ma obojętny charakter kwasowo-zasadowy (pH=7) i zachowuje przy tym własności doskonałego rozpuszczalnika.
Obecność wody modyfikuje strukturę trzeciorzędową białek, decyduje o funkcjonalności białek w komórkach biologicznych i poza nimi.
Istnienie w wodzie wiązań wodorowych powoduje powstanie struktur otwartych , w których mogą być zamykane obce molekuły -tworzenie hydratów.
AKTYWNOŚĆ SKŁADNIKÓW ROZPUSZCZONYCH MOC JONOWA ROZTWORU
Siła jonowa-jest to miara występujących w roztworze oddziaływań międzyjonowych. Określa wpływ wszystkich obecnych w roztworze jonów na ich zachowanie , oraz oddziaływanie na pole elektryczne.
![]()
Gdzie Ci -to stężenie jonu (molowe [mol/dm ]lub molarne [mol/kg]
Zi- ładunek jonu
n- całkowita ilość jonów w roztworze
Dla prostych elektrolitów typu 1:1 które posiadają tylko jony jednowartościowe np. NaCl, NaOH, KCl KI siła jonowa jest równa ich stężeniu molowemu.
W przypadku elektrolitów typu 2:2 CaSO4 jest czterokrotnie większa niż stężenie molowe tego roztworu.
Współczynnik aktywności- to bezwymiarowy współczynnik pozwalający przeliczyć wielkości fizyczne o charakterze stężenia obliczone na podstawie ilości substancji i wielkości układu lub ciśnienie mierzone w sposób mechaniczny na wielkości o charakterze termodynamicznym nazywane aktywnością . Dla układów idealnych (gaz doskonały, roztwór doskonały ) w których nie występują oddziaływania pomiędzy parami cząsteczek ,a także przypadku układów bardzo rozcieńczonych współczynniki aktywności są równe 1.
Aktywność- to efektywne termodynamiczne stężenie substancji
![]()
![]()
Jakie powinno być stężenie ![]()
C1 aby roztwór tej soli był izotoniczny z roztworem KCl o stężeniu C2:
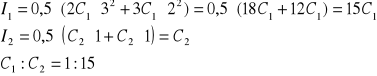
INSTRUMENTALNE METODY BADANIA ŻYWNOŚCI
1.Żywność jako materiał analityczny:
Wieloskładnikowa mieszanina
Zmienny poziom składników
Makro i mikroskładniki
Mało i wielocząsteczkowe składniki
Wieloskładnikowa mieszanina
Reakcje którym ulegają chemiczne składniki żywności:
Fosforoliza
Dehydratacja
Acylowanie
Alkilowanie
Fosforylacja
Estryfikacja
Nitrozowanie
Dekarboksylacja
Defosforylacja
Kondensacja
Polimeryzacja
Hydroliza
Uwodornienie
2.Stechiometryczne metody analizy :
Miareczkowanie potencjometryczne (redox oraz kwas zasada)
Miareczkowanie konduktometryczne
3.Metody niestechiometryczne:
Turbidymetria
Refraktometria
Podczerwień
UV -VH
Nefelometria
4.Wymagania dla współczesnych metod instrumentalnych :
Nieinwazyjność
Niedestrukcyjność
On-line
In-line
Szybkość
Cena
Dokładność
Precyzja
powtarzalność
niski poziom detekcji
Cel wprowadzania nowych metod i rozwijania już istniejących:
nowe standardy
polepszanie polityki żywieniowej
dobrobyt obywateli
rozwiązywanie problemów społecznych
polepszanie koniunktury i konkurencyjności
kontrola jakości
rozpowszechnienie wiedzy/wyników
Mleko |
|
Cel |
metoda |
Do wykrywania pozostałości weterynaryjnych |
Biosensory metody mikrobiologiczne |
Do badania właściwości fizykochemicznych |
Ultradźwięki, elektrochemia, |
Do oznaczania zawartości tłuszczu, białka makro i mikroelementów |
IR |
Ryby |
|
Cel |
metoda |
Do wykrywania dioxyn |
Ultradźwięki, bioreceptory, mikrobiologiczne, nosy elektroniczne |
Do badania cech sensorycznych |
Ultradźwięki, |
Zboża |
|
Cel |
metoda |
Do wykrywania metali ciężkich |
Bioreceptory, spektroskopia |
Do identyfikacji mykotoksyn |
NIR bioreceptory |
Oznaczanie energetyczności zawartości protein, twardość ziaren |
Nir kalorymetria, laserowa analiza plazmowa |
Owoce |
|
Cel |
metoda |
Do wykrywania pozostałości pestycydów |
MPI |
Do badania właściwości sensorycznych |
Ultradźwięki IR ,spektroskopia, fluorescencyjna |
Zjawisko fiz. Będące podstawa metody |
Metoda nalityczna |
Absorbancja promieniowania |
UV VIS IR ASA NMR EPR |
Rozproszenie i absorpcja |
Turbidymetria |
Rozproszenie peomoeniowania |
Nefelometria, dyfrakcja promieni retgenowskich |
Odbicie światła |
Interferometria, reflaktometria |
Skręcenie płaszczyzny światła spol. |
polarymetria |
Stan początkowy
Stan końcowy
Reakcja chem.
analiza chem.
Analiza chem.
Wyszukiwarka
Podobne podstrony:
BRĄZOWIENIE ENZYMATYCZNE I NIEENZYMATYCZNE W14, Studia SGGW, WNoŻ Inżynierskie 2008-2012, Sem III, C
Kwantowanie energii W13, Studia SGGW, WNoŻ Inżynierskie 2008-2012, Sem III, Chem żywn
WITAMINY W 15, Studia SGGW, WNoŻ Inżynierskie 2008-2012, Sem III, Chem żywn
Biochemia - Pytania, Studia SGGW, WNoŻ Inżynierskie 2008-2012, Sem III, biochemia
Towary - Test odp nowe pyt, Studia SGGW, WNoŻ Inżynierskie 2008-2012, Sem V, Fakultety, towarozn
równoważnik miedzi (spraw.), Studia SGGW, WNoŻ Inżynierskie 2008-2012, Sem II, Fizyka
analiza 02, Studia SGGW, WNoŻ Inżynierskie 2008-2012, Sem IV, Ocena jakości
Analiza 08, Studia SGGW, WNoŻ Inżynierskie 2008-2012, Sem IV, Ocena jakości
toksyka 02, Studia SGGW, WNoŻ Inżynierskie 2008-2012, Sem IV, Toksykologia
Energia 03, Studia SGGW, WNoŻ Inżynierskie 2008-2012, Sem IV, Gospodarowanie Energią
Ekologia 2, Studia SGGW, WNoŻ Inżynierskie 2008-2012, Sem VI, ekologia
BAKTERIE MLEKOWE 2009, Studia SGGW, WNoŻ Inżynierskie 2008-2012, Sem VI, Fakultety, Bakterie mlekowe
Ekol. ochrona środ.zal.2011, Studia SGGW, WNoŻ Inżynierskie 2008-2012, Sem VI, ekologia
Zestaw 3, Studia SGGW, WNoŻ Inżynierskie 2008-2012, Sem II, Chemia organiczna
Ekologia 2, Studia SGGW, WNoŻ Inżynierskie 2008-2012, Sem VI, ekologia
Zestaw 1, Studia SGGW, WNoŻ Inżynierskie 2008-2012, Sem II, Chemia organiczna
polityka 4, Studia SGGW, WNoŻ Inżynierskie 2008-2012, Sem VI, Fakultety, Polityka wyzywienia
Energia 01, Studia SGGW, WNoŻ Inżynierskie 2008-2012, Sem IV, Gospodarowanie Energią
Polityka2a, Studia SGGW, WNoŻ Inżynierskie 2008-2012, Sem VI, Fakultety, Polityka wyzywienia
więcej podobnych podstron