Numer ćwiczenia: 7 |
Temat ćwiczenia: Współczynnik podziału |
Data wykonania ćwiczenia: 03.12.2013r. |
|
|
Data oddania sprawozdania: 17.12.2013r. |
Grupa: A2 |
Góralik Monika |
Nazwisko sprawdzającego: dr Beata Korchowiec |
Uwagi: |
Ocena: |
|
1. Cel ćwiczenia.
Celem wykonanego ćwiczenia było wyznaczenie stałych asocjacji i dysocjacji kwasu benzoesowego oraz współczynnika podziału Nernsta.
2. Wykonanie.
Na wadze analitycznej odważono 4 odważki kwasu benzoesowego o masie: 0,071 g, 0,14 g, 0,211 g i 0,28 g
Odważki przeniesiono do czterech butelek i rozpuszczono w 25 cm3 toluenu
Do butelek wlano po 250 cm3 wody destylowanej
Wszystkie butelki pozostawiono na wytrząsarce na pół godziny
Zawartość butelek przeniesiono do rozdzielaczy gruszkowych i pozostawiono na 15 minut do rozdzielenia się warstw
Warstwy wodne rozdzielono od toluenowych i zmiareczkowano 0,01 M roztworem NaOH wobec fenoloftaleiny
3. Wyniki.
Tabela1.: wyniki miareczkowań odważek kw. benzoesowego
Nr odważki |
Masa odważki [g] |
Objętość miareczkowanej próbki [cm3] |
Objętość titranta [cm3] |
Średnia objętość titranta [cm3] |
|
|
|
|
1. miareczkowanie |
2. miareczkowanie |
|
1 |
0,071 |
50 |
9,9 |
9,8 |
9,85 |
2 |
0,14 |
50 |
17,4 |
17,4 |
17,4 |
3 |
0,211 |
25 |
11,5 |
11,6 |
11,55 |
4 |
0,28 |
25 |
14,5 |
14,6 |
14,55 |
4. Opracowanie wyników
-Na podstawie wyników miareczkowań obliczono, jakie masy kwasu benzoesowego znajdowały się
w każdej z faz wodnych.
Podczas miareczkowania dochodziło do reakcji:
C6H5COOH + NaOH → C6H5COONa + H2O
Z równania reakcji wynika, że 1 mol kwasu benzoesowego przereagował z 1 molem wodorotlenku sodu. Stężenie titranta jest określane wzorem:
CNaOH=nNaOH/VNaOH
Gdzie C to stężenie (0,01 mol/dm3), n - liczba moli wodorotlenku sodu, V - objętość (w dm3). Przez przekształcenie tego wzoru można obliczyć liczbę moli zasady, która przereagowała z kwasem benzoesowym:
nNaOH=CNaOH*VNaOH
Z powyższych wzorów obliczono zawartość kwasu benzoesowego w każdej z badanych próbek:
CC6H5COOH=nC6H5COOH/Vpr,obki
gdzie CC6H5COOH - stężenie kw. benzoesowego w próbce, nC6H5COOH - liczba moli kwasu, Vpr,obki - objętość miareczkowanej próbki.
Obliczono zawartość kwasu w każdej z faz wodnych:
nC6H5COOH=CC6H5COOH*Vfazy
gdzie Vfazy - całkowita objętość fazy wodnej (250 cm3). Masy zawartego w roztworach kwasu obliczono ze wzoru:
mC6H5COOH=nC6H5COOH*MC6H5COOH
gdzie MC6H5COOH to masa molowa kwasu benzoesowego (122,117 g/mol).
Tabela2.: zawartość kwasu benzoesowego w fazach wodnych
Nr próbki |
nC6H5COOH |
cC6H5COOH [mol/dm3] |
nC6H5COOH - całkowita [mol] |
mC6H5COOH [g] |
1 |
0,0000985 |
0,00197 |
0,0004925 |
0,0601 |
2 |
0,000174 |
0,00348 |
0,00087 |
0,1062 |
3 |
0,000115 |
0,0046 |
0,00115 |
0,1404 |
4 |
0,0001455 |
0,00582 |
0,001455 |
0,1771 |
-Obliczono, ile kwasu benzoesowego zawierały fazy toluenowe - masę zawartego w każdej z faz kwasu obliczono ze wzoru:
mC6H5COOH (toluen)=mC6H5COOH (naważka)-mC6H5COOH (woda)
gdzie mC6H5COOH (toluen) - masa kw. benzoesowego w fazie toluenowej, mC6H5COOH (naważka) - masa naważki, mC6H5COOH (woda) - masa kw. benzoesowego w fazie wodnej. Liczbę moli kwasu benzoesowego w warstwach toluenowych obliczono ze wzoru:
nC6H5COOH=mC6H5COOH/MC6H5COOH
gdzie MC6H5COOH to masa molowa kwasu. Stężenia kwasu obliczono ze wzoru:
c=nC6H5COOH/Vroztworu
(Vroztworu=25 cm3).
Tabela3.: zawartość kwasu benzoesowego w warstwach toluenowych
Nr próbki |
masa kwasu benzoesowego w próbce [g] |
liczba moli kwasu w próbce [mol] |
stężenie kwasu [mol/dm3] |
1 |
0,0109 |
0,00008926 |
0,0035704 |
2 |
0,0338 |
0,00027678 |
0,0110712 |
3 |
0,071 |
0,00058141 |
0,0232564 |
4 |
0,1029 |
0,00084263 |
0,0337052 |
-Wyznaczono stopień dysocjacji kwasu w warstwach wodnych. Stała dysocjacji kwasu benzoesowego wynosi Kd=6,46*10-5. Ze znajomości prawa rozcieńczeń Ostwalda:
i jego odpowiedniemu przekształceniu można wyznaczyć stopień dysocjacji kwasu:
Pod uwagę wzięto wartości α1 - wartości α2 okazały się być ujemne.
Tabela4.: stałe dysocjacji kwasu benzoesowego - fazy wodne
Nr próbki |
α |
1 |
0,16543 |
2 |
0,12728 |
3 |
0,11169 |
4 |
0,09995 |
-Obliczono współczynnik podziału Nernsta oraz stałą asocjacji kwasu benzoesowego w toluenie na podstawie wykresu zależności
od Cw(1-α).
Tabela5.: dane do wykresu
Nr próbki |
Cw(1-α) [mol/dm3] |
|
1 |
0,0016441 |
2,1716402 |
2 |
0,0030371 |
3,6453608 |
3 |
0,0040862 |
5,6914131 |
4 |
0,0052383 |
6,4343886 |
Wykres1.: zależność
od Cw(1-α)
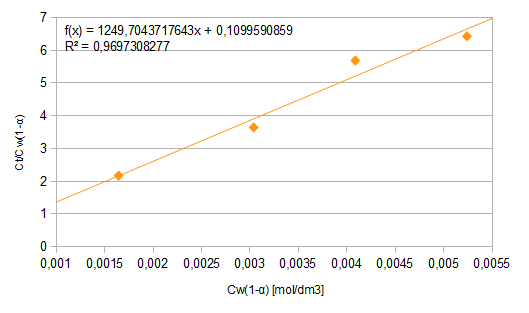
Wyznaczony wykres jest dany funkcją f(x)=1249,70437x+0,10995. Znając zależność
można wyznaczyć poszukiwane wartości.
→
→
KN=1/0,10995=9,095
Ka=51687,16
5. Wnioski.
Stosowane podczas doświadczenia ciecze - woda i toluen nie mieszają się ze sobą, tylko tworzą dwie odrębne fazy. Wprowadzony do układu kwas benzoesowy ma zdolność do rozpuszczenia się w obu tych cieczach, przez co uległ podziałowi. W wodzie ulegał dysocjacji. Dzięki znajomości stałej dysocjacji kwasu oraz obliczeniu stopni dysocjacji dla każdej z tych faz zauważono, że im wyższe jest stężenie roztworu, tym kwas ulega mniejszej dysocjacji (stopień dysocjacji malał ze wzrostem stężenia). Dzięki wykonanemu ćwiczeniu poznano również stałą asocjacji kwasu w toluenie oraz współczynnik podziału Nernsta. Dokonano tego poprzez narysowanie wykresu zależności
od Cw(1-α) (wykres 1). Zauważono, że kwadrat współczynnika korelacji był nieznacznie różny od 1 - wskazuje to na możliwość popełnienia pewnych błędów podczas ćwiczenia, które negatywnie wpłynęły na uzyskane wyniki - mogły one wynikać m.in. z błędu kropli bądź niepełnego rozwarstwienia się obu faz w rozdzielaczach.
Wyszukiwarka
Podobne podstrony:
Współczynnik podziału -16 wykres, Biotechnologia PWR, Semestr 3, Chemia fizyczna - Laboratorium, 16.
29. Wyznaczanie współczynnika podziału Nernsta metodą potencjometryczną, chemia fizyczna
Wspolczynnik podzialu-protokol, Rok I, chemia fizyczna, chemia fizyczna-protokoły
Wspolczynnik podzialu, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyc
Sprawozdania z fizycznej 1 ~$rawozdanie Współczynnik podziału
Sprawozdania z fizycznej 1, Sprawozdanie Współczynnik podziału, Sprawozdanie z ćwiczenia 11
Absorbcja promieniowania gamma, Pomiar współczynnika pochłaniania promieniowania gamma 2, LABORATORI
Sprawozdania Karol, Współczynnik podziału, Gr
lab 7 - współczynnik podziału słabego kwasu pomiędzy fazą wodną a organiczną, kiciaqq
Współczynnik podziału Sprawozdanie
7. Współczynnik podziału Nernsta - zbiorcze, Zespół 1
62Wyznaczanie współczynnika temperaturowego oporu, Fizyka-Laboratoria
Współczynnik podziału Nernsta
10 Współczynnik podziałuid 11179
Laboratorium Fizyka Współczesna I pociag, Przyroda UG, Laboratorium fizyka współczesna I
Laboratorium Fizyka Współczesna I monochromator, Przyroda UG, Laboratorium fizyka współczesna I
Ćw 9. Współczynnik załamania ciał stałych, Laboratoria, Laboratorium Fizyka
więcej podobnych podstron