Interpretacja procesu spalania /definicje, czynniki wpływające na ten proces/
SPALANIE- 1)jest to proces fizykochemiczny przebiegający pomiędzy materiałem palnym i powietrzem z wydzieleniem ciepła i powstaniem efektów świetlnych. 2)jest to egzotermiczna reakcja palnego materiału (paliwa) z utleniaczem zwykle z towarzyszeniem płomieni, i(lub) tlenia lub żarzenia i(lub) dymu.
Procesy fizyczne przygotowują materiał palny do spalania, w przypadku gazu są to procesy dyfuzyjne, w przypadku cieczy- parowanie, ciał stałych- rozkład termiczny (dysocjacja termiczna, piroliza, rozkład termiczny)
Typy spalania /dyfuzyjne, kinetyczne/. Co różnicuje ten proces i jak typ spalania wpływa na szybkość spalania
Spalanie dyfuzyjne (wolne), np. pożar - szybkość spalania zależy od dyfuzji powietrza do środowiska pożarowego. Występuje tutaj rozdział substancji palnej i powietrza. Łączą się one dopiero w chwili zapoczątkowania reakcji spalania. Tym typem spalania rządzi zjawisko fizyczne (dyfuzja), więc jest to spalanie wolne.
b) Spalanie kinetyczne (szybkie), np. wybuch - szybkość spalania nie zależy od dyfuzji powietrza. Występuje tutaj mieszanina substancji palnej z powietrzem, której całkowity czas spalania uzależniony jest od kinetyki reakcji chemicznej, co oznacza, że jest to spalanie bardzo szybkie (wybuchowe), ponieważ reakcja chemiczna przebiega o wiele rzędów szybciej niż zjawisko fizyczne.
Podstawowa różnica między spalaniem, a pożarem w odniesieniu do warunków przebiegu procesów.
Gdy spalanie jest niekontrolowanym w czasie i przestrzeni wydzielaniem ciepła połączonym z przenoszeniem masy, mamy do czynienia z pożarem
Pożar- jest to efekt cieplny powstały z różnych przemian chemicznych i zjawisk mechanicznych w danych warunkach wymiany gazowej w określonym układzie termodynamicznym powodujący zmianę stanu równowagi termodynamicznej tego układu. Różni się tym, że poza spalaniem pożar charakteryzuje przede wszystkim wymiana gazów w takim układzie palnym w którym zachodzi. Wymiana gazowa następuje pomiędzy produktami rozkładu termicznego, a produktami spalania i zimnym powietrzem. Na skutek zmian temperatury środowiska pożarowego i zimnego powietrza następuje zmiana gęstości poszczególnych gazów i w konsekwencji w skutek działania sił wyporu wymiana gazowa -spalanie jest elementem pożaru
Termostabilność materiałów palnych /definicja, sposoby jej określania/. Jak termostabilność wpływa na palność materiałów.
Termostabilność jest to ubytek masy w czasie ogrzewania lub poprzez temperaturę. Oznacza się ją: 1.Temperatura maksymalnego ubytku. 2. Temperatura, przy której polimer traci 50% masy w czasie 30 minut (czas połowicznego rozkładu) - dla tworzyw.
Termostabilność decyduje o szybkości spalania się materiału w środowisku pożarowym, ponieważ powstałe z rozkładu termicznego produkty decydują o tym, jak szybko nastąpi zapłon, czy samozapłon i ile energii cieplnej z płomienia zostanie zwrócone spalającej się powierzchni.
Termostabilność -wpływa na nią moc wiązania pomiędzy atomami tworzącymi polimery, co obrazuje wartość energii dysocjacji tych wiązań. Im ta energia jest większa tym polimer jest odporniejszy termicznie. Innymi słowy termostabilność określana jest jako graniczna temperatura, po osiągnięciu której ma miejsce termiczny lub termochemiczny rozkład polimeru charakteryzujący się wydzielaniem substancji lotnych.
Najłatwiej jest rozłożyć polimery, gdzie są wiązania: C-Cl, C-Br, C-I, trudniej typu C-C, C=C.
Moc wiązania pomiędzy atomami w łańcuchu polimeru zależy również od podstawnika i budowy całej makrocząsteczki:
niska odporność cieplna charakteryzuje posiadające w swojej budowie grupy -OH, -Cl, -NH2 z których w czasie ogrzewania wytwarza się H2O, chlorowodór, amoniak, alkohole
Zmniejszanie odporności termicznej obserwuje się w polimerach posiadających duże grupy boczne (np. fenylowe) przyłączone do łańcucha głównego.
Polimery, których łańcuchem głównym są pierścienie aromatyczne mają większą termostabilność niż te o budowie łańcuchowej lub cyklicznej.
Zastąpienie wodoru przy węglu w łańcuchu glównym przez grupe metylową powoduje zmniejszenie termostabilności.
Polimery mające wbudowane w łańcuchu głównym, węglowym, atomy tlenu, są mniej odporne na ciepło niż te złożone wyłącznie z atomów węgla.
Płomień /definicja, typy płomieni, wpływ różnych czynników na charakterystykę termiczną i spektralną płomienia, temperatura płomienia, kształt, szerokość, wysokość, intensywność promieniowania, własności dymu/.
Płomień jest to objętość gazowa, w której występuje spalanie się palnej fazy lotnej.
Płomień dyfuzyjny charakteryzuje spalanie dyfuzyjne. Jest to płomień powstały w wyniku zapalenia tej części objętości, w której następuje mieszanie się paliwa z powietrzem. Szybkość spalania w płomieniu dyfuzyjnym jest określona szybkością dyfuzji powietrza do strefy spalania płomienia. Szybkośc ta jest podstawą klasyfikacji płomieni na :
laminarne - przy niskich szybkościach przepływu
turbulentne - przy wysokich szybkościach przepływu
Pomiędzy dyfuzyjnym płomieniem laminarnym, a turbulentnym jest taka różnica że płomień turbulentny dla tego samego paliwa ma:
mniejszą wysokość ( wysokość płomienia zależy od szybkości przepływu fazy lotnej; lepsze mieszanie mieszaniny, szybsze spalanie)
większą szybkość spalania ( ze względu na penetrację głębiej powietrza w głębiej położonej objętości płomienia)
wyższą temperaturę spalania ( ze względu na szybkość spalania)
Temperatura spalania jest funkcją ciepła spalania. Decyduje o własnościach
środowiska pożarowego. Zależy od:
ciepła spalania - im wyższe ciepło spalania, tym wyższa temperatura płomienia
współczynnika nadmiaru powietrza - oznacza on stosunek objętości powietrza niezbędnego do spalenia jednostki masy materiału w warunkach rzeczywistych, do objętości powietrza wyliczonej z równania stechiometrycznego.
wysokości płomienia - jest funkcją objętościowej szybkości przepływu paliwa w przepływie laminarnym. Najwyższą temperaturę notuje się w 1/3 wysokości płomienia, a najniższą tuż przy powierzchni spalania, w górnej części płomienia maleje, gdyż produkty spalania uniemożliwiają dopływ powietrza do paliwa.
charakterystyki spektralnej płomienia ( emisyjności płomienia w warunkach pożarowych) - im płomień więcej wypromieniowuje ciepła, tym bardziej temperatura spalania spada. Charakterystyka ta jest zmienna i zależna od ilości węgla, która znajduje się w danej substancji. Wszystkie związki które mają zawartość węgla powyżej 60%, dają płomień świecący.
Współczynnika emisji ciepła promieniowania z płomienia do otoczenia - im jest większy, tym temperatura spalania jest niższa.
Dym to dyspersyjny układ aerozolowy, składający się z ośrodka gazowego
(faza rozpraszająca, tzw. dyspersyjna), oraz fazy rozproszonej w stanie ciekłym lub stałym.
Dym tworzący się podczas spalania płomieniowego składa się prawie całkowicie z cząstek stałych (sadzy). W warunkach oddziaływania płomienia jako wysokoenergetycznego strumienia ciepła mała część cząsteczek stałych oblepia ciekłe produkty spalania, dlatego też przy spalaniu płomieniowym powstaje znacznie mniej dymu niż przy bezpłomieniowym. Większość zaś tych cząstek jest tworzona w fazie gazowej w wyniku niecałkowitego spalenia, wysokiej temperatury i niskiej zawartości tlenu. Własności dymu zależą od rodzaju ośrodka gazowego, fazy dyspersyjnej, tzw. Stężenia liczbowego i masowego, rozmiarów cząsteczek, pierwotnego kształtu cząsteczek nie zaglomerowanych, stopnia ich agregacji, kształtu agregatów i ładunku elektrycznego cząsteczek.
Własności dymu:
stopień przezroczystości - jest to stosunek natężenia wiązki światła wchodzącego w dym I0, do natężenia wiązki światła I po przebyciu przez nią w obłoku dymu drogi o długości l, przy założeniu że część strumienia świetlnego określonego różnicą natężenia I0-I nie osiąga punktu detekcji.
optyczna gęstość dymu:D= log I0/I
właściwa gęstość optyczna dymu - gęstość optyczna warstwy aerozolu dymu o grubości 1 m wytworzonego w obj. 1 m3 w czasie rozkładu term. lub spalania próbki badanego materiału o powierzchni 1 m2. Ds= D*V/A*l gdzie: V- obj. komory dymowej, A- powierzchnia próbki, l- grubość mierzonej warstwy dymu.
masowa gęstość optyczna dymu- gęst. opt. Warstwy dymu o grubości 1 m wytworzonego w obj. 1m3 w czasie rozkładu term. i spalania 1 kg materiału: MOD= Ds*A/m gdzie m- ubytek masy próbki w wyniku spalania lub bezpłomieniowego rozkładu termicznego w komorze
ilość wydzielonego dymu: S=δV gdzie δwspółczynnik tłumienia
DYM jest nośnikiem ciepła a nie płomień!!!!!
Różnica między temperaturą płomienia, a temperaturą pożaru. Co jest najistotniejszą wielkością, która różni obie wyżej wymienione temperatury
Temperatura pożaru to średnia temperatura gazów spalinowych, które tworzą się w środowisku pożarowym.
Temperatura płomienia jest funkcją ciepła spalania, odwrotnie proporcjonalną do ciepła właściwego (entalpii) gazów spalinowych. Im wyższe ciepło spalania tym wyższa temperatura płomienia. Jest to najwyższa temperatura strefy spalania płomienia osiągana w następujących warunkach:
objętość powietrza, zużywana do spalania paliwa równa jest ilości powietrza teoretycznie wyliczonej z reakcji, czyli współczynnik nadmiaru powietrza W wyniku spalania otrzymuje się produkty całkowitego spalania. Rzeczywista temperatura jest zawsze niższa od temp. teoretycznej ponieważ spalanie zachodzi w nadmiarze powietrza ( >). Spalanie jest niecałkowite i część ciepła spalania wypromieniowana jest do otaczającego środowiska.
Najwyższą temperaturę płomienia dają paliwa gazowe (acetylen, wodór), zawierające dużo węgla, najniższe- włókna syntetyczne (elana, nylon), średnie temp. płomienia dają między innymi materiały celulozopochodne.
Temp. płomienia zależy od wysokości, w której ją w płomieniu mierzymy. Najniższa temp. występuje bezpośrednio nad paliwem, najwyższa obserwowana jest w 1/3 wysokości płomienia.
Metale palą się bezpłomieniowo, bo nie mają fazy lotnej.
7.Co to znaczy własność palna materiału? Podać przykłady własności palnych materiałów o różnych stanach skupienia.
Własność palna- jest to taka własność materiału, która wyznaczana jest w warunkach laboratoryjnych, w warunkach niskoenergetycznych. Zalicza się tutaj temperaturę zapłonu, samozapłonu, samozapalenia.
Samozapalenie jest funkcją bilansu cieplnego. Temperatura samozapłonu jest funkcją masy.
Temp. zapłonu
1.Pyłów (ciał stałych) - najniższa temp. ziarna(ogrzewanej powierzchni), przy której produkty rozkładu termicznego tego ziarna zapalą się od płomieniowego źródła ciepła(punktowego bodźca energetycznego).
2.Cieczy- najniższa temp. cieczy ogrzewanej w ściśle określony sposób, w której to pary cieczy tworzą mieszaninę z powietrzem- mieszaninę zapalającą się przy zbliżeniu płomienia.
Ciecze palne to ciecze, które mają temperaturę zapłonu poniżej 100°C.Ciecze niebezpieczne pożarowo to te, które mają temperaturę zapłonu poniżej 55°C.
I kl. niebezpieczeństwa pożarowego < 21°C
II kl. niebezpieczeństwa pożarowego 21-55°C
III kl. niebezpieczeństwa pożarowego 55-100°C
Gazy nie są charakteryzowane przy pomocy temperatury zapłonu. Gazy nie mają temperatury zapłonu, ponieważ od płomienia zapalają się w każdej temperaturze powyżej ich temp. skroplenia.
Temp. samozapłonu
1.Pyłów - najniższa temp. ziaren pyłu, w której ulega on samorzutnemu zapaleniu się płomieniem. Przy samozapłonie dostarczmy tylko strumień ciepła ( bez płomienia).
-gazów 400-600°C.Wyjątki:
C2H2 czysty 305
C2H2 techniczny 140
PH3 100
P2 H4 80
H2 S 240
Gazy mają wysoką temp. samozapłonu, bo są termoprzepuszczalne - przepuszczają promieniowanie cieplne.
- cieczy: 300- 500 °C. Wyjątki:
benzyna lotnicza 260
eter dwuetylowy 180
dwusiarczek węgla 112
aldehyd octowy 140
Jako ciecze mają szerokie granice wybuchowości.
-ciał stałych: 200-400°C. Wyjątki:
koks
antracyt
Mają wyższe temperatury samozapłonu z powodu nieporowatości i małego λ.
Temperatura Zapalenia:
Cieczy-nazywamy najniższą temperaturę ścianek naczynia, w której w danych warunkach i dla danej mieszaniny następuje samorzutne zapalenie cieczy w całej masie bez udziału tzw. zewnętrznego bodźca energetycznego.
8.Spalanie gazów (układów homogenicznych). Mechanizm reakcji łańcuchowej. Zasadnicze elementy łańcucha interpretacja tych elementów w procesie spalania. Omówienie na dowolnym gazie (wodór, tlenek węgla, metan itd.)
Spalanie gazów to spalanie homogeniczne. Jest to taki typ spalania, w którym mat. palny i utleniacz się w tym samym stanie skupienia. W takim spalaniu nie ma granicy rozdziału faz, ponieważ istnieje tylko jedna faza lotna.
Spalanie gazów może być
dyfuzyjne-(wolne), np. pożar- szybkość spalania zależy od dyfuzji powietrza do środowiska pożarowego. Występuje tutaj rozdział powietrza od gazu, mieszanina powstaje dopiero w strefie spalania.
kinetyczne-(szybkie)- wybuch, tzn. szybkość spalania nie zależy od dyfuzji powietrza, lecz od czynników cieplnych i hydrodynamicznych. Występuje tutaj mieszanina gazów, której szybkość spalania zależy od szybkości reakcji chemicznej.
Mechanizm reakcji łańcuchowej na przykładzie metanu CH4 :
C+H = CH3*+H*+M a inicjacja reakcji-paliwo zużywa się
CH4+OH*=CH3*+H2O b
CH4+H*= CH3*+H2 c
CH4+O2= CH3*+OH* d
O2+H*=O*+OH* e Etap rozgałęzienia łańcucha
CH3*+O2=CH2O+OH* f
CH2O+O*=CHO*+OH* g
CH2O+OH*=CHO*+H2O h
CH2O+H*=CHO*+H2 -cząstka niereaktywna i
H2+O*=H*+OH* j
H2+OH*=H*+H2O k
CHO*+O*=CO+OH* l
CHO*+OH*=CO+H2O m
CHO*+H*=CO+H2 n
CO+OH*=CO2+H* o Zakończenie reakcji łańcuchowej
H*+OH*+M=H2O+M p
H*+H*+M=H2+M r
H*+O2+M=H2O+M s Zakończenie reakcji
Jeżeli z jednej cząsteczki powstaje jeden rodnik - reakcja łańcuchowa prosta.
Jeżeli powstają dwa rodniki - reakcja łańcuchowa rozgałęziona.
Obecność wolnej wartościowości w rodnikach powoduje, iż szybko łączą się one z paliwem w płomieniu wg pokazanego schematu łańcuchowego.
Aby powstał rodnik cząsteczka metanu musi zderzyć się z cząsteczką obojętną mp. powierzchnią naczynia. W wyniku zderzenia rozpocznie się proces inicjacji reakcji, tzn. paliwo zużywa się wg zapisu a-d. Na reakcji d kończy się etap inicjacji, ponieważ z jednego rodnika przed reakcją powstają dwa rodniki po reakcji, taką reakcję nazywamy reakcją łańcuchową rozgałęzioną, a rozpoczynający się etap- etapem rozgałęzienia łańcucha.
W reakcji f powstaje bardzo istotny pośredni produkt reakcji spalania w płomieniu wszystkich materiałów palnych lotnych, tzn. formaldehyd ( CH2O ). Jest on bardzo ważnym etapem pośrednim w reakcji spalania paliw gazowych. Aldehyd łączy się następnie z poszczególnymi rodnikami. Powstały wodór (i) jest materiałem palnym. Występuje jednak w tej reakcji w postaci cząsteczkowej, czyli niereaktywnej, dlatego musi ulec rozbiciu na rodniki.
Reakcje e-l są to tzw. reakcje podstawowe rozgałęzienia łańcucha. Z chwilą powstania tlenku węgla zaczyna się tzw. terminacja, czyli zakończenie reakcji łańcuchowej. Polega to na dezaktywacji wolnych rodników poprzez przekształcenie ich w cząsteczki. W reakcji m-o powstały związki obojętne plus rodnik H* , wchodzi on następnie w reakcję wg schematu p-s.
W ten sposób przebiega każda reakcja spalania paliwa gazowego.
10Źródło ciepła - definicje, typy, przykłady źródeł ciepła ich kaloryczność, moc,temp.
Źródło ciepła (bodziec energetyczny)-dowolny impuls cieplny, mający niezbędny (wystarczający w danych warunkach ) zapas energii cieplnej do zapoczątkowania reakcji spalania.
1.Punktowe(Q+ światło), są to takie bodźce, które oddziałują na ściśle określoną powierzchnie lub objętość(temp.pow.400ºC),zaliczamy do nich:
a)płomień zapałki
b)tlący się papier
c)żarzące się cząstki sadzy
2.Ciągłe (tylko ciepło) inicjują samozapłon. Zaliczamy do nich wszystkie nagrzane powierzchnie instalacji, mające temp. niższą niż 400ºC,mają energię nie świecą.
Inicjator spalania jest to ilość ciepła dostarczone przez źródło do układu palnego w stosunku do wartości ciepła spalania jednostki masy paliwa.
-niskoenergetyczne małe Q-kilka do kilkunastu kJ
-wysokoenergetyczne -duże Q- duża moc strumienia ciepła kJ, MJ.
Źródłem ciepła jest nawet najmniejszy impuls ciepła lecz nie każdy impuls wystarczy, by om świecił, musi oj by ć wystarczająco duży. Dlatego dzieli się je na punktowe i ciągłe. Źródła ciepła nazywane jako symulator pożarowy to takie impulsy cieplne, które w warunkach laboratoryjnych odtwarzają warunki pożarowe, tzn. podczas spalania dają strumień ciepła zbliżony do mocy strumienia ciepła, tworzącego się w pierwszej fazie pożaru. Najczęściej są to, moce rzędu od kilkudziesięciu do stu kJ.
Źródła ciepła -symulatory pożaru
Jednorodne Kombinowane
Jednoczesne oddziaływanie
źródeł płomieniowych i
bezpłomieniowych
O działaniu ogólnym Lokalne efekty Duża intensywność
(bezpośrednie zetknięcie np.:pożar fotela, pożaru(14-17 W/cm2,
się ze źródłem płomieni): stosu drewna. Tzn.140-170 kW/m2)
-zapałka
-tlący papieros
-rozżarzone cząstki metalu
Symulatory dzielimy na jednorodne, tzn. takie źródła, które składają się z jednego rodzaju materiału, ich oddziaływanie polega ma bezpośrednim zetknięciu się z materiałem. Drugi typ to duże źródła ciepła o lokalnym działaniu. Trzeci typ to źródła o dużej intensywności.
Symulatory pożaru kombinowane (łączone) to taki typ symulatorów pożarowych, które oddziałują na materiał palny jednocześnie płomieniem i warstwą tlącą lub żarzącą się (powierzchnie nie rozłożone ).Temperatura źródła ciepła ma maksymalną wartość w obszarze działania źródła ( płomień ).
11. Charakterystyka płomieniowych źródeł ciepła : iskry elektrycznej i iskry mechanicznej. Mechanizm zapłonu substancji palnej od iskry elektr. tzn. wyjaśnić jakie po kolei zjawiska doprowadzają do zapłonu.
Iskra mech.- jest to oddzielona od podłoża cząstka masy, rozgrzana do takiej temp., że występują zjawiska świecenia i przemieszczająca się w środowisku z określoną prędkością. Dzielimy je na:
Iskry tarcicowe: powstają w przypadku tarcia dwóch ciał mechanicznych, głównie metali dobrze przewodzących ciepło
Iskry udarowe: powstają podczas zderzenia się dwóch ciał metalicznych lub ciała metalicznego z ciałem niemetalicznym np. beton. W chwili zderzenia Ekin zamieniana jest na energ. odkształcenia sprężystego lub plastycznego, a w miejscu uderzenia w warstwie powierzchniowej o grubości ułamka mm wytwarza się wysoka temp. rzędu 1200K.
Ze względu na własności chemiczne iskry mechan. dzielimy na:
Iskry mechaniczne aktywne (czynne)- reagujące z otaczającym je środowiskiem.
Iskry mechanicznie bierne
Iskra elektr.- zjonizowany gaz ogrzany do temp. od 6000-20000 K. Temp. zależy od parametrów obwodu elektrycznego.
Mechanizm zapłonu od iskry elektr. polega na wytworzeniu się w mieszaninie odpowiedniego bilansu cieplnego. Po stronie dochodów ciepła jest ciepło, które dostarcza iskra oraz ciepło utleniania się tej mieszaniny zwane ciepłem reakcji. Po stronie strat jest ciepło wypromieniowane z mieszaniny do otoczenia. Jeśli straty ciepła przewyższą akumulację ciepła wtedy iskra nie ma wystarczającej zdolności zapłonowej, aby zapalić mieszaninę. W chwili, kiedy mieszanina palna osiągnie temp. samozapłonu wtedy straty ciepła są równoważone ciepłem reakcji. Taka temp. odpowiada krtytycznej wartości promienia mieszaniny palnej zapalonej przez iskrę. Problem zapłonu polega na tym, że iskra musi mieć pełną energię (MEZ), która jest wystarczająca do ogrzania mieszaniny do jej temp. samozapłonu.Aby zaistniały te warunki musi być odpowiedni stan cieplny mieszaniny. Stan cieplny mieszaniny zależy od objętości mieszaniny, która przyjmuje ciepło od iskry, od ilości ciepła, którą przekazuje iskra oraz od sposobu dystybucji tej energii cieplnej w przestrzeni międzyelektrodowej. Im mniejszej objętości mieszaniny jest oddawane ciepło. tym szybciej się ona zapala i ma wyższą temperaturę.
Zakładamy, że mamy stechiometryczną mieszaninę metanu z powietrzem, tzn. 8,8% CH4 a reszta powietrze. Temp. samozapłonu CH4 wynosi 6200C, temp. spalania tej mieszaniny wynosi 13000C. Jeśli ciepło iskry jest przekazywane np. objętości 1,24 mm3, to aby ją ogrzać do temp.7000C musimy dać strumień ciepła 3,7 kJ w czasie 3,4 ms, natomiast jeżeli w tych samych warunkach ten sam strumień ciepła będzie ogrzewał 0,98 mm3, to wzrost temp. do 13000C nastąpi po 2 ms. Czyli promień mieszaniny decyduje o transmisji ciepła i jego rozprzestrzenianiu się.
Warunkiem zapłonu mieszaniny od iskry elektrycznej jest relacja między temperaturą spalania tej mieszaniny, a jej temp. samozapłonu. Jeśli iskra przeskakuje przez mieszaninę -oddaje część ciepła, czyli ochładza się, a mieszanina nagrzewa. Warunkiem powstania zapłonu jest zrównoważenie bilansu cieplnego w objętości mieszaniny. Wówczas temp. iskry osiąga (wewnątrz mieszaniny) temp. zapłonu tej mieszaniny, straty ciepła są równoważone ciepłem redukcji(spalania). Warunkiem aby mieszanina w całej objętości nagrzała się do temp. samozapłonu jest, aby promień mieszaniny był równy lub większy od: r ≥ 2 √δm gdzie δm - grubość czoła płomienia ( cienka, zewn. warstewka płomienia mająca najwyższą temp. w płomieniu). Warunek ten jest spełniony jeżeli promień krytyczny mieszaniny jest dużo większy od 10-cio krotnej grubości czoła płomienia: rkr >> 10 δm
12 Minimalna energia zapłonu MEZ
Jest to minimalna energia bodźca energet. mogąca spowodować zapłon. W przypadku mieszanin gazowych całe ciepło z bodźca energet. np. z iskry elektr. idzie na ogrzanie mieszaniny i jej utlenianie. W przypadku mieszaniny palnej wielofazowej całe ciepło iskry idzie na odparowanie (ciecze), utlenianie par cieczy, rozkład termiczny np. ziaren pyłu (endotermiczny), utlenianie części lotnych powstałych z rozkładu termicznego ziaren pyłu. Praktycznie aby określić zdolność zapalczą bodźca energet. takiego jak iskra elektr. nie podaje się jej temp. a podaje się jej minimalną energię zapłonu. Różnice MEZu dla mieszanin palnych o różnych stanach skupienia są bardzo duże:
Gazy 0,001 mJ - 0,01 mJ
Ciecze 0,01 mJ 0- 0,1 mJ (zależy od ciepła parowania)
Pyły 1 mJ - kilkuset mJ
13. Co to jest materiał palny i materiał niepalny.
Materiał palny -jest to taki materiał, który utlenia się w warunkach normalnych lub po podgrzaniu ulega rozkładowi termicznemu, którego produkty są palne (np. drewno, produkty celulozowe.)
Materiał niepalny - jest to taki materiał, który nie utlenia się w warunkach normalnych lub nie ulega rozkładowi termicznemu lub też ulega rozkładowi termicznemu dając niepalne produkty rozkładu. (np. wszystkie węglany, krzemiany, marmury, cegły, żelbet, beton)
14. Co to znaczy bezwładność cieplna materiałów i jak wpływa ona na zapalność materiałów.
Bezwładność cieplna - jest to iloczyn gęstości, ciepła właściwego oraz współczynnika przewodnictwa ciepła.
Im bezwładność cieplna materiałów jest mniejsza tym materiały mają większą podatność do zapoczątkowania reakcji spalania i odwrotnie. Przy dużych wartościach bezwładności substancja jest trudnozapalna lub nie pali się w ogóle.
16. Wybuch deflagracyjny
Deflagracja jest to taki wybuch chemiczny, podczas którego szybkość rozprzestrzeniania się czoła płomienia w mieszaninie jest stała a rozprzestrzenianie się wybuchu następuje przez lokalne ogrzewanie mieszaniny wybuchowej. Mechanizm rozprzestrzeniania się płomienia opiera się na transferze ciepła (na drodze przewodnictwa i promieniowania w ciałach stałych oraz na drodze przewodnictwa, promieniowania i konwekcji w gazach). Podczas deflagracji prędkość rozprzestrzeniania się płomienia jest prędkością poddźwiękową, a typowa szybkość wybuchu (prędkość rozprzestrzeniania się płomienia) może zmieniać się od niskich wartości, tzn. cm/s do szybkości poddźwiękowej ok. 100 m/s. W przypadku deflagracji fale ciśnienia poprzedzają front płomienia (fale ciśnienia i płomień oddzielone); fale ciśnienia są ciągłe (dP/dt). Ponieważ deflagracja może przebiegać stosunkowo wolno a mechanizm rozprzestrzeniania deflagracji jest taki sam jak rozprzestrzenianie pożaru ( tzn. przenoszenie ciepła) to deflagracja jest czasami nazywana „spalaniem wybuchowym”. Przykłady deflagracji: explosion „BLEVE-FIREBALL”, „BLEVE”- boiling liquids expanding vapor explosion, “UNYC-unconfined- vapor cloud”.
17. Definicja detonacji. Różnica między detonacją a deflagracją.
Detonacja - samoistna, samorozprzestrzeniająca się fala uderzeniowa sprzężona z chemiczną reakcją spalania. O ile falę uderzeniową można zdefiniować jako bardzo małą objętość, w której następuje skokowy wzrost ciśnienia powstały w wyniku nakładania się cząstkowych fal ciśnieniowych, o tyle fala detonacyjna jest to fala uderzeniowa zasilana przez reakcję spalania.
W przypadku deflagracji mechanizm rozprzestrzeniania się wybuchu opiera się na transferze ciepła natomiast mechanizm rozprzestrzeniania się detonacji nie jest oparty na przenoszeniu ciepła, ale na bardzo szybkim i ostrym sprężaniu przebiegającym w fali uderzeniowej. Granice wybuchu deflagracyjnego są stosunkowo szerokie (szczególnie dla gazów) natomiast granice wybuchu detonacyjnego są bardzo wąskie (z wyjątkiem acetylenu i wodoru). Przy deflagracji jest znacznie większe prawdopodobieństwo trafienia stężenia pomiędzy DGW a GGW niż w przypadku granic detonacyjnych ( z wyjątkiem acetylenu i wodoru ). Minimalne energie zapłonowe (MEZy) dla deflagracji są bardzo niskie a dla detonacji bardzo wysokie. Charakterystyczną cechą jest prędkość rozprzestrzeniania się wybuchu- w przypadku wybuchu deflagracyjnego max. 100 m/s natomiast wybuchu detonacyjnego od 800 m/s (pary cieczy) do kilku km/s (gazy- acetylen, wodór ok.3 km/s).
19. Mechanizm zapłonu substancji od iskry mechanicznej.
Mamy 3 definicje pojęcia „iskra mechaniczna”
Iskry mechaniczne są to cząstki masy oderwane od podłoża wskutek oddziaływania mechanicznego (tarcia lub uderzenia), ogrzane do takiej temperatury, że świecą i przemieszczające się w środowisku z określoną prędkością.
Iskra mechan. jest to iskra, która powstaje w wyniku tarcia, uderzenia, spawania albo stałych powierzchni jedna o drugą, albo też powierzchni rozdrobnionych o powierzchnie starte, albo pow. stałych rozdrobnionych o pow. rozdrobnione.
Iskra mechan. jest ot oddzielona od podłoża cząstka masy, rozżarzona do temperatury, w której zachodzą zjawiska świetlne; przemieszczająca się w środowisku z określoną prędkością.
Iskry mechaniczne możemy podzielić na:
tarciowe (powstają w przypadku tarcia 2 ciał metalicznych)
udarowe (powstają podczas zderzenia 2 ciał metalicznych lub ciała metalicznego z niemetalicznym. Uderzenie polega na dynamicznym kontakcie ciał poruszających się ukośnie względem siebie. W czasie uderzenia energia kinetyczna ciała zostaje zamieniona na energię odkształcenia sprężystego, plastycznego oraz ciepło. W czasie uderzenia w warstwie powierzchniowej w czasie 10-4÷10-3 s tworzy się bardzo wysoka temp. (ponad 1000οC). Ta oderwana cząstka ogrzana do wysokiej temp. nazywa się iskrą udarową.
Mechanizm zapłonu od iskry mechanicznej (czynnej) powstaje podczas spawania elektrycznego.
Najczęściej elektrody spawalnicze składają się ze stali niskostopowej (tzn. zawierają 96% Fe i 4% C).
Załóżmy, że odrywa się kawałek elektrody, np. o średnicy 2cm. Na skutek sił grawitacji kawałek ten leci na dół i ogrzewa się w wyniku 2 zjawisk: na skutek okopu powietrza (tarcie) i utleniania; podnosi się temperatura tego rozrzutu. Na skutek zmiany temp. powietrza istniejącego w otoczeniu tego rozrzutu w stos. do zimnego powietrza następuje zmiana przepływu powietrza w otoczeniu rozrzutu z laminarnego w turbulentny. Na skutek utleniania żelazo (Fe) przechodzi w Fe2O3, natomiast węgiel zawarty w stali utlenia się do CO i CO2 tworząc zewnętrzną otoczkę gazową. Przy dalszym opadaniu rozrzutu (przy jego bardzo wysokiej temp.) wzrasta prężność otoczki zewnętrznej, co powoduje, że pęka ona rozpryskując materiał rozrzutu i tzw. żużla na różne odległości. W dalszym ciągu opadania tego rozrzutu zjawisko to postępuje coraz głębiej, co powoduje dalszy wzrost temp. i w pewnej odległości powstanie, z całej masy materiału stałego zawartego w żużlu, dużej ilości rozprysków spawalniczych.
Zmiana temp. rozrzutu spawalniczego przy spadaniu pionowym rozrzutu w funkcji odległości od miejsca jego powstania:
Przy spawaniu elektrycznym, w którym odpadająca elektroda leci pionowo w dół, na 1m2 podłoża, na które ona spada może powstać kilkadziesiąt drobnych rozrzutów spawalniczych.
Temperatura żużli spawalniczych w funkcji odległości od miejsca spawania (rozrzut poziomy):
20. Różnica między czynną i bierną iskrą mechaniczną. Sposób oceny zdolności zapłonowej iskry mechanicznej.
Ze względu na własności chemiczne iskry mechan. dzielimy na aktywne (czynne) i bierne.
Iskra mechaniczna czynna jest to taka iskra, która reaguje z otoczeniem. Do iskier takich zalicza się przede wszystkim rozrzut spawalniczy.
Przykładem iskry aktywnej są wszystkie iskry tworzące się w wyniku tzw. reakcji termitowej. Reakcja ta przebiega wg następującego zapisu: 2Al+Fe2O3=2Fe+Al2O3+ciepło
Z 2gramo-atomów Al powstaje ok. 1000kJ ciepła, co powoduje, że cząstka ogrzana jest (ogrzewa się) do temp. ponad 2000°C. Jest to jedna z najbardziej niebezpiecznych iskier, ponieważ jej temp. przewyższa wszystkie temperatury samozapłonu wszystkich ciał palnych.
Iskry bierne są to takie iskry, które nie reagują z otoczeniem (np. blacha miedziana; nie utlenia się mimo, że po uderzeniu odrywa się cząstka-kawałek o wysokiej temp.)
Do iskier biernych zaliczamy takie iskry, które:
po pierwsze są metalami, które szybko ulegają pasywacji, tzn. pokrywają się swoim własnym tlenkiem, a więc nie może przebiegać dalszy proce ich utleniania, co powoduje, że w czasie lotu nie wzrasta ich temp., a wręcz przeciwnie-energia cieplna zawarta w takiej cząstce ulega rozproszeniu w atmosferze (np. miedź, brązy, beryle, stopy miedzi)
po drugie są natury termodynamicznej, tzn. są to takie cząstki mechaniczne, które do utleniania i w konsekwencji do spalania potrzebują bardzo dużych energii.
Temperatura iskry biernej jest największa w chwili oderwania się od podłoża, a później temp. ta maleje.
Problem zapłonu od iskry ELEKTRYCZNEJ polega na tym, że iskra musi mieć pewną energię (MEZ- minimalna energia zapłonowa), która jest wystarczająca do ogrzania mieszaniny palnej do temp. samozapłonu.
Praktycznie aby określić zdolność zapalczą iskry elektr. nie podaje się jej temperatury, a podaje się jej MEZ. Dlatego różnice MEZ'u dla mieszanin palnych o różnych stanach skupienia są bardzo duże:
-gazy MEZ 0,001mJ÷0,01mJ (bardzo niska energia zapłonu bo już są w stanie gazowym)
-ciecze MEZ 0,01mJ÷0,1mJ (to, która ciecz ma większy, czy mniejszy MEZ zależy od ciepła parowania)
-pyły MEZ 1mJ÷kilkuset mJ (dużo ciepła idzie tu na rozkład-pirolizę)
21. Co to są produkty spalania? od czego zależy ich kaloryczność, jak oblicza się temperatura spalania?
Produktami spalania - nazywamy produkty powstające w wyniku reakcji spalania.
Produkty spalania charakteryzują reakcję spalania, umożliwiając wyliczenie różnych parametrów charakterystycznych dla tej reakcji, np. : temperatura spalania.
Rozróżnia się wilgotne i suche produkty spalania. Wilgotnymi produktami spalania-nazywamy całkowitą objętość tworzących się w procesie spalania produktów łącznie z tworzącą się podczas spalania para wodną. Jeśli w objętości powstałych produktów spalania nie uwzględni się objętości pary wodnej, produkty te nazywają się suchymi produktami spalania. Skład produktów spalania wyraża się w procentach objętościowych lub m3 liczonych na kg substancji palnej.
Temperaturę spalania oblicza się ze wzoru: Tsp= Qsp/(ϑ'c'+ϑ”c”).
Qsp- ciepło spalania
Tsp- temperatura spalania
ϑ'-teoretyczna objętość produktów spalania
ϑ”-objętość nadmiaru powietrza
c'- średnie ciepło właściwe produktów spalania
c”- średnie ciepło właściwe powietrza w temperaturze od T do Tmax
22. Związek między temperaturą spalania a temperaturą pożaru
temperatura spalania - uśredniona wielkość temperatury spalania produktów spalania.
Temperatura spalania zależy od:
kaloryczności układu
rodzaju materiału spalanego
współczynnika nadmiaru powietrza α
wysokości na której mierzymy te temperaturę spalania
budowy struktury
budowy paliwa
Temperatura spalania jest funkcją ciepła spalania. Temperatura spalania materiałów stałych oscyluje w granicach 1000oC.
Temperatura pożaru - średnia temperatura gazów spalinowych, które tworzą się w warunkach pożaru ( CO2, CO, H2O ) - główne gazy spalinowe
23.Opisć w jaki sposób przebiega proces spalania cieczy. Co wpływa na ten proces, szczególnie na szybkość jego przebiegu.
Spalanie cieczy zachodzi nie w ten sposób ,że nie pali się ciecz ale palą się jej pary. Każda ciecz przed zaistnieniem zjawiska spalania musi przejść w stan lotny co wiąże się z wykorzystaniem dostarczanej energii z zewnątrz. Pali się mieszanina par cieczy z powietrzem pod warunkiem że stężenie par mieści się w granicach wybuchowości. W wyniku spalania się par nad powierzchnią cieczy emitowana jest energia cieplna która w między innymi powoduje dalsze ogrzewanie cieczy, co przyspiesza proces spalania.
Na proces spalania cieczy wpływ ma prężność pary, dyssypacja (szybkość z jaką rozprzestrzenia się dana para w atmosferze), dyfuzja oraz szybkość parowania.
Ciecze mogą ulegać:
-zapłonowi
-samozapłonowi
-samozapaleniu
-deflagracji i detonacji
Masowa szybkość spalania jest to ilość gramów cieczy, która spaliła się z jednostkowej powierzchni tej cieczy, w jednostce czasu.
msp = (QF - QL)/LV , jednostka [g/(m2*s)]
QF - ciepło dostarczone z płomienia do substancji palnej [kW/m2]
QL - straty ciepła z płomienia w czasie spalania [kW/m2]
LV - ciepło gazyfikacji [kJ/g] dla cieczy - ciepło parowania
QF jest zależne od ciepła spalania danej substancji.
LV jest funkcją temperatury wrzenia.
Szybkość spalania jest funkcją obciążeń cieplnych. Ma ono największy wpływ na szybkość spalania. Obciążenie jest funkcją charakterystyki spektralnej płomienia tworzącego się w tych warunkach.
W przypadku dużych zbiorników, które zawierają paliwa ciekłe, przy określaniu szybkości spalania należy uwzględnić przewodnictwo cieplne przez ściany zbiornika w czasie pożaru.
24. Jaka jest różnica między spalaniem się cieczy jednorodnych /jedna substancja/ i mieszanin cieczy.
Jeśli w czasie pożaru spala się ciecz jednorodna (jeden rodzaj cieczy, np. aceton, spirytus), to wtedy tworząca się warstewka przegrzana, o temp. wyższej niż temp. wrzenia tej cieczy, w czasie spalania nie zmienia swojej grubości. Oznacza to, że w miarę spalania się cieczy w pożarze przesuwa się ona w dół razem z lustrem cieczy.
Spalanie się cieczy niejednorodnych w dużych zbiornikach:
Sposób spalania się mieszanin cieczy w czasie pożarów dużych zbiorników różni się od sposobu spalanie się cieczy jednorodnych. Wynika to z tego, że mieszanina stanowiąca ropę naftową zawiera składniki o różnej temp. wrzenia. Te składniki, które mają bardzo niskie temp. wrzenia ulegają destylacji frakcjonowanej (rozdział na części), natomiast te, które mają wyższe temp. wrzenia w czasie pożaru opadają w dół. Powoduje to mieszanie się poszczególnych frakcji w wyniku czego warstwa przegrzana powiększa swą grubość i systematycznie przesuwa się w dół.
Takie zjawiska jak wykipienie i wyrzut są możliwe tylko podczas pożarów mieszanin cieszy palnych, w których skład wchodzi woda. W cieczach jednorodnych nie zajdzie takie zjawisko.
25.Mechanizm zapłonu cieczy.
Zapłon jest to zapoczątkowanie procesu spalania od punktowego bodźca energetycznego. Stężenie par cieczy zależy od prężności pary nasyconej cieczy w danej temp. To ile jest tych par zależy od rodzaju cieczy i temp. Ciecze posiadające wysoką prężność pary mają dużą szybkość parowania i na odwrót. Pary cieczy utleniają się, a nie ciecz. Warunkiem zaistnienia zapłonu jest wytworzenie takiej ilości ciepła w sferze oddziaływania bodźca punktowego energetycznego w fazie gazowej, że temp w tej sferze osiągnie wielkość temp samozapłonu cieczy. Jeżeli jest mało par cieczy to ciepło w wyniku utleniania jest zbyt małe, nie jest przekazywane na dalsze cząsteczki a całe ciepło idzie na straty. Jeżeli jest więcej par to nie całe ciepło idzie na straty ale ogrzewane są inne cząsteczki. Jest tyle ciepła że temp osiąga wartość temp samozapłonu. Płomień powstaje nad bodźcem, przesuwa się później po cieczy i gaśnie. W zbyt niskiej temp jest zbyt mało par, dopiero po podgrzaniu następuje wzrost stężenia par. Zapłon zachodzi szybciej niż samozapłon bo mamy już bodziec energetyczny. Stężenie przy którym zapłon jest już możliwy to DGW. Zapłon jest to stan równowagi bo podgrzewając ciecz ona paruje, a jednocześnie skrapla się. Jest to stan równowagi odwracalnej. Przy zapłonie nie cała mieszanina ulega zapłonowi ale tylko ta, która jest w okolicach bodźca.
26. Opisać mechanizm samozapłonu cieczy.
Samozapłon może nastąpić od różnych powierzchni grzewczych <najczęstszy przypadek w przemyśle> do instalacji elektrycznej. Załóżmy że mamy temperaturę początkową T0 cieczy 200C w tej temp substancji nic się nie dzieje. Załóżmy że mamy T1 500C wtedy substancja paruje, utlenia się ale ciepło utleniania jest zbyt niskie, aby ciecz samo nagrzewała się. Załóżmy że mamy T2 2000C niech to będzie np. benzyna <ciecz o niskiej temp samozapłonu> jeżeli T2= 2300C ciecz ta ogrzeje się to pary w wyniku utleniania zaczną się grzać, że powstaje taka sytuacja, że nawet po odsunięciu tej cieczy od gazowej powierzchni ciecz ta będzie się samo nagrzewała. Wynika to z faktu że spadek temp w tej cieczy w przeliczeniu na jednostkę długości w stosunku do normalnej =0.(dT/dn)n=0 =0 Oznacza to że ciecz nie traci ciepła i zaczyna się powolna akumulacja ciepła. Wystarczy teraz podgrzać tę powierzchnię i w konsekwencji ciecz o minimalną wartość aby bilans cieplny przechylił się. Ciecz ta zaczęła się samo nagrzewać i wystąpiła chemiluminescencja fazy lotnej czyli pojawił się płomień.
27.Wyjaśnić jakie związki wpływają na podniesienie temp samozapłonu cieczy.
Temp samozapłonu jest to najniższa temp cieczy w której nad powierzchnią tej cieczy w warunkach jej ogrzewania ciągłymi bodźcami energetycznymi nastąpi samorzutne pojawienie się płomienia. Warunkiem zaistnienia samozapłonu jest to aby prosta strat cieplnych leżała poniżej krzywej wydzielania ciepła. W takich warunkach HRR jest zawsze większa od HLR. Zastosowanie zbiorników ze ścianami żelaznymi <stalowymi> podwyższa temp samozapłonu w stosunku do zbiorników ze ścianami kwarcowymi np. eter dwuetylowy ze 120 do 140. Antydetonatory takie jak czteroetylenek ołowiu, pięciokarbonylek żelaza, i czteroetylek cyny. Benzyna jest mieszaniną węglowodorów. W miarę mieszania tlen z powietrza przyłącza się do łańcucha węglowodoru poprzez strukturę molekularną mostka nadtlenowego. Jest to wiązanie nietrwałe .Antydetonator wychwytuje tlen , sam się utlenia, czyli zmniejsza stężenie tlenu a przez to podnosi temp samozapłonu benzyny. Gdy mieszanina styka się z inhibitorem reakcji spalania temp podnosi się.
28.Jakie związki wpływają na obniżenie temp samozapłonu cieczy
Zastosowanie ścian kwarcowych zamiast żelaznych dla eteru dwuetylowego obniża temp ze 140 do 120. W miarę wzrostu stężenia tlenu w powietrzu i gdy mieszanina styka się z promotorem reakcji spalania - kwarcem i platyną.
29. Co to jest szybkość spalania cieczy i jak się ją definiuje dla różnych sposobów magazynowania?
Szybkość spalania cieczy jest to ubytek masy cieczy w jednostce czasu. Msp = (Qf - Ql)/Lv gdzie: Qf - ciepło dostarczane z płomienia do danej substancji, Ql - ciepło strat, Lv - ciepło gazyfikacji. W zależności od sposobu magazynowania rozróżniamy szybkość liniową <mm/min> i szybkość wagową <kg/ m2h>. Szybkość spalania zależy od ilości węgla w danej substancji np. benzen ma dużą szybkość spalania bo zawiera dużą ilość węgla w swoim składzie który podczas spalania bardzo się nagrzewa a potem emitując to promieniowanie nagrzewa lustro cieczy równie mocno co powoduje wyparowanie dużych ilości benzenu z reakcji spalania.
30. Wyjaśnić na czym polega mechanizm przegrzewania się cieczy i jakie ma on praktyczne skutki.
Ciecze które w trakcie spalania pod warstwą powierzchniową ogrzaną do temp wrzenia dają warstwe przegrzaną- o temp wyższej niż temp wrzenia tej cieczy. Grubosc tej warstwy zazwyczaj kilkumilimetrowa , w miare spalania się cieczy , tzn przesuwania się lustra cieczy w dół , nie ulega zmianie. Jest ona stała i nie ma wpływy na szybkość spalania cieczy w czasie pożaru. Aby ciecz spalała się w takich warunkach musi być to ciecz jednorodna musi mieć małą lepkość i musi być mały zbiornik ( φ < 20m ). Jeżeli pożar będzie miał miejsce w dużym zbiorniku a ciecz będzie pochodną ropy lub węgla ( mieszanina różnych substancji ) wówczas ma miejsce inny sposób przegrzewania się cieczy w środowisku pożarowym , tzn podpowierzchniowa warstewka przegrzana w czasie spalania poszerza swoją grubość i w miare obniżania się lustra cieczy i spalania się jej może powodować różne zjawiska wtórne- wykipienia i wyrzut.
31. Zinterpretować bardzo dokładnie zjawisko wykipienia .
Jest to jedne ze zjawisk wtórnych występujących podczas pożaru . Podstawową rolę w możliwości zaistnienia tego zjawiska ma obecność wody i sposób jej występowania w ropie . Woda może występować w postaci zawiesiny wodnej lub tzw. poduszki wodnej czyli warstwy wody istniejącej na dnie zbiornika. Samo zjawisko wykipienia jest to jednoczesne przejście w parę wodną większej ilości wody ( zawiesiny wodnej ) znajdującej się w produkcie naftowym (ropie) , powstanie piany na powierzchni cieczy , która może przelewać się przez ściany zbiornika , rozprzestrzeniając spalanie na sąsiednie obiekty . Warunki do wystąpienia wykipienia : a) ciecz będąca mieszaniną - tworząca warstwę przegrzaną o różnej grubości; b) odpowiednia zawartość wilgoci w postaci emulsji wodnej.
32. Zinterpretować bardzo dokładnie zjawisko wyrzutu.
Wyrzut podobnie do wykipienia jest zjawiskiem wtórnym występującym podczas pożaru . Warunkiem powstania wyrzutu jest obecność wody w zbiorniku z cieczą palną ( ropą ) . Wyrzut powstaje wówczas gdy woda w zbiorniku znajduje się na dnie zbiornika tworząc poduszkę wodną . W takich warunkach po dojściu warstwy przegrzanej do wody . Woda natychmiast przechodzi w stan pary . Wzrasta ciśnienie gdyż z 1 litra wody powstaje 1700l pary wodnej i cała masa nad powierzchnią wody zostaje wyrzucona na zewnątrz . Stąd nazwa zjawiska wyrzutu .
33. Jak wielkość zbiornika wpływa na sposób spalania się cieczy?
Rysunek zbiornika
Spalanie się cieczy w zbiornikach w warunkach pożarowych jest funkcją:
-wielkości zbiornika(wielkości powierzchni cieczy
-typu cieczy(rodzaju)
-czasu spalania się tej cieczy.
Aby określić zagrożenie pożarowe np. paliwa w zbiorniku, należy określić jego szybkość spalania. W odniesieniu do cieczy najczęściej określa się tzw. masową szybkość spalania. Masowa szybkość spalania jest to ilość gramów cieczy, która spaliła się z jednostki powierzchni tej cieczy[m2] w jednostce czasu[s]. Czyli mianem jest [g/m2*s]
msp=(QF-QL)/LV
Gdzie:
QF- ciepło dostarczone z płomienia do substancji[kW/m2]
QL- straty ciepła z płomienia w czasie spalania[kW/m2]
LV- ciepło gazyfikacji[kW/g] (dla cieczy ciepło parowania) - decyduje najbardziej o szybkości spalania.
W przypadku cieczy w dużych zbiornikach z cieczami, które zawierają paliwa ciekłe przy precyzyjnym określaniu szybkości spalania należy również uwzględnić przewodnictwo ciepła przez ściany zbiornika w czasie pożaru. Najbardziej nagrzewa się ta część ścian, która nie styka się bezpośrednio z cieczą. Powoduje to, że w czasie długotrwałego pożaru, ciepło to przekazywane jest głębiej położonym warstwom cieczy co wpływa w sposób znaczący na powstanie niebezpiecznych zjawisk jakimi są wykipienie i wyrzut.
Sposób spalania się mieszanin cieczy w czasie pożaru dużych zbiorników różni się od sposobu spalania się cieczy jednorodnych w dużych zbiornikach. Wynika to z tego, że mieszania stanowiąca ropę naftową zawiera składniki o różnej temperaturze wrzenia. Te składniki, które mają bardzo niską temperaturę wrzenia ulegają destylacji frakcjonowalnej, natomiast te, które mają wyższe temperatury wrzenia w czasie pożaru opadają w dół. Powoduje to mieszanie się poszczególnych frakcji w wyniku czego warstwa przegrzana powiększa swą grubość i systematycznie w czasie pożaru przesuwa się w dół
35. Co różni granice zapalności par a granice zapalności gazów.
DGW -najniższe stężenie składnika palnego w mieszaninie z powietrzem lub innym gazem utleniającym, przy którym zapłon jest już możliwy.
GGW -najwyższe stężenie składnika palnego w mieszaninie z powietrzem lub innym gazem utleniającym, przy którym zapłon jest jeszcze możliwy.
Granice zapalności są wielkościami stałymi, ale zależą od pewnych czynników. Jednym z nich jest temperatura (inne: ciśnienie, domieszka gazów obojętnych, energia źródła zapłonu, kierunek propagacji płomienia).
Z wykresu zależności stężenia od temperatury widać wyraźnie, że stężenie par równe DGW w cieczy powstaje dokładnie w ich temperaturze zapłonu. Dlatego temperatura zapłonu i DGW par są ze sobą ściśle związane, Temperatura zapłonu wskazuje najniższą temperaturę cieczy przy której mieszanina par cieczy z powietrzem jest palna, DGW wskazuje stężenie par w tej mieszaninie.
To stwierdzenie nie dotyczy gazów, bo gazy nie mają temperatury zapłonu. Gazy ulegają zapłonowi w każdej temperaturze powyżej temperatury wrzenia. Dlatego nie można powiedzieć, że temperatura zapłonu jest ściśle związana z DGW.
36.Zróżnicować opis charakterystyki spektralnej płomienia tworzącego się podczas spalania np.C2H5OH i C7H14 (benzyny).
Charakterystyka spektralna płomienia, który tworzy się w czasie pożaru uzależniona jest od zawartości węgla pierwiastkowego w płomieniu. Jeśli zawartość węgla w paliwie jest ponad 50% to wtedy płomień jest silnie świecący, kopcący o dużej gęstości dymu. W paliwach o dużej zawartości tlenu lub braku w strukturze węgla rodzaj emisji zmienia się i płomień może stać się niewidzialny
M C2H5OH = 2*12+16+6*1=24+16+6=46
C%=24/46*100%=52%
Zawartość węgla w C2H5OH wynosi 52%, płomień więc powstający podczas spalania etanolu będzie płomieniem jasno świecącym , słabo kopcącym.
MC7H14= 7*12+1*14=84+14=98
%C=84/98*100%=85%
37. Klasyfikacje cieczy obowiązujące w PSP.
1067
Rozporządzenie ministra gospodarki
z dnia 20 września 2000r.
w sprawie warunków technicznych jakim powinny odpowiadać bazy i stacje paliw płynnych, rurociągi dalekosiężne do transportu ropy naftowej i produktów naftowych i ich usytuowanie;
§3. W rozumieniu niniejszego rozporządzenia ropę naftową i produkty naftowe, z wyjątkiem gazu płynnego, w zależności od temperatury zapłonu zalicza się:
do I klasy-ropę naftową i produkty naftowe o temperaturze zapłonu do 296,15 K (23°C)
do II klasy - produkty naftowe o temperaturze zapłonu wyższej od 296,15 K (23°C) do 334,15 K (61°C)
do III klasy - produkty naftowe o temperaturze zapłonu wyższej od 334,15 K do 373,15 K (100°C).
Zawartość węgla w C7H14 wynosi 85%. Płomień powstający podczas spalania benzyny będzie płomieniem świecącym ,silnie kopcącym o dużej gęstości dymu o wiele większej niż płomień C2H5OH.
38. Mechanizm spalania się materiałów stałych (zanalizować wpływ termostabilności, ciepła gazyfikacji, ciepła dysocjacji na podatność do inicjacji reakcji spalania).
Zjawiska zachodzące podczas spalania się materiałów stałych.
gazy niepalne
materiał palny rozkład termiczny gazy palne powietrze zapłon lub zapalenie ……
-Q mieszaniny gazowej
produkty ciekłe
proces endotermiczny pozostałość zwęglona
…płomień produkty spalania energia cieplna zwrócona z płomienia
do materiału ( energia feedback)
proces egzotermiczny
Spalanie się palnych stałych materiałów organicznych ma pewną specyfikę, która różni się od spalania palnych nieorganicznych materiałów stałych.
Stały palny materiał nieorganiczny : np.:siarka, aluminium (metale, niemetale).
Siarka podczas ogrzewania topi się, aluminium się topi i nie ulega rozkładowi.
Materiały nieorganiczne nie ulegają rozkładowi termicznemu!
Aby proces spalania materiałów palnych organicznych zachodził w sposób ciągły, tak jak odbywa się to w środowisku pożarowym to pewna ilość energii z płomienia musi być zwrócona do powierzchni materiału palnego. Ponieważ w czasie spalania 70% ciepła jest wypromieniowywane jako strumień ciepła promieniowania a strumień ten rozchodzi się we wszystkich kierunkach, część tego strumienia-zwany energią zwróconą wraca z powrotem do powierzchni materiału palnego. Im wyższy ten strumień tym większa szybkość spalania.
Rozkład termiczny ciał stałych jest to rozkład ciała stałego pod wpływem strumienia ciepła na produkty lotne i pozostałość zwęgloną (pozostałość może występować lub nie).
Ciepło gazyfikacji jest to ilość ciepła, którą trzeba dostarczyć do jednostki masy paliwa aby otrzymać 1g produktów lotnych (kJ/g).
Ciepło gazyfikacji Lv jest decydującym elementem w szybkości tworzenia się środowiska pożarowego, im jest ono mniejsze tym szybkość spalania materiałów stałych jest większa.
Lv dla materiałów stałych jest większe niż dla cieczy.
Dla paliw zwęglających się Lv jest inne niż dla nie zwęglających się, czyli m=Qpł/Lv (intensywność spalania w środowisku pożarowym).
Wszystkie tworzywa termoplastyczne mają z reguły niższe ciepła gazyfikacji, stąd też wyższą szybkość spalania a termoplastyczne mają wysokie ciepła gazyfikacji i wolniej tworzą środowisko pożarowe.
Ciepło gazyfikacji dla cieczy jest tożsame z ciepłem parowania.
O podatności do spalania ciał stałych decyduje szybkość rozkładu termicznego(pirolizy, dysocjacji termicznej)tzn. im niższa początkowa temperatura rozkładu, im niższa temperatura maksymalnego ubytku masy tym więcej się tworzy fazy lotnej i tym szybciej materiał palny zapala się.
Materiał, który ma niskie temperatury rozkładu nazywa się nietermostabilnym a ten , który ma wysokie temperatury rozkładu-termostabilnym.
Rozkład termiczny zależy od ciepeł gazyfikacji poszczególnych materiałów. Ciepło gazyfikacji jest funkcją( i zależy) od:
- stanu skupienia paliwa (najwyższe - ciała stałe),
-ciężaru cząsteczkowego; im cięższe paliwo tym wyższe ciepło gazyfikacji,
-struktury paliwa stałego, która decyduje o tym czy w środowisku pożaru paliwo zwęgla się, czy nie zwęgla się. Zwęglają się tworzywa termoutwardzalne, nie zwęglają się termoplastyczne.
Ciepło gazyfikacji paliw zwęglających się jest duże, dużo większe od paliw nie zwęglających się.
41. Wytłumaczyć pojęcie bezwładności cieplnej materiału i związek tej wielkości z zapalnością.
Bezwładność cieplna materiału - jest to ilość ciepła, które może pochłonąć materiał albo odparować. Jest to iloczyn λ*ρ*cp gdzie:
λ - współczynnik przewodnictwa cieplnego ( izolacji powłoki) wszystkich materiałów występujących w kablu najczęściej uwzględnia się tylko λ zewnętrznej powłoki.
ρ - gęstość poszczególnych warstw kabla w obliczeniach przyjmuje się średnią gęstość liczoną ze wszystkich warstw.
cp - ciepło właściwe przewodnictwa cieplnego ( izolacji powłoki) ponieważ jest ono zbliżone dla różnych warstw przyjmuje się cp powłoki.
Związek bezwładności cieplnej materiału z zapalnością.
Im większa bezwładność cieplna materiału tym zapalność mniejsza.
43. Jakie własności drewna decydują o podatności do zapalenia drewna (przykłady).
O podatności do zapalenia drewna decydują następujące własności drewna :
ciepło właściwe - ilość ciepła potrzebna do ogrzania jednostki masy o 1ºC [kJ/gºC]
przewodnictwo cieplne - zdolność danego ciała do przewodzenia ciepła.
Przewodnictwo cieplne zależy głównie od :
budowy anatomicznej drewna - ogólnie gatunki iglaste (sosna, świerk) spalają się znacznie lepiej niż gat. liściaste (dąb, brzoza, lipa)
gęstości drewna - jest to zależność liniowa, w miarę wzrostu gęstości rośnie proporcjonalnie przewodnictwo cieplne drewna. Dlatego też aby zapalić ciężkie drewno (np. grab, dąb, buk, jesion) musimy podziałać o wiele większym strumieniem ciepła niż w przypadku drewna lekkiego (np. lipa, topola, balsa, świerk, sosna). Przykład - temperatura samozapłonu balsy wynosi 120ºC, lipy, świerku i sosny 360ºC natomiast dębu 450ºC akacji 480ºC.
kierunku przebiegu włókien - anizotropia przewodnictwa cieplnego polega na tym, że współczynnik przewodnictwa cieplnego jest wzdłuż włókien 1.8 razy większy niż w kierunku prostopadłym do przebiegu włókien.
wilgotności - przyjmuje się, że w przedziale 5÷35% wilgotności wzrost wilgotności o 1% powoduje wzrost przewodnictwa cieplnego średnio o 1.25%
temperatury drewna - w miarę wzrostu temperatury przewodność cieplna drewna rośnie tym bardziej im większa jest gęstość drewna, wypełnione powietrzem pory powodują obniżenie przewodności cieplnej. Istotną rolę odgrywa wilgotność drewna. Gdy drewno jest suche - wpływ temperatury jest niewielki. Inaczej w przypadku drewna wilgotnego.
44. Jakie własności drewna decydują o szybkości spalania drewna (przykłady).
Szybkość zwęglania (spalania) drewna zależy od :
gęstości drewna (ciężaru objętościowego) - szybkość spalania maleje wraz ze wzrostem gęstości, czyli drewno o dużej gęstości np. gwajak, dąb, heban spala się szybciej od drewna o mniejszym ciężarze objętościowym (balsa, lipa, topola)
warunków cieplnych, w których się ją wyznacza - temperatura środowiska
budowy anatomicznej
wilgotności
sposobu ogrzewania (dopływ powietrza)
powierzchni właściwej (stosunek powierzchni do objętości) - im mniejsza powierzchnia właściwa tym mniejsza szybkość spalania. Dlatego też np. mączka czy wiór spalają się z dużą szybkością, natomiast drewniane belki o dużych małej powierzchni właściwej palą się o wiele wolniej.

Aby zmniejszyć zagrożenie pożarowe stwarzane przez materiały drewnopochodne pokrywa się je środkami ognioochronnymi, które zmieniają ich klasyfikację na średnio lub trudnozapalne, co w konsekwencji daje możliwość ich szerszego zastosowania w budownictwie.
49.Klasyfikacje tworzyw mające wpływ na sposób ich spalania.
Tworzywa (tworzywo = polimer) można podzielić ze względu na sposób ich spalania na:
I.
1.Tworzywa naturalne (drewno (C6H10O5)n, polisacharydy ,wełna, len, bawełna, czysta celuloza).
2.Tworzywa sztuczne (włókna np:celuloza+CS2 ,włókno wiskozowe-jeden surowiec naturalny występujący w przyrodzie a drugi sztuczny nie występujący w przyrodzie a otrzymany w wyniku reakcji chemicznych).
3.Tworzywa syntetyczne (np.: anilana, elana).
II. Ze względu na własności fizyczne takie jak: moduł sprężystości i stopień wydłużenia.
1.Elastomery (charakteryzują się bardzo dużą elastycznością, która jest odwracalna w temperaturze pokojowej, włókna celulozowe, poliestrowe, anilana)
2.Plastyki (mają tylko częściową odkształcalność i odwracalność własności fizycznych).
Plastyki dzielimy na:
termoplastyczne (ich deformacja w podwyższonej temperaturze jest odwracalna, łatwo zapalne, struktura łańcuchowa, łatwo ulegają rozkładowi termicznemu, polietylen, polipropylen, poliamid, poliwęglany itd...)
termoutwardzalne (zmiana struktury w podwyższonej temperaturze-nieodwracalna, żywice poliestrowe, żywice epoksydowe itd...)
3.Włókna (bardzo duża wytrzymałość na rozciąganie, bardzo mała rozszerzalność).
III.W zależności od składu chemicznego tworzywa dzielimy na:
1.Ze względu na typ łańcucha:
Homoatomowe (zawierające tylko węgiel w łańcuchu głównym, najbardziej popularne: polietylen -(CH2-CH2)n- , polipropylen -(CH2(CH3)CH2)n- , opakowania, powłoki, izolacje kablowe, instalacje wodne itp...)
Heteroatomowe (zawierające różne atomy w łańcuchu głównym).
zawierające tlen w łańcuchu głównym (polimetakrylan etylu PMMA, poliestry, poliwęglany, małe zdolności dymotwórcze, niska temperatura rozkładu polimeru)
zawierające w łańcuchu głównym azot (nylony-(CO-NH)n-, polimetany-(NH-COO)n-, poliakrylonitryle,wełna,jedwab-naturalne poliamidy,obniżona palność polimerów,obniżenie termostabilności,toksyczność)
zawierający w łańcuchu głównym chlor (winidur -(CH2-CHCl)n-, obniżona odporność termiczna,obniżona palność polimerów,toksyczność)
zawierające w łańcuchu głównym fluor (teflon-politetrafluoroetylen PTFE -(CF2-CF2)- ,duża termostabilność,obiżenie palności).
Dieny (występuje podwójne wiązanie w monomerze, najbardziej popularne: polibutadien - gumy, kauczuki, poliizopren).
Zawierające potrójne wiązanie w monomerze (duża termostabilność).
50. Opisać dlaczego struktura tworzywa wpływa na ich własności palne.
Spalaniu ulegaja proste produkty rozkładu termicznego polimerów takie jak węglowodory alifatyczne,cykliczne,aromatyczne,CO itp...Aby tworzywo mogło ulec rozkładowi musi być dostarczona odpowiednia ilość energii,która wystarczy do rozerwania wiązań pomiedzy poszczególnymi atomami z których jest zbudowane (reakcja endotermiczna,nieodwracalna).Wyróżnia się jednak w budowie polimerów różne struktury związane z przestrzenną budową łańcucha głównego.Wyróżniamy więc polimery o:
budowie liniowej (brak rozgałęzień innego rodzaju jak grupy boczne monomerów)
budowie rozgałęzionej
budowie usieciowanej
Stuktura przestrzenna polimerów ma duży wpływ na ich własności palne.Związane jest to głównie z charakterem zmian jakie towarzyszą wzrostowi temperatury,oraz rozkładu polimeru na związki.Polimery o struktórze liniowej lub rozgałęzionej to głównie polimery termoplastyczne.Nie mają one grup funkcyjnych zdolnych do usieciowania i nie ulegaja utwardzeniu podczas ogrzewania.W czasie rozkładu tworzywa te w wyniku przemian fizycznych (topnienie,parowanie) oraz chemicznych (destrukcja,depolimeryzacja) wytwarzaja mieszankę gazową.Mechanizm spalanie tego typu tworzyw można porównać ze spalaniem cieczy.Faza lotna spala się po zapłonie lub samozapłonie płomieniowo (tak spala się np.polimetastyren).
Z kolei polimery termoutwardzalne to tworzywa w których pod wpływem podwyższonej temperatury nastepuje nieodwracalny proces powstawania struktury przestrzennie usieciowanej.Struktura ta może być kształtowana tylko jednokrotnie.Tworzywa te rozkładaja siępod wpływem ciepła z wytworzeniem związków niskoczasteczkowych o różnych stanach skupienia.W chwili samozapłonu lub zapłonu palna faza lotnazapala się płomieniem a pozostałość popirolityczna (koksowa) zaczyna się spalać bezpłomieniowo (czyli tlić) na granicy rozdziału fazy stałej i lotnej (w taki sposób spalają się np.poliestry termoutwardzalne).
51. Wyjaśnić które grupy tworzyw i włókien z nich otrzymanych są łatwopalne a które trudno zapalne.Od czego to zależy?
52. Jaką zależnością analityczna opisuje się szybkość spalania tworzyw.Wyjaśnić poszczególe człony tej zależności.
Szybkość spalania tworzyw opisana jest następującą zależnością:
m=(Qpł-Ql)/Qg
Qpł - ciepło docierające z płomienia do jednostki powierzchni spalania tworzywa w jednostce czasu(strumień ciepła kW/m2)
Ql - strumień ciepła tracony z płomienia(kW/m2)-do otoczenia.
Qg-ciepło gazyfikacji-ilość ciepła jaka jest niezbędna do ogrzania 1g substancji lotnej(kJ/g, kJ/Kg)
m-szybkość spalania(g/m2s)
53.Które tworzywa mają silne właściwości dymotwórcze i toksyczne - dlaczego. Przykłady .
Podczas rozkładu polimerów w warunkach pożarowych (wysoka temperatura) wytwarzają się prostsze związki na skutek degradacji i depolimeryzacji.Spalają się one z wydzieleniem mniejszych lub większych ilości dymu.
Silne właściwości dymotwórcze charakterystyczne są dla węglowodorów o dużym ciężarze cząsteczkowym.Obserwuje się ogólna zależność,że zdolności dymotwórcze wzrastają od n-alkanów przez izo-alkany,aleny,alkiny,związki aromatyczne do kondensatów aromatycznych.Materiały lub związki chemiczne posiadające w swoim składzie tlen wydzielają mniejsze ilości dymu niż węglowodory od których one pochodzą.
Przykłady:
dość niskie właściwości dymotwórcze ma polietylen i polipropylen (spalanie płomieniowe) - stosunkowo niski ciężar cząsteczkowy produktów rozkładu termicznego
dużą dymotwórczością charakteryzuje się PCW. W wyniku rozkładu następuje cyklizacja struktury PCW i powstaje pierścień podobny do aromatycznego z tym,że istnieja w nim tylko pojedyncze wiązania.Pod wpływem dalszego ogrzewania pierścień ten pęka,rozpadają się grupy CH i tworzy się sadza czyli węgiel
duża dymotwórczość jest również charakterystyczna dla poliuretanu
duża dymotwórczość - także żywice epoksydowe
CDN...
54. Jakie własności palne i cechy pożarowe ma PCW,PE i PMMA.
PCW - polichlorek winylu może być termoplastyczny tzn. podczas ogrzewania ulega stopieniu a następnie podczas chłodzenia staje się ciałem stałym (popularny materiał powłokowy i izolacyjny kabli,ma dodatek zmiękczaczy organicznych tak zwanych plastyfikatorów)(poliwinid).
Polichlorek twardy bez plastyfikatorów który nie ma własności termoplastycznych stosowany na osłony róznego typu domów antyhałasowe na autostradach (winidur).
Wszystkie winiloplasty są znacznie bardziej palne w porównaniu nieuplastycznionymi PCW (wynika to z tego,że środkiem plastycznym dodawanym do polichlorku winylu są łatwo zapalne estry organiczne).
Istnieje zasadnicza różnica w sposobie spalania się poliwinidu i winiduru.Podczas ogrzania poliwinidu następuje depolimeryzacja w wyniku czego odszczepia się chlorowiec - to podstawowa wada.W temperaturze 180stopni wydziela się 240l chlorowodoru w przeliczeniu na 1kg a natepnie ulega on zwęglaniu.
Aczkolwiek PCW jest tworzywem termoplastycznym instalacje z tego materiału ulegają również zwęglaniu i po odszczepieniu HCl nastepuje tak zwana cyklizacja PCW polegajaca na tym,że ze struktury liniowej,łańcuchowej tworzy się struktura cykliczna pierścieniowa.Struktura ta spalając się daje czarny gęsty dym.To w połączeniu z chlorowodorem tworzy najbardziej toksyczne i korozyjne środowisko pożarowe.
PCW ma bardzo wysokie temperatury zapłonu i samozapłonu,ponieważ w fazie lotnej tworzy się chlorowodór,który wpływa na zmniejszenie szybkości spalania poprzez mechanizm łańcuchowo-rodnikowy (HCl - inhibitor reakcji spalania).
Polietylen - jedno z najbardziej popularnych tworzyw.Ma mało węgla,daje płomień jasny (niebieski a później staje się bardzo żółty).Tworzące się gazy i dymy pachną woskiem i parafinami.Podczas ogrzewania pęka łańcuch i tworzą się różne związki typu parafiny,oleiny i związki cykliczne.Sa to tworzywa niebezpieczne pożarowo i wybuchowo (pyły).Wynika to z faktu,że szybko rozkładając się ulegaja zapłonowi i samozapłonowi w niskich temperaturach a ponadto w fazie lotnej po spaleniu dają CO2 i H2O oraz CO (w warunkach niedoboru powietrza).Podczas spalania płomieniowego charakteryzują się niską dymotwórczością.Kinetyka generacji ciepła HRR od 3000 - 4000kW/m2.
PMMA - szkło organiczne spala się dając niewielkie ciepło spalania natomiast ma bardzo niskie parametry temperatur inicjacji spalania.Jest to spowodowane tym,że w cząsteczce posiada tlen co ułatwia reakcje spalania.W warunkach pożarowych w ogóle nie daje pozostałości zwęglnej.daje czysty żółty płomień.Ponieważ podczas pożaru najpierw stapia się,mętnieje aby, polepszyc jego właściwości dodaje się do niego SF6,który powoduje,że w środowisku pożarowym kiedy szyba z PMMA ogrzeje się do temperatury 200 - 300stopni natychmiast z dużej płaszczyzny szklanej robi się kulka.HRR:2000kW/m2
55. Jakie własności palne ma anilana i elana. Podać różnice podstawowe w szybkości tworzenia się środowiska pożarowego.
Jeżeli azot jest przyłączony do węgla dając grupę CN- to w wynkiu polimeryzacji otrzymuje się tworzywa poliakrylonitrylowe. Anilana jest najbardziej niebezpiecznym tworzywem pod względem zagrożenia pożarowego. Ma bardzo małe ciepło spalania, w wyniku czego daje najniższą temperaturę pożaru, pachnie migdałami. W czasie spalanie wydziela się cyjanowodór. Ciepło spalania anilany 2900 kcal/kg, temperatura spalania 600˚C
56. Wyjaśnić różnice między sposobem spalania się tworzyw termoplastycznych i termoutwardzalnych.
W czasie rozkładu w wyniku przemian fizycznych (parowanie) oraz chemicznych (destrukcja) tworzywa termoplastyczne wytwarzają mieszaninę gazową. Powstała faza lotna może ulec samozapłonowi lub zapłonowi i w rezultacie spalać się płomieniowo. Mechanizm spalania tego rodzaju tworzyw można porównać ze spalaniem cieczy. Tworzywa termoplastyczne przy przejściach międzyfazowych w wyniku stałej szybkości parowania charakteryzują się stałą szybkością spalania. W taki sposób pali się polimetastyren. Większość tworzyw termoplastycznych rozkłada się w niższych temperaturach i zapala się szybciej w porównaniu z tworzywami termoutwardzalnymi, które podczas ogrzewania zwęglają się.
Tworzywo termoutwardzalne rozkłada się pod wpływem ciepła z wytworzeniem związków niskocząsteczkowych o różnych stanach skupienia. W chwili zapłonu lub samozapłonu palna faza lotna zapala się płomieniem, a pozostałość popirolityczna ( koksowa) zaczyna spalać się bezpłomieniowo (czyli tlić) na granicy fazy stałej i lotnej ( powietrze). Tworzywa termoutwardzalne ze względu na zmienną szybkość zwęglania charakteryzują się zmienną szybkością spalania. Szybkość spalania jest uzależniona od zdolności do rozkładu termicznego danego tworzywa. W taki sposób spalają się np. poliestry termoutwardzalne.
57.Załóżmy, że mamy w dwóch pomieszczeniach dwa różne tworzywa, w jednym PCW w drugim nie nasyconą żywicę poliestrowa. Opisać różnice w przebiegu pożaru i charakterystyce powstałego środowiska pożarowego.
PCW jest tworzywem plastycznym. Czysty PCW zawiera 56,7 % chloru jest materiałem trudno zapalnym. Dodatek modyfikatorów może zwiększyć podatność materiału do zapalenia. Mechanizm rozkładu PCW:
1.podgrzewanie polimeru (doprowadzenie ciepła ze źródła zewnętrznego do strefy spalania)
2.mięknięcie (70-90°C) dla polimeru nie modyfikowanego lub niżej dla polimeru modyfikowanego
3.piroliza (200-300˚C) odszczepienie HCl z utworzeniem wiązań podwójnie sprzężonych, tworzy się pozostałość zwęglona z fragmentami aromatycznymi powstałymi przez cyklizację. Gazy powstałe podczas pirolizy po zmieszaniu z powietrzem są zdolne do zapalenia od zewnętrznego bodźca energetycznego. Temperatura zapłony nie modyfikowanego PCW -450˚C, modyfikowanego PCW 390˚C, ciepło spalania 20000 kJ/kg.
Jeżeli w monomerze jest tlen to jest łatwiej zapalny, jeżeli jest azot to jest gorzej zapalny natomiast jest bardziej toksyczny.
Mechanizm spalanie PCW zawiera 3 elementy zmniejszania palności:
1.przerywanie łańcucha rodnikowego (działanie w fazie gazowej)
2.utrudnianie dostępu ciepła i tlenu do polimeru przez tworzenie się zwęgliny (działanie fazy stałej),
3.działanie fizyczne wydzielanego chlorowodoru, który rozcieńcza gazy palne i utrudnia dostęp tlenu.
Zagrożenia pożarowe jakie powoduje PCW:
-wydzielanie szkodliwych substancji,
-kontakt z metalami ciężkimi,
-wydzielanie przy spalaniu toksycznych produktów,
-korozyjność powstałych gazów,
-wydzielanie dużych ilości gęstego i żrącego dymu.
Nienasycona żywica poliestrowa ma większą odporność termiczną i chemiczną oraz elastyczność po utwardzeniu w porównaniu z nasyconymi żywicami poliestrowymi-więcej KURWA nie znaleźliśmy w pizdu!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
58. Spalanie bezpłomieniowe. Charakterystyka. Model Moussa. Obliczenie szybkości tlenia określonego materiału.
Środowisko pożarowe obejmuje spalanie płomieniowe. Natomiast tlenie jest często przyczyna inicjacji reakcji spalania płomieniowego i w konsekwencji pożaru. Tleniu ulegają: - wszystkie materiały, które zawierają tlen
- materiały porowate, zwęglające się ( styropian)
- wszystkie tworzywa termoutwardzalne, które dają podczas ogrzewania węgiel
W modelu Moussa zakłada się, że podczas ogrzewania materiałów tworzy się tzw. fala tląca, czyli fala spalania bezpłomieniowego, czyli pewna grubość materiału ogrzana do takiej temperatury, że świeci ( powyżej 450ºC) i która powoduje, że tlenie rozprzestrzenia się. Moussa rozróżnia w materiale palnym trzy strefy podczas tlenia:
-strefa pirolizy, podczas której następuje rozkład termiczny materiału, wydzielenie się substancji lotnych i w wyniku ich utleniania następuje wzrost temperatury w tej strefie.
-strefa zwęglania, w której temperatura osiąga maksimum, ustaje wydzielanie się produktów lotnych, co powoduje ,że węgiel zaczyna się powierzchniowo utleniać i w konsekwencji spalać bezpłomieniowo co objawia się świeceniem
- strefa porowatego węgla z przewagą popiołów.
W przypadku modelu Moussa ciepło maksymalne wydziela się w strefie drugiej, gdzie następuje powierzchniowe utlenianie i spalanie węgla, gdzie temperatura może osiągnąć 700ºC. Aby następowały takie zmiany w materiale ulegającym tleniu temperatura strefy pirolizy musi przewyższać temperaturę 250-300ºC, ponieważ te temperatury są to najniższe temperatury rozkładu termicznego materiałów ulegających tleniu.
v - szybkość rozprzestrzeniania się warstwy tlącej, można ją oszacować z następującej zależności: v=q/ς*h
q - strumień ciepła rozprzestrzeniający się wraz z falą tlącą [W/m2]
ς - gęstość [kg/m3]
h - entalpia, ilość ciepła wymagana do tego aby nastąpił wzrost temperatury w materiale tlącym od temperatury początkowej do temperatury tlenia
Oznaczmy przez To temperaturę początkową , Tsm temperaturę tlenia, wtedy h = c*( Tsm - T0)
c- ciepło właściwe przy stałym ciśnieniu
Jeżeli założyć, że ciepło jest przenoszone w materiale, który ulega tleniu przede wszystkim na drodze przewodnictwa to strumień ciepła przewodzony przez ten materiał określić można z uproszczonej postaci równania Fouriera q=λ*(Tsm-T0)/x , gdzie λ - współczynnik przewodnictwa cieplnego, x- odcinek materiału, w którym rozprzestrzenia się fala tląca
Po podstawieniu otrzymuje się następujące równanie: v = λ/ς* cp* x = α/x , gdzie α- dyfuzyjność cieplna [m2/s] , która oznacza następującą zależność α= λ/(ς*cp)
Z równania tego widać, że szybkość rozprzestrzeniania się tlenia jest wprost proporcjonalna do dyfuzyjności cieplnej materiału. Dla typowego materiału celulozowego α= 10-7 [m2/s] x jest zwykle szacowane w mm, co daje v=10-2-10-4, czyli od 20 do 40 cm na godz. Od czego zależy zmienna szybkość tlenia (20 czy 40 cm/godz.):od grubości materiału (grubość)2 temperatury strefy tlącej ( im wyższa tym szybkość większa) w kierunku rozwoju fali tlącej (w pionie daje największe szybkości tlenia bo poza efektami cieplnymi wynikającymi ze zdolności do utleniania się i spalania produktów rozkładu termicznego i węgla istotną rolę odgrywa czynnik konwekcyjny intensyfikujący szybkość ogrzewania się materiałów).
59.Sposoby spalania się układów rozproszonych ( pyłów).
Mechanizm spalania się pyłów organicznych i nieorganicznych.
Pyły, które są zawieszone w powietrzu w sposób trwały, tzn. ich średnica ziaren jest mniejsza niż 60μm dają trwałe chmury pyłów w powietrzu, stwarzają zagrożenie wybuchowe. Natomiast gdy średnica ziaren jest powyżej 100μm, w wyniku oddziaływania siły ciężkości tworzą warstwę pyłu, która stwarza zagrożenie pożarowe. Stan dynamiczny pyłu rzadko występuje w przemyśle ze względów BHP, ale stan dynamiczny, czyli zagrożenie wybuchem powstaje najczęściej kiedy mamy ciąg powietrza.
Aby ocenić własności pożarowe i wybuchowe pyłów należy je podzielić na dwie podstawowe grupy:
- pyły nieorganiczne, np. pyły metali, siarki, pyły węglowe nie ulegają rozkładowi termicznemu w warunkach pożarowych
- organiczne rozkładają się w warunkach pożarowych
Pyły pochodzenia nieorganicznego podczas ogrzewania wydzielają bardzo duże ilości ciepła. to ciepło jest przejmowane przez powietrze i spełnia ono podczas wybuchu taką samą rolę jak produkty rozkładu termicznego pyłów organicznych. Ze względu na dobre przewodnictwo cieplne pyły nieorganiczne wymagają silnych bodźców energetycznych do zainicjowania reakcji spalania.
Pyły organiczne-cechy charakterystyczne. Wybuchają i zapalają się dlatego że podczas rozkładu dają palną fazę lotną, w przypadku pyłów organicznych własności fizyczne typu λ nie odgrywają dużej roli ponieważ wszystkie te pyły źle przewodzą ciepło. Najważniejszą cechą z punktu widzenia stwarzanych zagrożeń pożarowych i wybuchowych jest wielkość tzw. współczynnika zmiany objętości. Jest to stosunek objętości fazy lotnej powstałej po rozkładzie po spaleniu w stosunku do objętości substancji wyjściowej. Im większy jest on tym wybuch jest większy. W przypadku pyłów organicznych o podatności do wybuchu decyduje zawartość wilgoci w pyle. Jeżeli pyl zawiera60% wilgoci staje się nie wybuchowy.
Pyły nieorganiczne nie mają temp. zapłonu, nie charakteryzuje się przez podanie temp. zapłonu ponieważ z definicji temp. zapłonu wynika, że zapłon pyłów dotyczy produktów rozkładu termicznego.
Mechanizm wybuchów pyłów
1 organicznych
np. pył dekstryny: C12H22O11+ 12 O2 + 45 N2 =12 CO2 +11 H2O + 45 N2
Vsubstr. < Vproduktów
Pomijając objętość ciała stałego, która jest bardzo mała w stosunku do objętości gazów można zauważyć, że podczas takiej przemiany objętość produktów jest o 10 obj. większa w stosunku do obj. substratów, a więc jeśli wzięlibyśmy 1 kg pyłu węglowodanu i spalili w objętości zamkniętej np. w 10l naczyniu, to w tedy ze względu na objętość produktów spalania nastąpi duży wzrost ciśnienia w naczyniu. Taki jest mechanizm wybuchu pyłów pochodzenia organicznego, tzn. współczynnik zmiany objętości substratów jest tak duży i reakcja jest tak egzotermiczna, że następuje wzrost ciśnienia.
2 nieorganicznych
- pył węglowy
węgle niskokaloryczne( zwykły węgiel)który zawiera maksymalnie 60% tzw. węgla pierwiastkowego resztę stanowią tlenki, kamień, piryt, siarka, produkty roślinne. Podczas ogrzewania masa węgla ulega rozkładowi dając palną fazę lotną. Najbardziej niebezpieczny jest pył węglowy, który daje 10-25% objętości fazy lotnej. Wtedy parametry wybuchów są najsilniejsze. Jeśli obj. produktów lotnych jest większa niż 25% nie wpływa to już na wzrost ciśnienia wybuchu.
Węgle wysokokaloryczne ( antracyt, grafit)- ponad90% węgla pierwiastkowego. Podczas ogrzewania albo nie rozkłada się w ogóle( grafit) albo też dają bardzo małą fazę lotną która nie daje zjawiska wybuchu lecz spalanie płomieniowe.
Ponieważ podczas spalania pyłu węglowego nie obserwuje się zmiany współczynnika zmiany objętości
C+ O2+ 3,76 N2 = CO2 + 3,76 N2
w związku z tym wybuch pyłu węglowego nie należy do wybuchów bardzo silnych.
Najniebezpieczniejsze w kopalniach są mieszaniny hybrydowe- mieszaniny metanu z pyłem węglowym.
-siarka
S +O2 +3,76 N2 = SO2+ 3,76 N2
współczynnik zmiany objętości =1
Siarka wybucha tylko w postaci dużego rozdrobnienia. Przechodzi pod wpływem ogrzewania przez wszystkie stany skupienia. Przemiany te są endotermiczne, co znaczy że stan cieplny nie powoduje szybkiego wzrostu ciśnienia i dużej szybkości narastania ciśnienia.
60.Od czego zależy wybuchowość pyłów węglowych. Hybrydy.
W przypadku pyłów nieorganicznych węglowych o zagrożeniu pożarowym decydują trzy czynniki:
-zawartość węgla pierwiastkowego w węglu kamiennym (w węglach nisko energetycznych zawartość węgla wynosi maksymalnie 60% reszta to są domieszki typu kamień, tlenki żelazowe, torf, siarczki-piryt)
-zapalność i wybuchowość tego pyłu jest uzależniona od objętości tworzących się produktów lotnych w wyniku rozkładu termicznego im więcej węgla pierwiastkowego w węglu kamiennym tym mniejsze zagrożenie pożarowe i mniejsza zdolność do wybuchu
-obecność palnych par lub gazów w powietrzu, (w kopalniach pył węglowy jest często zawieszony w powietrzu w mieszaninie z metanem, tworząc bardzo niebezpieczny układ wybuchowy, takie mieszaniny nazywa się mieszaninami hybrydowymi i są najczęściej przyczyną wybuchów).
Palne składniki lotne mogą być obecne w mieszninie nie tylko jako składniki powietrza. W tym ostatnim przypadku mieszanina "pył palny+ powietrze + gaz palny" nazywa się mieszaninę hybrydową. Obecność nawet małej ilości gazu palnego w mieszninie (w stężeniach poniżej ich DGW) powodując intensyfikację wybuchu, w szczególności wzrasta szybkość narastania ciśnienia (dp/dt)max.
61. Współczynnik zmiany objętości- definiuje się go jako stosunek objętości gazów spalinowych tworzących się w warunkach wybuchu do objętości par cieczy przed reakcją spalania. Najbardziej groźny w skutkach jest ten wybuch, gdy objętość gazów spalinowych jest kilkakrotnie razy większa niż objętość substratów biorących udział w trakcie zapoczątkowania reakcji utleniania. W przypadku gazów i par współczynnik zmiany objętości zmienia się bardzo mało lub w ogóle, dlatego nie decyduje on o wybuchu par i gazów lecz bardzo wysokie ciepło spalania.
62. Podstawowe różnice między parametrami wybuchu mieszanin- Zasadaniczo mieszaniny gazowo-powietrzne dają dużo mniejsze energie niż mieszaniny par z powietrzem, czy też pyłów z powietrzem. Drugą różnicą jest szybkość utleniania miesznin; największe szybkości osiągają mieszniny gazowo-powietrzne, np.: wodór utlenia się z v=3,2m/s, metan z v=0,37 m/s. Gazy dają prędkość rozprzestrzeniania się czoła wybuchu rzędu 1,5-3 km/s, znacznie wyższe parametry dają ciecze i ciała stałe. (to jest wiadomość niepewna, proszę o skorygowanie jeżeli ktoś zna poprawną opcję)
65. Pojęcie cechy pożarowej - jakie cechy pożarowe materiałów wykorzystane są w przepisach budowlanych dotyczących palności materiałów.
Cecha pożarowa jest to własność palna materiału stałego wyznaczona w warunkach cieplnych symulująca pierwszą względnie drugą fazę pożaru.
Do cech pożarowych zaliczamy:
-kinetykę generacji ciepła (HRR) - jest to ilość ciepła, która wydziela się z jednostki powierzchni materiału w jednostce czasu [kW/m2]
Są materiały o HRR niskiej (wartość do 100-120 kW/m 2), średniej (do 300kW/m2) i wysokiej (pow. 300 kW/m2). Materiały celulozo pochodne mają z reguły wysoką HRR. Tworzywa sztuczne nie modyfikowane przeciwogniowo prawie wszystkie mają bardzo wysoką HRR.
-szybkość rozprzestrzeniania się płomienia - jest to zasięg rozprzestrzeniania się płomienia po powierzchni materiału stałego w czasie
-zapalność materiału - podatność do zapoczątkowania reakcji spalania oraz rozprzestrzeniania się płomienia po powierzchni materiału stałego.
-własności dymotwórcze (toksyczność) produktów rozkładu termicznego i spalania - jako cecha pożarowa jest określana w ten sposób, że wyznacza się współczynnik osłabienia kontrastu, a następnie klasyfikuje się materiał biorąc pod uwagę jego wielkość. Natomiast toksyczność wyznacz się tylko w odniesieniu do następujących gazów: CO2, CO, H2O, tlenku azotu i tlenku siarki.
-korozyjność produktów rozkładu - oznacza stężenie związków toksycznych powstałych w produktach rozkładu termicznego i spalania w jednostce objętości spalin.
67. Spalanie się materiałów wielowarstwowych (kabli). Jak struktura kabla wpływa na sposób jego spalania?
- Charakterystycznym przedstawiciele materiałów wielowarstwowych są kable , dlatego na przykładzie spalania kabli elektroenergetycznych przedstawiony zostanie problem spalania się materiałów wielowarstwowych.
Kabel - to wyrób wielowarstwowy , który składa się w 70% z palnej , na ogół organicznej , części oraz w 30% z części niepalnej.
Część niepalna kabla stanowi rdzeń kabla oraz niektóre włókniny niepalne stosowane w kablach optycznych. Część organiczną kabla stanowi powłoka (zew. część kabla ) ; izolacja oraz warstwy pośrednie np. papier lub czysta celuloza lub też innego typu włóknina. Ilość warstw zależy od przeznaczenia kabla ; kable siłowe mają najbardziej zróżnicowaną budowę. Pod względem struktury kable dzieli się na kable węglowe i silikonowe. Kable węglowe są to takie kable , których materiały izolacyjne oparte są na związkach węgla (węglowodory). Kable silikonowe są to takie kable , których struktura zw. organicznych oparta jest na krzemie.
Spalanie się materiałów wielowarstwowych zależy przede wszystkim od rodzaju użytego tworzywa , oraz od grubości poszczególnych warstw i ich wzajemnego ułożenia. Rodzaj materiału użytego do budowy wierzchniej warstwy materiałów wielowarstwowych ma największy wpływ na ich spalanie , gdyż to od jego parametrów pożarowych zależy zachowanie się materiału w podwyższonej temperaturze. W przypadku kabli zależy głównie na ich bezpieczeństwie pożarowym , dlatego wierzchnie warstwy wykonywane są z tworzyw o podwyższonej odporności cieplnej.
- Na spalanie kabla największy wpływ ma materiał z jakiego została wykonana jego powłoka zewnętrzna.
W Polsce najczęściej stosowane są kable w wykończeniu tradycyjnym tzn. powłoka czyli zewnętrzna warstwa kabla wykonana jest ze zwyczajnego PCV (słowo zwyczajny określa , że PCV nie jest modyfikowany przeciwogniowo ).
Poza tym jako powłoki stosuje się również modyfikowany czyli uognioodporniony PCV , aby zmniejszyć własności palne powłok izolacyjnych. Podczas produkcji dodaje się do PCV substancje zmniejszające palność tzw. antypireny , są to Sb2O3 (trójtlenek antymonu) , Al2O3 (trójtlenek glinu).
Do wyznaczenia odporności ogniowej powłoki zewnętrznej stosuje się pomiar temp max ubytku masy , w której kable najczęściej ulegają samozapłonowi. Dobry kabel z dobrą powłoką musi podczas ogrzewania do temp 10000C max tracić masę 40% - 50%. Musi pozostać około 60% masy początkowej.
Dobry kabel z PCV musi mieć temp max ubytku masy ponad 4000C. Obok PCV stosuje się również kable o znacznie większej termostabilności tzn. mające powłoki z polietylenu usieciowanego. PE usieciowane mają temp max ubytku masy ponad 4000C , a max ubytek masy około 50%-60%.
69. Sposoby obliczeń objętości powietrza , niezbędnej do spalania jednostki paliw.
Do całkowitego spalania tych samych ilości różnych substancji palnych potrzebna jest niejednakowa ilość powietrza.
Do całkowitego spalenia 1kg drewna potrzeba 4-5m3 powietrza. Do spalenia tej samej ilości węgla kamiennego zużywa się 8-9m3 powietrza. Podczas pożarów , gdzie spalanie przebiega z dużym nadmiarem powietrza w. wym. ilości wzrastają nawet dwukrotnie.
Obliczenia ilości powietrza , koniecznego do spalenia różnych substancji , można przeprowadzić różnymi sposobami w zależności od składu i stanu skupienia substancji palnej.
Substancja palna jest związkiem chemicznym.
Jeżeli substancja palna jest związkiem chemicznym , najprościej obliczyć ilość powietrza konieczną do spalenia na podstawie reakcji chemicznej.
sposób postępowania:
Napisać równanie reakcji i dobrać współczynniki.
Z równania określić ile moli O2 przypada na jeden mol spalanego związku.
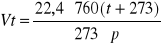
Obliczyć jaką objętość zajmuje jeden mol gazu w określonych w zadaniu warunkach ciśnienia i temperatury, ze wzoru:
Na podstawie obliczeń z powyższego wzoru określić jaką objętość zajmuje ilość tlenu wyznaczona z równania reakcji.
Obliczoną objętość tlenu odnieść do masy jednego mola substancji palnej , a wynik podać w m3 tlenu przypadających na kilogram spalanego związku.
Substancja palna jest mieszaniną różnych związków chemicznych.
Takimi substancjami są : drewno , torf , węgiel kamienny , ropa naftowa i inne. W celu określenia ilości powietrza koniecznego do spalenia określonych ilości tych substancji , należy ustalić skład tych substancji , tzn. wymienić jakie pierwiastki i w jakich ilościach znajdują się w wyżej wymienionych związkach , a więc trzeba znać procent wagowy poszczególnych pierwiastków wchodzących w skład danego związku. Najczęściej substancje te składają się z następujących pierwiastków: C , H , O , S i N.
Objętość powietrza potrzebnego do spalenia 1kg substancji oblicza się ze wzoru:
![]()
gdzie,
C,H,S,O - ilość węgla ,wodoru, siarki, tlenu - wyrażone w % wagowych.
Substancja palna jest mieszaniną gazów.
Do grupy tych związków zalicza się : techniczne gazy palne np. gaz świetlny , wodny, generatorowy itp. Wszystkie te gazy zawierają w różnych ilościach CO, CH4 ,H2S, C2H4
Skład gazów technicznych zwykle podaje się w procentach objętościowych.
![]()
Objętość powietrza potrzebnego do spalenia 1m3 mieszaniny gazowej oblicza się ze wzoru:
gdzie, CO, CH4 ,H2S, O2 - ilość tlenku węgla , metanu , siarkowodoru i tlenu w % objętościowych
Określona w wyżej podany sposób ilość powietrza , konieczna do spalenia określonej substancji palnej nazywa się ilością teoretyczną.
Praktycznie ilość powietrza zużywanego podczas spalania (podczas pożarów) jest znacznie większa . Różnica pomiędzy ilością powietrza zużywaną rzeczywiście podczas spalania a teoretycznie wyliczoną ilością , nazywa się nadmiarem powietrza.
Stosunek ilości powietrza biorącego udział rzeczywiście w spalaniu do ilości teoretycznej wyliczonej , nazywa się współczynnikiem nadmiaru powietrza i oznacza α.
Współczynnik nadmiaru powietrza oblicza się ze wzoru:
![]()
gdzie
Vprakt.- objętość powietrza w m3 , praktycznie zużywana podczas spalania
V teoret. - objętość powietrza w m3 , teoretycznie potrzebna do spalania.
![]()
Nadmiar powietrza :
70. Sposoby obliczeń objętości produktów spalania.
Produktami spalania nazywamy produkty powstające w wyniku spalania.
Produkty spalania charakteryzują reakcję spalania , umożliwiając wyliczenie różnych parametrów charakterystycznych dla tej reakcji . Rozróżnia się wilgotne i suche produkty spalania. Wilgotnymi produktami spalania nazywamy całkowitą objętość tworzących się w procesie spalania produktów łącznie z parą wodną. Jeśli w objętości powstałych produktów spalania nie uwzględnia się objętości powstałej pary wodnej , produkty te nazywa się suchymi produktami spalania. Skład produktów spalania wyraża się bądź w % objętościowych , lub w m3 liczonych na 1kg substancji palnej. Skład i ilość powstałych produktów spalania oblicza się w różny sposób w zależności od składu substancji palnej.
Substancja palna jest związkiem chemicznym.
Jeśli substancja palna jest związkiem chemicznym , obliczenie ilości i składu powstałych produktów spalania oblicza się na podstawie reakcji spalania.
Sposób postępowania:
Piszemy równanie reakcji spalania i dobieramy współczynniki.
Na podstawie reakcji określamy ile i jakie otrzymaliśmy produkty spalania. Ilość poszczególnych produktów spalania wylicza się z proporcji , biorąc pod uwagę stechiometrię równania i zależność wynikającą z prawa Avogadro (1mol gazu w W.N. zajmuje 22,4dcm3)
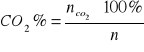
Wyniki podać :
-w %objętościowych wyliczając jaki procent sumy moli wszystkich produktów spalania stanowi liczba moli poszczególnych produktów wg. wzoru (np. CO2)
nCO2 - liczba moli CO2 wyznaczona z reakcji.
![]()
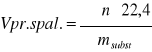
-w m3 na 1 kg związku palnego korzystając ze wzoru:
![]()
msubst- masa substancji palnej (w kg)
ilość moli w (kilomolach)
Substancja palna jest mieszaniną różnych związków chemicznych
Jeśli znany jest skład mieszaniny , to skład i ilość produktów spalania dla 1 kg substancji można określić na podstawie reakcji spalania poszczególnych pierwiastków wchodzącej w skład danej substancji złożonej.
Uwzględniając pierwiastki palne najczęściej i w największych ilościach występujące w palnych związkach chemicznych /C,H,S/. Podczas spalania węgla, wodoru i siarki potrzebny do spalania tlen zawarty jest w powietrzu. Substancja palna w swoim składzie może również zawierać tlen , który jest wykorzystany podczas spalania. W tym przypadku ilość powietrza konieczna do spalenia tej substancji będzie mniejsza i odpowiednio w produktach spalania będzie mniej azotu. W składzie substancji palnej mogą znajdować się azot i wilgoć które w procesie spalania przechodzą do produktów spalania.
Wykorzystując te dane i dane zawarte w tabeli 4 (mieszczącej się w skrypcie „Obliczenia chemiczne w zastosowaniu pożarniczym” na str. 24) można określić skład i ilość produktów spalania, jeśli znany jest skład pierwiastkowy substancji palnej.
Substancja palna jest mieszaniną gazów.
Dla mieszaniny gazów , ilość i skład produktów spalania określa się na podstawie reakcji spalania składników wchodzących w skład danej mieszaniny. W skład większości gazów technicznych wchodzą : metan , wodór , tlenek węgla , etan , i inne. Z równania reakcji łatwo obliczyć jaka objętość gazów spalinowych powstanie z 1m3 palnego gazu.
Wykorzystując dane zawarte w tabeli 6 (mieszczącej się w skrypcie „Obliczenia chemiczne w zastosowaniu pożarniczym” na str. 27) , można określić zarówno skład i ilość produktów spalania.
72. Czy metody badania eksperymentalnych temperatur samozapłonu cieczy , stosowane w Polsce są metodami , które w sposób obiektywny umożliwiają ocenę tej wielkości?
W Polskich przepisach termin temperatura zapalenia używany jest zamiennie z określeniami: temperatura samozapalenia , samozapłonu i zapłonienia.
W Polsce stosuje się dwie metody wyznaczania temperatury zapalenia są nimi:
1 Metoda dynamiczna pomiaru temperatury zapalenia cieczy pod ciśnieniem atmosferycznym (wg PN/C-04006).
2 Pomiar temperatury zapalenia cieczy metodą piecową.
Pierwsza z wymienionych metod polega na ogrzewaniu naczynia do określonej temperatury ,a następnie na wkropleniu do niego badanej cieczy. Naczynko pomiarowe zaopatrzone jest w pokrywkę ,w której znajduje się dysza , przez którą wprowadzane jest powietrze z określonym przez PN wydatkiem. To obostrzenie dotyczące wydatku przepływającego powietrza stwarza określone warunki w jakich przeprowadzone zostaje badanie , a powtarzalność wyników możliwa jest tylko w obrębie danej metody. Dlatego trudno mówić o obiektywnym wyniku tej metody jeżeli z góry zostają założone warunki w jakich powinno odbyć się badanie.
Okazuje się że najdokładniejszą metodą badania temperatury zapalenia cieczy jest metoda równomiernego jej ogrzewania w tyglu pod normalnym ciśnieniem i bezpośredniej rejestracji temperatury zapalenia w chwili pojawienia się płomienia. Charakteryzuje się ona dużą prostotą i dokładnością pomiarów. Do metody tej na pewno należy pomiar temperatury zapalenia cieczy metodą piecową. Wyniki tego pomiaru mogą być jak najbardziej odpowiadające rzeczywistym ,gdyż odbywają się w warunkach najbardziej zbliżonych do rzeczywistych. Dlatego wyniki uzyskane tą metodą mogą być najbardziej obiektywne ze wszystkich otrzymanych innymi metodami stosowanymi w naszym kraju.
Jednakże PN zaleca do pomiaru temperatury zapalenia cieczy stosowanie pierwszej metody.
UWAGA!!!
Ze względu na brak odpowiedniego źródła informacji na ten temat , wyżej przeprowadzone rozważania mogą być nieprawdziwe. W opracowaniu tego pytania oparłem się na materiale zawartym w opisie ćwiczeń laboratoryjnych.
Materiały
niepalne
palne
łatwozapalne
trudnozapalne
niezapalne
![]()
![]()
![]()
![]()
![]()
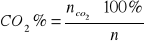
![]()
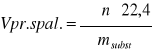
![]()
Wyszukiwarka
Podobne podstrony:
dzień- zaliczenie, SGSP, SGSP, cz.1, egzaminy
MELA2, SGSP, SGSP, cz.1, egzaminy
Zależności, SGSP, SGSP, cz.1, fizykochemia splania, Fizykochemia spalania
nie ważne jest ustalenie odbiorników I kategorii i dopuszcza, SGSP, SGSP, cz.1, elektroenergetyka, e
temperatury zapłonu tworzyw sztucznych2, SGSP, SGSP, cz.1, fizykochemia splania, Fizykochemia spalan
ściąga długopis, SGSP, SGSP, cz.1, fizykochemia splania, Fizykochemia spalania
DGW pyłów2, SGSP, SGSP, cz.1, fizykochemia splania, Fizykochemia spalania
zapalenie tworzyw sztuczzny, SGSP, SGSP, cz.1, fizykochemia splania, Fizykochemia spalania
dgw par cieczy aceton, SGSP, SGSP, cz.1, fizykochemia splania, Fizykochemia spalania
Urządzenia z osłoną olejową Exo, SGSP, SGSP, cz.1, elektroenergetyka, energetyka, elektra na egzamin
TEMP ściąga, SGSP, SGSP, cz.1, fizykochemia splania, Fizykochemia spalania
17.Elektryczność statyczna, SGSP, SGSP, cz.1, elektroenergetyka, energetyka, elektra na egzamin
13. urządzenia grzejne, SGSP, SGSP, cz.1, elektroenergetyka, energetyka, elektra na egzamin
DGW pylow 1, SGSP, SGSP, cz.1, fizykochemia splania, Fizykochemia spalania
palnosc wskaznik tlenowy, SGSP, SGSP, cz.1, fizykochemia splania, Fizykochemia spalania
Badanie dymotwórczości, SGSP, SGSP, cz.1, fizykochemia splania, Fizykochemia spalania
cieplo spalania w bombie, SGSP, SGSP, cz.1, fizykochemia splania, Fizykochemia spalania
WŁAŚCIWOŚCI dymowtwórcze, SGSP, SGSP, cz.1, fizykochemia splania, Fizykochemia spalania
Mela - egz. III, SGSP, SGSP, cz.1, fizykochemia splania, Fizykochemia spalania
więcej podobnych podstron