Technologia wody i ścieków jest nauką, która wykorzystuje wiedzę z zakresu chemii, biologii i fizyki do uzdatniania wody na cele pitne i przemysłowe. Dodatkowo zajmuje się procesami oczyszczania ścieków (odzyskiem wody „czystej”). Zagospodarowanie osadów ściekowych powstających w trakcie uzdatniania wody i oczyszczania ścieków w celu zmniejszenia ich szkodliwego działania na środowisko. Naszym zadaniem jest przetworzenie osadów ściekowych aby zmniejszyć ich ilość, wykorzystań ich zdolności nawozowe i energetyczne.
Woda w środowisku naturalnym nie występuje nigdy jako woda czysta, czyli połączenie wodoru i tlenu, jako bardzo dobry rozpuszczalnik zawiera w swoim składzie dobrze rozpuszczane sole, zasady i kwasy. Dodatkowo niesie ze sobą zanieczyszczenia biologiczne.
Technolodzy dzielą zawsze wodę na trzy podstawowe grupy: atmosferyczne, powierzchniowe: płynące i stojące, podziemne.
Wody opadowe - charakteryzują się różnym stopniem zanieczyszczenia w zależności od miejsca, w którym są zbierane. W najlepszym przypadku występuje w nich jedynie zanieczyszczenie tlenkami azotu pochodzącymi z wyładowań atmosferycznych, ale tak naprawdę wody te zanieczyszczone są przez przemysł. W wyniku czego zawierają tlenki siarki, amoniak, siarkowodór. Dodatkowo zmywając powierzchnię dachów i powierzchni jezdni i parkingów, zanieczyszczają się także substancjami organicznymi. Nad terenami rolniczymi mogą być także zanieczyszczenia pestycydami zmywanymi z powierzchni roślin lub nawozami zmywanymi z powierzchni gleby, na która spadną. Dawniej przyjmowano zasadę, że wody były odprowadzane do kanalizacji. Zaleca się, aby wody opadowe były zbierane. Mogą być np. stosowane w gosp. Domowych do spłukiwania muszli ustępowych lub gromadzone i nawadniane gleby lub zmywanie powierzchni parkowych.
Wody powierzchniowe - strumienie, rzeki, jeziora, wody zbiorników retencyjnych, morza, oceany. Zasilane są przez wody opadowe i podziemne. Ich skład jest bardzo zróżnicowany i uzależniony jest od klimatu, pór roku, zagospodarowania zlewni oraz od charakterystyki geologicznej terenu, na którym występują. Dodatkowo skład wód pow. Może być zmieniamy w wyniku procesów życiowych organizmów żywych. Pod względem technologicznym najmniejsza ilość zanieczyszczeń występuje w górnej części. Natomiast najbardziej zanieczyszczone są odcinki przepływające przez tereny zabudowane, tam gdzie występuje duży rozwój przemysłu. Wody pow. Wykorzystywane są jako uzupełniające źródło poboru wód w celu pobierania ich na cele pitne. Pod względem składu dominują w nich wodorowęglany wapnia i magnezu. W mniejszych ilościach występują siarczany i chlorki, występują również żelazo i mangan w formie utlenionej, może występować żelazo ze związkiem organicznym. Mogą również występować zanieczyszczenia organiczne nie tylko pochodzenia naturalnego, ale również pochodzenia antropogenicznego. Są to substancje niebezpieczne. Trzeba na nie zwrócić szczególną uwagę w procesie uzdatniania wody.
Wody podziemne - w zależności od głębokości zalegania, mogą posiadać związki, które przedostają się z wodami opadowymi, czyli mogą być to zaniecz. Org. Pochodzenia sztucznego, ale też produkty rozkładu substancji roślinnych i zwierzęcych pobieranych z warstw gleby przez które wody zasilające infiltrują. Wody podz. Zalegające płycej posiadają dla nas mniejszą wartość i są trudniejsze do uzdatniania niż wody głębinowe. Optymalnie byłoby gdybyśmy mogli wykorzystywać wody głębinowe, lecz jest nie niemożliwe. W przypadku uzdatniania wód głębinowych mamy do czynienia z następującymi zanieczyszczeniami: Wapń i magnez: wapń pochodzi z procesów wietrzenia chemicznego skał osadowych. Magnez ze skał krystalicznych i osadowych. Oba te pierwiastki występują często równocześnie. Różnią się zawartością w wodach głębinowych. Wapń-200mg/l; magnez nie przekracza 20mg/l. Oba te pierwiastki odpowiadają za występowanie twardości wapniowej i magnezowej, mają złe skutki na cele byt.-gospo. Sód - występuje w zróżnicowanych ilościach: 1mg/l - wody niskozmineralizowane; 100 000mg/l - w solankach. Obecność sodu nadaje wodzie charakterystyczną cechę zasadowości alkalicznej. Sód występuje najczęściej z wodami z wodorowęglanami i powoduje podwyższenie twardości węglanowej uzdatnionej wody. Żelazo i mangan - Żelazo występuje w tych wodach w odróżnieniu od wód powierzchniowych w postaci II i III wartościowych. Żelazo może pochodzić ze skał magmowych. Przechodzi do wód w procesach hydratacji i hydrolizy, a także poprzez oddziaływanie mikroorganizmów. Mangan - ze skał magmowych i osadowych. Występuje w niższych stężeniach niż żelazo. Wody zawierające żelazo i mangan charakt. Się: podwyższoną barwą i mętnością, pogorszeniem smaku.
Proces odżelaziania. AZOT AMONOWY - składnik, który jest niepożądany w wodach pobieranych do procesów uzdatniania, ponieważ może powodować przejście azotu w azotany. Jest czynnikiem, który przeszkadza w procesach odżelaziania i odmanganiania. Może powodować występowanie w instalacji obrostów w przypadku niedostatecznego usunięcia azotu. ANIONY: WODOROWĘGLANY I WĘGLANY, które powodują występowanie w wodach twardości węglanowej. Mogą też być źródłem dwutlenku węgla powstającego w trakcie ich rozkładu. SIARCZANY I CHLORKI - powodują powstanie twardości niewęglanowej nadające czasami właściwości korodujące. GAZY - dw. Węgla, siarkowodór - Dw. Węgla nadaje wodzie właściwości korodujące. Jest także czynnikiem odpowiedzialnym za uwalnianie do wody poszczególnych pierwiastków. Siarkowodór - może być pochodzenia organicznego lub mineralnego. Przy wysokich stężeniach nadaje wodom nieprzyjemny zapach i smak.
Wymagania stawiane wodzie na cele bytowo-gosp. Wody pobierane do uzdatniania muszą się charakteryzować określonym składem w zależności od dalszego ich przeznaczenia. Inne wymagania będziemy stawiać wodzie przeznaczanej na cele pitne i gosp. Parametry określane są w rozp. Pod względem zawartości poszczególnych zanieczyszczeń. Stężenie dopuszczalne poszczególnych zanieczysz. Zmieniają się w latach, tak samo jak zmienia się ilość zan. Wynikających z Rozp. Wynika to z coraz lepszej aparatury stosowanej do badań, która pozwala wykrywać i określać stężenia poszczególnych zan. A także pozwala na wykrycie większej ilości pojedynczych zan. Głównie organicznych.
Uzdatnianie wody na cele przemysłowe. Skład wody pobieranej a następnie wody uzdatnianej określają albo przepisy dot. Określonej gałęzi przemysłowej. Na cele ciepłownicze - parametry wody określają producenci kotłów.
Wody naturalne - powierzchniowe i głębinowe podzielone zostały na kilka klas w ramach których określa się parametry czy stężenia poszczególnych zan. Które nie mogą być przekroczone. Do roku 2004 obowiązywała nas skala 3-klasowa, od 2005-podział na 5 klas. 3 klasy: 1) wody, które mogły być przeznaczone na cele pitne i do hodowli ryb łososiowatych. 2) wody, które mogły być przeznaczone na cele pitne po procesie uzdatniania i mogły być stosowane do hodowli ryb oprócz łososiowatych. 3) wody, które można było wykorzystywać do celów przemysłowych wszędzie tam gdzie nie wymagana była woda pitna, do nawadniania terenu , upraw rolniczych i ogrodowych. W wyjątkowych sytuacjach mogła być uzdat. Ale jest to proces kosztowny. Wszystkie wody, które nie mieściły się w 1-3 klas, były wodami pozaklasowymi.
5 klas: 1) woda bardzo dobrej jakości, spełniająca wymagania dla wód na cele pitne, nie mogą nosić śladów oddziaływania antropogenicznego. 2) wody dobrej jakości, muszą odpowiadać w większości parametrom jakości wody na cele pitne w przypadku konieczności poddajemy je uzdat. Pełnemu. Wartości zan. Biologicznych mogą wykazywać niewielkie oddziaływanie czynnikami antropog. 3) wody zadowalające - spełniają one parametry wody przeznaczonej na cele pitne, lecz większość tych parametrów jest w wartościach granicznych i woda ta musi być poddawana pełnemu procesowi uzdatniania. 4) wody charakteryzowane jako niezadowalające, spełniają graniczne wartości parametrów jakości wody na cele pitne ale wskaźniki biologiczne tych wód przekraczają wartości dop. Wskazując na silne oddziaływanie czynników antrop. 5) wody złej jakości, nie spełniają one wymagań określonych dla wody pitnej. Wody gdzie wartości biologiczne wskazują na silne oddziaływanie czynników antrop., Wody także nie powinny być uzdatniane na cele pitne.
Dobór sposobu oczyszczania wód naturalnych
Przystępując do procesy uzdatniania wody wykonujemu : 1. Poznanie składu wody 2. Dobór procesów umożliwających udatnianie tej wody wykorzystujemy tylko te procesy, które odnoszą się do zanieczyszczeń występujących w wodzie. Wybierając ciąg technologiczny oczyszczania czy uzdatnianiem wody kierujemy się ekonomią, powstawaniem zanieczyszczeń wtórnych, powstawaniem produktów ubocznych - osadów. Osady chemiczne powstające przy uzdatnianiu czy oczyszczaniu są ponownie wykorzystywane np. osady Fe powstające przy płukaniu filtrów odżelaźniających wykorzystujemy w procesie oczyszcania ścieków. W trakcie pracy techn. mamy spowodować przygotowanie wody do sporzycia odzyskanie wody czystej ze ścieków a celu oddania ich do środowiska. Mamy do tego urzyć jak najmniej chemii a jak najefektywniej i najtaniej wykorzystać procesy Proces cedzenia stosowany jest na stacjach uzdatniania wód powierzchniowych. Nie ma on zastosowania na SUW głębinowych. W trakcie prowadzenia cedzenia zatrzymyane są zanieczyszczenia pływające po powierzchni cieczy zawieszone lub wleczone po dnie. Proces cedzenia znajduje też zastosowanie na terenie oczyszczania ścieków. Wyróżniamy tutaj 1-wsze cedzenie na początku oczyszczalni ścieków tu zatrzymujemyzanieczyszczenia które dopływają do oczyszczalni kanałami. 2-gi proces cedzenia w przypadku ścieków przemysłowych gdzie jego celem jest substratów dostających się do ścieków, a które można zawrócić do procesu technoligicznego. Proces cedzenia prowadzimy na 3 urządzeniach: Kraty - zespół prętów zespolonych ze sobą umieszczone są pionowo na ujęciu wody pow. Lub w korycie dopływowym w oczyszczalni ścieków prześwit krat wynosi 20-50 mm Na kratach zatrzymywane są gałęzie i puszki. Przepływ przez kraty 2-1 m/s. Sita - są urządzeniami zamkniętymi w budynku ich zaaniem jest zatrzymanie liści i małych rybek. Wielkość oszek 2-5 mm. Konstrukcyjnie sprowadzają się do siatki rązciągniętej na stelażu. Prędkość przepływu > 0.15 m/s Mikrosita - wykonane są jako urządzenie bębnowe na których rozciągnięte są odpowiednie tkaniny wykonane są najczęciej z metalowej mikrosiatki, oczka rzędu kilku mm. Prędkość przepływwu 0,03-0,003 m/s. Stosowane tylko na oczyszczalniach przemysłowych.Proces sedymentacji-polega na rozdzieleniu ciał stałych od cieczy pod wpływem siły ciężkości.Prędkość opadania uzależniona od wielkości i kształtu cząstek. Proces ten stosowany jest jako proces samoistny oraz jako proces uzupełniający wszędzie tam, gdzie w trakcie innych prosesów powstają osady. Proces ten może być prowadzony w urządz. Do pracy ciągłej od których zaliczamy osadniki i piaskowniki:*-w osadnikach - zatrzymywane są związki pochodzenia org.*-w piaskown - mineralnego. Oraz w urządzeniach o pracy cyklicznej - odstojniki - stos. Na SUW, napełnia się je wodą wykorzystywaną dp płukania filtrów, wodą odżelażniającą np. wodorotlenek żelaza (III) oddieli się od wody i poddaje się procesowiuzdatniania. Proces uzależniony od rodzaju zawiesiny: a)zawiesina ziarnista b) zawiesina włóknista.
W przypadku cząskek ziarnistych w trakcie sedymentacji cząst. Nie zmieniają swoich podst parametrów fizycznych - kształtu wielkości i gęsości. W trakcie sedymen cząst opadające zderzają się niędzy sobą, co pwoduje zakłócenie procesu. Im większe jest zagęszczenie cząst, tym większe występują sa zakłócenia w ich opadaniu. Jest to sedym. skupiona trudna do opisu matematycznego. Przy projektowaniu piaskowników i osadników opieramy się o sedym. swobonną - zakładamy że cząst kuliste opadają w nieograniczonej przestrzeni bez zakłóceń Innym problemem jest proces sedymenatcji o strukturze kłaczkowywatym. Zawisina kłaczków posiada tendencę do łączenia się w większe skupiska, co wpływa na zmianę prędkości opadania - zmieniają one swoją gesośćkształt i strukture. Powstałe agregaty są niestabilne - po pewnym czasie ponownie się rozpadają na mniejsze cząst. Opis matem tego prosesu jest b. trudny. Konieczne jesp przeprowadzenie badań laboratoryjnych. Proces flotacji - pewna odm. Sedym. separacja fazy stałej od ciekłej tu mamy subst. Stałe o mniejszej gęst od cieczy. Flotacja może zachodzić samoistnie lub w sposób sztuczny. Flotacja może zach w osadnikach lub w oddzielnych urządzeniach - odtłuszczaczach, piaskown. Napowietrzanych. Przy uzd. Wody możemy mówić o zawiesinach trudnoopadającej w procesach koagulacji. Po procesie osadu czynnego, gdy występuje proces jego pęcznienia wtedy wykazuje zdolność do flotowania. W sposób sztuczny możemy prowadzić f. ciśnieniową- wodę znajdującą się pod ciśnieniem nasycamu powietrzem i kierujemy do komory flotacji. W wuniku spadki ciśnienia w trakcie wpływania wody do komory powstają mikropęcheżyki powietrza które łączą się z zawiesiną wynosząc ją na powierzchnie. Też flotacja sprężonym powietrzem i tu pęcheżyki gazu uzyskiwane ze specjalnych urządz. Znajdujących się na dnie komory - dyfuzory drobnopęcheżykowe. Proces odżelaziania - charakt do SUW głębinowej. Fe w wodach głęb.może występować na 2 lub 3 stopniu utlenienia woda ta po pobraniu jest klarowana ale po kontakcie z tlenem obserwujemy mętnienie, powstały pierwotnie osad przyjmuje zabarwienie rdzawe. Proces odżelaziania uzależniony jest występowaniem w wodzie czynników przeszkadzających, czyli np. występowanie azotu amonowego, zan organicznych, charakt wartością pH utlenialności lub OWO Niezal. Od formy występowania Fe istaoą procesu jest przeprowadzenie Fe2+ do Fe3+ i usunięcie powstałego osadu. Najłatwiej usunąć Fe w połączeniu z kwaśnym węglanem i wtedy zachodzi reakcja: Przeprowadzamy proces natleniania i wtedy : Fe(HCO3)2 + 2H2O Fe(OH)2 + H2CO3, W trakcie napowietrzania Fe(OH)2 przechodzi w Fe(OH)3, który wytrąca się jako rdzawy osad. Jeśli dużo osadu - sedym. potem filtracja dezynfekcja. Jeśli mała ilość osadu - bez sedymentacji. Jeśli pH<7 to należy usunąć z wody CO2 Może to nastąpoić w trakcie napowietrzania - ody małe stężenia, a gdy duże stężenia konieczne wapmniowanie lub przepuszczanie wody przez złoże wiążące CO2. W przypadku połącz. Fe z siarczanem:
FeSO4 + 2H2O Fe(OH)2 + H2SO4
H2SO4 + Ca(OH)2 CaSO4 + 2H2O
H2SO4+ NaOH Na2SO4 + 2H2O
Układ technologiczny: *powietrzanie,*alkalizacja (dodawanie wapnia albo zasady sodowej), *edymentacji,* fitracja, *korekta pH, *dezynfekcja,* przesył do odbiorcy.
W przypadku występowania Fe w połączeniach ze związkami organicznymi uzdatnianie wody na drodze tradycyjnej nie daje pozytywnych efektów. Najszybciej można by taką wodę uzdatnić przez sprowadzenie jej do wartości pH=2. W takich warunkach jon wodorowy H+ jest konkurencyjny dla Fe2+ i wypiera go z połączenia z anionem organicznym. Proces przeprowadzony tą metodą jest kosztowny. Nie może być stosowany na szeroką skale.
Inną metodą jest zastosowanie silnych utleniaczy - stosowanie ozonu i dwutlenku chloru, posiada jednak wady. Woda oddawana jest w/w utleniaczu, wstępnie procesowi natleniania, sedymentacji, filtracji i dezynfekcji.
Ilość ozonu potrzebna do uwolnienia Fe jest 5-krotnie stężanie Fe, a w przypadku dwutlenku chloru nawet 10-krotne stężenie Fe.
W przypadku chlorowania powstają substancje rakotwórcze, a w przypadku stosowania utleniaczy do ciągu technologicznego włączana jest sorpcja na węglach aktywnych granulowanych na końcu układu technologicznego przed dezynfekcją, natomiast sorpcje stosujemy w celu zatrzymania niebezpiecznych substancji chloro-pochodnych.
W przypadku usuwania Fe w połączeniach ze związkami organicznymi dzisiaj najszersze zastosowanie znajduje metoda oparta o proces koagulacji z wykorzystaniem koagulanta glinowego lub wykorzystaniem wapnia.
W przypadku tego procesu glin neutralizuje ujemne naładowane połączenie żelaza ze związkiem organicznym co prowadzi do tworzenia obojętnych aglomeratów (cząst.) wytrącających się z roztworu. W przypadku stosowania procesu koagulacji ze związkami wapnia istnieje dodatkowa konieczność przywrócenia pH o wartości 7 w wodzie uzdatnionej. Do surowej wody dodajemy koagulant lub wapno, zachodzi proces koagulacji, w którym powstaje osad:
- jeżeli dużo osadu - proces sedymentacji,
- jeżeli mało osadu - proces filtracji, i na końcu proces dezynfekcji.
Rysunek - proces koagulacji
Rys.1
Proces odmanganiania
Istotą tego procesu jest przeprowadzenie Mn+2 w Mn+4. Utlenianie Mn do formy 4-watrtościowej jest procesem bardzo złożonym i w dużym stopniu uzależniony jest od pH reakcji. W środowisku obojętnym lub w środowisku kwaśnym reakcja ta prawie nie zachodzi. Przy pH charakterystycznym dla wody pitnej (ph=7) przeprowadzenie procesu jest utrudnione i wspomagane musi być odpowiednimi katalizatorami.
Aby przeprowadzić Mn+2 w Mn+4 na drodze procesów napowietrzania i filtracji trzeba doprowadzić pH wody do wartości 8,5. Po przeprowadzonym procesie potrzebna jest ponowna korekta uzdatnionej wody do wartości pH=7. Proces usuwania Mn można uzyskać dość prosto w wodach miękkich oraz w wodach o wysokiej alkaliczności. Zaś w wodach o pH=7 (obojętnych) można prowadzić odmanganianie z wykorzystaniem utleniaczy lub katalizatorów reakcji. Jako utleniacze stosujemy tu ozon i dwutlenek chloru i związki te mogą doprowadzić do usunięcia Mn nawet w wodach kwaśnych. Niestety proces ten jest procesem drogim z uwagi na ilość zużywanych odczynników i tak ozonu należy używać w stężeniu 5-krotnie większym od stężenia Mn w uzdatnianej wodzie. Zaś jeśli chodzi o dwutlenek chloru to jego dawka musi być 10-krotnie > od Mn w uzdatnionej wodzie. Dlatego na dzień dzisiejszy najszersze zastosowanie znalazła metoda filtracji wody przez złoże aktywne.
Złoże aktywne zawiera na swojej powierzchni dwutlenek manganu posiadający zdolność zatrzymywania Mn2+. Aktywne złoża możemy uzyskać w dwojaki sposób:
1)- samoistne prowadzenie złoża - w wyniku przepuszczenia przez normalny filtr, np. piaskowy wody zawierający np. Mn2+ dochodzi do wytworzenia na powierzchni ziaren warstwy aktywnej składającej się z MnO2. Pewną wadą tej metody jest fakt, że to wpracowanie złoża następuje dopiero po pewnym okresie oraz MnO2 ulega po pewnym czasie aktywacji przechodząc w trójtlenek Mn.
2)- Dlatego zaleca się stosowanie sztucznej aktywacji złoża, którą uzyskujemy przez przepuszczenie przez złoże roztworu nadmanganianu potasu. Jeśli przeprowadzimy równocześnie odżelazianie i odmanganianie to zalecane jest wykorzystanie dwóch złóż: pierwsze złoże jest złożem do usuwania Fe, a dopiero po usunięciu Fe przesyłamy wodę na złoże aktywowane. W przypadku zastosowania tylko złoża aktywowanego do uzdatniania wody zawierającej Fe i Mn w pierwszej kolejności na powierzchni aktywnej zatrzyma nam się Fe2+ powodując deaktywację złoża.
Dotatkowo w usuwaniu Mn przeszkadzają kwaśne węglany, siarczki, Fe2+ i jony amonowe.
Proces koagulacji
Jest powszechnie stosowany do uzdatnienia wód powierzchniowych, rzadziej do wód infiltracyjnych i podziemnych. W trakcie procesu koagulacji usuwane są z wody koloidy i zawiesiny trudno-opadające. Istotą tego procesu jest zmniejszenie stopnia dyspersji układu koloidalnego w wyniku łączenia się pojedynczych cząstek fazy rozproszone w większe aglomeraty, które następnie mogą być usuwane z wody w procesie sedymentacji lub flotacji. W tarkcie przebiegu procesu koagulacji usuwamy z wody barwę i mętność. Proces koagulacji uzyskujemy przez dodanie do uzdatnionej wody koagulantów. Najczęściej stosowanymi koagulantami są związki glinu i żelaza (tj. siarczan glinu, siarczan Fe2+, siarczan Fe3+ i chlorek Fe3+).
Proces koagulacji przebiega w 2 fazach:
1)-faza destabilizacji - występuje ona bezpośrednio po dodaniu koagulanta do uzdatnionej wody, w tym czasie następuj szereg reakcji fizycznych i chemicznych prowadzących do destabilizacji układów koloidalnych znajdujących się w uzdatnionej wodzie;
2) -faza flokulacji - trwa znacznie dłużej i w trakcie tej fazy dochodzi do zderzeń cząstek, które pozbawione ładunku łączą się w większe aglomeraty. Takie aglomeraty mogą być już usuwane z wody w procesie sedymentacji, flotacji lub filtracji.
FeSo4 => Fe2+ + SO42- (dysocjacja)
Fe2+ +H2O <=> Fe(OH)+ + H+ (I stopień hydrolizy)
Fe(OH)+ + H2O <=> Fe(OH)2 +H+ (II stopień hydrolizy)
czyli:
FeSO4 + 2H2O <=> Fe(OH)2 + SO42- + 2H+
Destabilizację układu koloidalnego powodują jony i produkty hydrolizy koagulanów, czyli powstające w wyniku hydrolizy wodorotlenki destabilizują układy koloidalne, łącząc się z cząsteczką koloidu przez co neutralizują jego ładunek, a przez zagęszczenie cząstek w roztworze dochodzi do częstych zderzeń prowadzących do tworzenia aglomeratów. Proces koagulacji możemy uzyskiwać na różnych drogach:
1* - przez dodawanie do uzdatnionej wody koloidu o znaku przeciwnym do znaku koloidu zawartego w uzdatnionej wodzie;
2* - dodawanie elektrolitu, który zmniejsza potencjał elektrokinetyczny; (1* i 2* - maja najczęstsze zastosowanie!);
3* - zastos. promieniowanie beta i gamma;
4* - ogrzewanie roztworu (lub wymrażanie);
5*- działanie mechaniczne na roztwór (np. przez wytrząsanie);
6* - dehydratyzację - przez dodawanie środków odwadniających.
Metody prowadzenia koagulacji:
(1) - Metoda objętościowa - zalecana jest dla wód zawierających dużą ilość zanieczyszczeń mających wpływ na barwę i mętność, szczególnie gdy te dwa składniki pochodzą w wyniku występowania Fe w połączeniach ze związkiem organicznym
Rysunek 2
1 - komora szybkiego mieszania, w której dochodzi do wymieszania wody z reagentami 2 - dozownik koagulanta 3 - dozownik czynnika korygującego pH 4 - dozownik węgla aktywnego pylistego
5 - dozownik obciążników 6 - komora wolnego mieszania 7 - osadnik 8 - filtr
W koagulacji objętościowej do całej objętości uzdatnianej wody dodajemy reagenty chemiczne, które w komorze szybkiego mieszania w trakcie kilku sekund mieszane są z uzdatnianą wodą i w tej komorze zachodzi 1˚ faza koagulacji. Następnie woda przepływa do komory wolnego mieszania, gdzie zachodzi faza wytworzenia struktury kłaczka. Następnie woda z wytworzonym osadem przepływa do osadnika, gdzie zachodzi proces sedymentacji. Po sedymentacji woda zawiera pewną ilość zawiesiny, która nie podlega ani procesowi sedymentacji ani flotacji - zatrzymujemy ją w procesie filtracji.
2. Koagulacja punktowa - jest zalecana dla wód o niskiej barwie i mętności RYS 3
Oznaczenia jak wyżej. Ilość zawiesin, która powstaje jest na tyle mała, że możemy tą wodę przesłać od razu na filtr. Można pominąć komorę mieszania szybkiego dodając odczynniki bezpośrednio do instalacji podającej na filtr. Efektywność procesu koagulacji uzależniona jest od optymalnej dawki koagulanta. Ta dawka uzależniona jest od wielu czynników, takie jak:*rodzaj i stopień zanieczyszczeń;*odczyn środowiska, w którym zachodzi reakcja;*czas i prędkość mieszania;*rodzaj zastosowanej substancji wspomagającej;*temperatura procesu. Wpływ poszczególnych czynników na przebieg koagulacji:
Dobór odpowiedniego koagulanta, który najefektywniej spowoduje usunięcie zanieczyszczenia
Sposób dawkowania - koagulanty możemy dawkować w postaci stałej lub roztworów - pozwala na dokładniejsze ustalenie dawki oraz zapewnia szybsze przereagowanie z uzdatnianą wodą
Dawkowanie koagulanta - ustalenie dawki optymalnej koagulanta dla procesu.
RYS 4.
1 - brak obniżenia mętności w trakcie dodawania dawki koagulanta (jest ona niewystarczająca, nie powoduje destabilizacji układu
Przy dalszym zwiększaniu dawek koagulanta widać wyraźny spadek wartości mętności uzdatnianej wody. Jest to faza, w której następuje destabilizacja układu. Na zakończenie drugiej fazy dochodzi do ustalenia optymalnej dawki koagulanta. Po przekroczeniu dawki optymalnej obserwujemy, że dalsze zwiększanie dawki koagulanta daje efektywność na tym samym poziomie. (3)
4- w fazie tej dochodzi do wtórnego zanieczyszczenia środowiska wodnego koagulantem, który jest wprowadzony do uzdatnianej wody. Występuje wtórne zmętnienie wody.
5 - mętność utrzymuje się na poziomie wartości wyjściowej
6 - w wyniku przesycenia układu ponownie zachodzi proces koagulacji - spowodowany zwielokrotnieniem dawki optymalnej
Temperatura - wzrost temperatury przyspiesza proces koagulacji np. przy zastosowaniu siarczanu glinu podwyższenie temperatury układu np. do 20˚C powoduje 3-krotnie przyspieszenie przebiegu reakcji.
Zastosowanie środków wspomagających - substancje: krzemionka lub węgiel pylisty, ich zadaniem jest przyspieszanie procesu, jeśli w roztworze występują zawiesiny, których cząsteczki są małe to przez zastosowanie tych środków w/w możemy doprowadzić do zwiększenia cząstek. Zastosowanie tych środków powoduje, że proces jest mniej wrażliwy na temperaturę oraz może prowadzić do zmniejszenia dawki koagulanta, przez co mamy tańszy proces i powstaje mniejsza ilość osadu.
Sposób mieszania zarówno reagentów z uzdatnianą wodą jak i mieszanie flokulacji (wolnego mieszania) - czas mieszania musi być na tyle szybki, aby doszło do wymieszania, a nie doszło do wytrącenia zawiesiny - w komorze szybkiego mieszania. Zaś w komorze wolnego mieszania sposób mieszania musi być tak dobrany, żeby cała zawiesina przeszła w formę włóknistą. W czasie mieszania nie rozbić strukturę powstających kłaczków.
pH - poszczególne koagulanty charakteryzują się swoja największą efektywnością przy określonym pH środowiska tj.:
- siarczan żelaza (III) - przy pH=7,8
- siarczan glinu - przy pH=7,0
PROCES FILTRACJI
Proces ten jest ostatnim zabiegiem stosowanym przy klarowaniu wody pozwalającym na usunięcie najdrobniejszej zawiesiny. Proces filtracji nie poprzedzony procesem koagulacji pozwala na usunięcie 80% zawiesiny. AZS w przypadku filtracji poprzedzonej koagulacją obserwujemy 90% i wyższe usuwanie zawiesiny. W procesie filtracji usuwamy zawiesiny o średnicy < niż 0,05 mm. Dodatkowo proces filtracji pozwala na usunięcie z wody substancji koloidalnych i bakterii. Po przejściu przez filtr oprócz zawiesiny usuwany jest tez smak i zapach wody.
Mechanizm filtracji - podczas filtracji woda przepływa w określonym kierunku i z odpowiednią prędkością przez złoże filtracyjne, które stanowi materiał porowaty. W zatrzymaniu zanieczyszczeń współdziałają ze sobą wiele zjawisk tj.:*cedzenie*sedymentację*flokulację*dyfuzję*adsorpcję* oddziaływanie elektrostatyczne decydujące o mechanizmie przyciągania
Najczęściej stosowanymi materiałami w technologii uzdatniania wody jest piasek kwarcowy i granulowany węgiel aktywny. Mogą tez być stosowane keramzyty, granity lub tworzywa sztuczne o gęstości < od gęstości wody. Materiały filtracyjne powinny się charakteryzować następującymi właściwościami:*odpowiednim uziarnieniem *odpowiednią gęstością *odpornością na działanie sił mechanicznych *odpowiednim składem chemicznym
Jakość filtracji zależy od następujących czynników:A)od rodzaju zanieczyszczeń znajdujących się w uzdatnianej wodzie B)liniowej prędkości przepływu wody C)wysokości złoża filtracyjnego D)rodzaju materiału filtracyjnego zastosowanego w złożu E) konstrukcji urządzeń filtracyjnych
Określenie rzeczywistej prędkości przepływu i długości drogi, jaka pokonuje cząsteczka w złożu jest bardzo utrudnione lub prawie niemożliwe. Dlatego w technologii przyjęto określać uproszczoną prędkość przepływu równą ilorazowi objętości przepływającej wody w czasie do całkowitego przekroju złoża filtracyjnego. Zaś długość drogi, jaka pokonuje cząsteczka przyjmuje się równą wysokości złoża. Obie te wartości SA krótsze niż wartości rzeczywiste.
Proces filtracji zachodzi w urządzeniach zwanych filtrami. Filtr to zbiornik wypełniony materiałem filtracyjnym wyposażonym w urządzenia doprowadzające wodę surową, odprowadzające wodę uzdatnioną oraz doprowadzające i odprowadzające wodę i powietrze służące do czyszczenia filtra. Proces filtracji odbywa się dzięki nadciśnieniu wytworzonemu nad złożem filtracyjnym przez słup wody lub przez pracę pomp podających wodę na filtr.
W trakcie pracy złoża filtracyjnego obserwujemy kolejność procesów tj.:
- mechaniczne zatrzymywanie zawiesin zachodzi w górnej części materiału filtracyjnego i jest to warstwa ok. 5 cm, która pozwala zatrzymać 90% zanieczyszczeń. Pozostałe 10% przechodzi w głąb złoża.
- właściwości adsorpcyjne i katalityczne związane są ze strukturą materiału filtracyjnego, czasami nabierane są po pewnym okresie pracy złoża.
Te procesy zachodzą w całej głębokości złoża. Przykładem są: pr odżelazienia i odmanganiania wody.-zjawiska chemiczne zachodzące w filtrze związane są z reakcjami wymiany pomiędzy składnikami uzd wody a składnikami złoża. Wykorzystujemy te reakcje w trakcie zmiękczania wody i odmineralizowania i odkwaszania wody. Procesy te zachodzą też w całej głębokości złoża. -procesy biochemiczne-odbywają się one na złożu filtracyjnym w obecności mikroorganizmów i bakterii. Uaktywnienie tych form następuje po pewnym okresie pracy filtra. Mikroorganizmy i bakterie przyczyniają się do usuwania z wody amoniaku, azotynów i azotanów oraz bakterii chorobotwórczych. Procesy te z działem form ożywionych zachodzą najintensywniej w górnej warstwie filtru.
Długość cyklu filtracji: C. filtracji- czas pracy złoża pomiędzy kolejnymi płukankami materiału. Zależy od uziarnienia złoża, ale też od prędkości filtracji i od poziomu zaniecz. zawartych w uzd wodzie. Przeciętna dł. c. fitr. przyjmujemy=24h, w rzeczywistości czas ten może być krótszy niż 8h. Koniec c. fil. to moment osiągnięcia dopuszczalnych strat ciśnienia lub pogorszenia się jakości filtra tu ponad wymaganą wartość. Po c. fil następuje płukanie mat. filtracyjnego. Może się ono odbywać w zależności od konstrukcji filtru albo wodą albo wodą ze sprężonym powietrzem. Po zakończeniu płukania ponownie zaczynamy c. fil. Jeśli stwierdzimy obecność w wodzie jeszcze zaniecz. organicznych pochodzenia naturalnego lub antropogenicznego to następnym zalecanym procesem jest sorpcja. Pr sorpcji stosuje się na stacjach uzd. wody w celu usuwania z wody np. pestycydów i fenoli, ale tez jest stosowany do usuwania zaniecz. powstających w pr uzd. wody. Mogą być to różne produkty pochodzące z ozonowania lub chlorowania wody. SORPCJA-wiązanie subst. zawartych w wodzie na powierzchni ciała stałego. Ciało stałe, które sorbuje subst. przyjęte nazywać sorbentem. Rozróżniamy w pr.sorbcji nast. sposoby zatrzymywania zaniecz: 1.zjawisko zatrz. powierzchniowego wyniku oddziaływania sił Van der Wasala między sorbentem a sorbatem -mówimy wtedy o sorpcji fizycznej. 2. zatrz zaniecz. w wyniku działania sił wiązania chemicznego pomiędzy sorbentem a sorbatem - mówimy wtedy o sorpcji chemicznej(chemisorbcji) 3. elektrostatyczne przyciąganie przez sorbent sus. rozpuszczonej w postaci jonowej-mówimy wówczas o sorpcji jonowej. Sorpcja może być procesem selektywnym, czyli 1 ze składników mieszaniny zaniecz. jest lepiej zatrzymywany od innych. Wynika to z powinowactwa tego zaniecz. do sorbentu i od jego rozpuszczalności w rozpuszczalniku. Klasyfikacja i rodzaje sorbentów stosowanych w uzd wodzie: Do sor. zalicza się ciała stałe porowate o różnym charak chemicznym i róż pochodzeniu. Najistotniejszymi właściwościami sorbentu są: powierzchnia właściwa oraz wielkość form występujących w materiale. Pow właściwa- pow. przypadająca na jednostkę masy sorbentu, czyli im większa pow. tym więcej zaniecz. może być zatrzymanych. Chociaż stwierdzenie to jest dużym uproszczeniem, ponieważ tak naprawdę ilość zaniecz. zatrzymywanych związana jest z przedostawaniem się tych zaniecz. w głąb porów mat. sorbcyjnego. Dlatego najważniejszą cechą charakt mat. sorbcyjny jest podanie wielkości por występujących w mat.Pory dzielimy na: makropowe, mezopory, mikropory. Makropory-śa to pory o prom. efektywnym >od 200nm i o pow. właściwej od 0,5 do 2m2/g, które otwierają drogę zaniecz. do wnikania do następnej grupy porów. Mezopora- jest to pora przejściowa o prom. efektywnym od 2 do 100nm i pow. właściwej od 10 do 40 m2/g. Makropory- pory o promieniu efektywnym< 2nm i ch wymiary są porównywalne z wielkościami cząsteczek. *Dodatkowo sorbenty klasyf można także wg strukturt elektronowej. Jednak w praktyce najszersze zastosowanie znalazł podział na sorbenty poch mineralnego i węglowego. Do sorbentów mineralnych zal. żele krzemionkowe, aktywne tlenki i wodorotlenki metali oraz występujące w przyrodzie mat. gliniaste. #Żel krzemionkowy jest to sorbent charakt. się dużą wytrzymałością chemiczną, mechaniczną i termiczną. W uzd. wody żel krzem. stosowany jest do usuwania metali z wody.# Tlenki i wodorotlenki metali -tl.glinu, Fe3+, jak i ich wodorotlenki stosowane są do uzd. wody jako wymieniacze jonowe i np. tl. glinu posiadają zdolność usuwania z wody fluoru, tl. żelaza posiadają zdolność usuwania z wody subs. organicznych.# Zeolit- mieszanina uwodnionych glinokrzemianów i krzemianów przeważnie Ca i Na, które posiadają zdolność zatrzymywania zaniecz. pionowych. Mogą one usuwać z wody jony powodujące twardość, ale dla największą wartość stanowią sorbenty, które mają zdolność usuwania zw. azotu(amonowego). Sorbenty węglowe (węg. aktywne) - produkowane są ona z mat naturalnych tj z drewna, torfu, pestek owoców, skorupek orzechów oraz węgla kamiennego. W proc. uzd. wody stosuje się węgle aktywne o pow. właściwej od 50 do 1500m2/g. Węgle aktywne stosujemy do usuwania z wody subst. powodujących nieprzyjemny smak i zapach, pestycydów i detergentów, węglowodorów alifatycznych i aromatycznych ale też niektórych metali ciężkich i wirusów. Obecnie też na sta. uzd. wody stosuje się złoża węgla aktywnego do odchlorowywania wody. Jeśli chodzi o formę wykorzystania węgla aktywnego w uzd.wody możemy go stosować w formie pylistej,granulowanej. Wyboru formy węgla dokonuje się biorąc pod uwagę nast. czynniki:
-cel jaki węgiel ma spełniać w proc uzd wody,-możliwości tech i ekon, rodzaje urządzeń jakie wchodzą w skład stacji uzd. wody, -wydajność instalacji. Jeśli chodzi o węgiel pylistyPWA jest on stos w celu polepszenia właściwości organoleptycznych uzd. wody czyli usuwa się tu subs. organiczne odpowiadające za smak i zapach wody.PWA jest stosowany najczęściej w pr koagulacji czyli dawkowany jest do komory szybkiego mieszania. Naj zaleta tego węgla jest możliwośc jego zast. w nagłych sytuacjach awaryjnych np. jeśli woda zostanie skażona subst. ropopochodnymi wtedy do istniejącego układu wprowadzamy PWA. #Granulowany węgiel aktywny jest on coraz częściej stosowany na st uzd. wody i chroni on odbiorców przed efektami pogorszenia jakości pobieranej wody. Dodatkowo zaletą GWA -ulega on dodatkowo biologicznej aktywacji czyli na węglu aktywnym namnażają się bakterie, które posiadają zdolności usuwania zaniecz. i te szczególnie z grupy zaniecz. toksycznych i kancerogennych. Biolog. aktywność złoża następuje w złożu po 2-3 mies jego pracy. Rozwijające się bakterie są odporne na działanie Cl, który może przedostawać się do złoża. Porównując stosowanie PWA i GWA na st. uzd. wody jako zalety przy PWA możemy uznać: łatwość stosowania i stosowanie do istniejącej inst. na st. uzd. wody. Jako wada brak możliwości regeneracji. GWA zalety:duża skuteczność, możliwość stosowania w układzie w zależności od założonego zaniecz. do usuwania ( po pr filtracji lub nawet w procesie jako jedna z warstw ) lub na końcu ciągu tech. Poddaje się regeneracji Wady- musimy budować wydzielone urządzenia do węgla . Wspólna wada wysoki koszt utrzymania!
Dezynfekcja wody
Zarówno wody powierz. jaki i zaleg. wody podziemne mogą być skażone biolo. W większości przypadków zawierają bakterie i wirusy, pasożyty i wyższe organizmy chorobotwórcze oraz formy przetrwalnikowe. Wody przeznaczone na cele pitne muszą być poddawane procesowi dezynfekcji. Dezynfekcja jest procesem którego zadaniem niszczenie form ożywionych i ich przetrwalników oraz zabezpieczenie dobre jakości wody w inst. Proces ten jest zawsze ost. procesem układu ciągu tech. pr uzd, wody.
Dezynfekcję możemy prowadzić na drodze metod fizycznych i chemicznych. Zadaniem stosowanych metod jest nieodwracalna destrukcja komórek, zakłócanie procesów metabolicznych oraz zakłócanie biocenozy i wzrostu.
Do fizycznych metod dezynfekcji wody zaliczamy gotowanie i pasteryzację, zastosowanie ultradźwięku i promieniowania ultrafioletowego. 1). Gotowanie wody i pasteryzacja- proces polegający na doprowadzeniu wody w przypadku gotowania do temperatury 100oC i wyżej, a w przypadku pasteryzacji kilkakrotnie doprowadzenie wody do temperatury 60-100 oC. Skuteczność tych procesów uzależniona jest od formy występowania patogenu, ponieważ różne organizmy niszczone są w różnych temperaturach i w różnym czasie, np. bakterie duru brzusznego możemy zniszczyć w temperaturze 75 oC po 10 minutach, zarodniki wąglika lub tężca giną po okresie 2 godzin w temperaturze 100 oC. Gotowania i pasteryzacji nie stosuje się na stacjach uzdatniania wody. Są one jedynie stosowane do przygotowania wody w niektórych gałęziach przemysłu i w sytuacjach awaryjnych. Proces gotowania i pasteryzacji powoduje zmianę właściwości fizykochemicznych uzdatnianej wodytermiczna dekarbonizacja i termiczny rozkład związków organicznych, co może powodować nieprzyjemny zapach w uzdatnionej wodzie. 2) stosowanie ultradźwięków- źródłem ultradźwięków jest działanie piezoelektryczne płytek kwarcowych poddanych działaniu prądu zmiennego. Mikroorganizmy niszczone są mechanicznie w wyniku oddziaływania fal. Odpowiednio dobrane fale powodują rozrywanie komórek. Dodatkowo może zajść też zjawisko chemiczne polegające na depolemineralizacji białka. Dodatkową zaletą tej metody jest to że oprócz mikroorganizmów pod wpływem działania fal następuje też rozpad wielocząsteczkowych związków organicznych. Skuteczność dezynfekcji za pomocą ultradźwięków zależy od: natężenia dźwięku, częstotliwości, czasu działania, rodzaju i liczebności niszczących mikroorganizmów. 3) zastosowanie promieniowania ultrafioletowego- promieniowanie to skutecznie niszczy mikroorganizmy (dł fali 210-280 nm). Najskuteczniejsza długość fali to ok. 265 nm. Metoda ta nie powoduje zmian składu fizykochemicznego uzdatnionej wody. Powoduje ona zniszczenie struktury DNA w sposób uniemożliwiający jego odbudowę. Czynnik destrukcyjny działa tylko w momencie naświetlania wody. Źródłem promieniowania ultrafioletowego są kwarcowe lampy rtęciowe wysokociśnieniowe. W trakcie dezynfekcji wody lampa umieszczona jest albo nad zwierciadłem wody w modelach starszych lub w środku uzdatnionej wody. Woda poddana uzdatnianiu ta metodą musi być pozbawiona cząstek koloidalnych i zawiesin. Zanieczyszczenia te mogą powodować zatrzymywanie części promieniowania lub obrastanie powierzchni lamp osadem, co prowadzi do zmniejszenia efektywności lampy i zmusza do częstego czyszczenia układu. Dezynfekcja wody za pomocą naświetlania jest drogą metodą . Wodę taką przed przesłaniem do instalacji należy zabezpieczyć przed wtórnym zanieczyszczeniem. Odbywa się to na drodze chlorowania.
Metody chemiczne: 1) chlor i jego związki, 2) ozon, 3) brom, 4) jod, 5)nadmanganian potasu, 6) woda utleniona. Trzeba pamiętać ze w przypadku wyżej wymienionych utleniaczy charakteryzują się one zdolnością nie tylko niszczenia mikroorganizmów, ale także utlenianiem zawartych w wodzie domieszek lub zanieczyszczeń organicznych i nieorganicznych. Wprowadzony związek chemiczny do wody w pierwszej kolejności zużywany jest na utlenianie związków organicznych i mineralnych, a pozostała cześć na dezynfekcję wody. Dlatego o skuteczności i przebiegu dezynfekcji chemicznej decyduje nie tylko liczba i rodzaj organizmów ale także skład chemiczny uzdatnionej wody, pH procesu, temperatura i ilość i rodzaj substancji organicznych i nieorganicznych.
Chlorowanie wody. Jedna z najprostszych i najszybszych metod dezynfekcji wody. Chlor może być przeprowadzany do uzdatnionej wody jako chlor gazowy. Jego odpowiednia dawka jest zapewniana przez wytworzenie na terenie stacji wody chlorowej. Chlor w postaci podchlorynu sodu dostarczany na teren stacji w postaci roztworu i dozowany jest do uzdatnionej wody. W trakcie dozowania chloru do uzdatnionej wody musimy określić zapotrzebowanie chloru. Ilość chloru potrzebna na pokrycie wszystkich procesów zachodzących w uzdatnionej wodzie w trakcie zastosowania utleniacza. Określamy tą dawkę jako ilośc chloru wolnego w mg Cl/lm która po 30 min kontaktu wody z chlorem w temp. 20 oC da nam pozostałość chloru o wartości 0,1 mg Cl/l. Dawka chloru wprowadzana do uzdatnionej wody jest znacznie zawyżona. 0,1 mg Cl/l ma być zawarte w uzdatnionej wodzie w najdalszym punkcie sieci wodociągowej od miejsca zastosowania chloru. Należy pamiętać, że przedawkowanie chloru już do stężenia 0,5 mg Cl/l spowoduje wystąpienie w uzdatnionej wodzie zapachu nieprzyjemnego chloru. Jeżeli w uzdatnionej wodzie występuje azot amonowy, to musimy wykorzystać do jej dezynfekcji troszeczkę większe dawki chloru ponieważ chlor ten jest wykorzystywany do tworzenia chloroamin.
Sposób prowadzenia chlorowania. Chlorowanie wody może być stosowane albo do zbiornika, w którym przechowujemy wodę albo do instalacji, którą woda jest kierowana do odbiorcy (odcinek przewodu do którego wprowadza się chlor i jego związki, był na tyle długi, aby zapewnić całkowite przereagowanie chloru z wodą).
Chlorowanie stałe i okresowe. 1) chlorowanie stałe stosujemy w celach bakteriobójczych, 2) chlorowanie okresowe- stosujemy w przypadku wód, które nie wymagają chlorowania stałego- częściej dotyczy wód głębinowych i likwidacji lub niszczenia obrostów biologicznych oraz dezynfekcji wybranych odcinków sieci. Jeśli chodzi o podział chlorowania w zależności od dawki stosujemy: chlorowanie dawką normalną - dawka ma utlenić związki organiczne i zniszczyć mikroorganizmy, przechorowanie- stosowane nadmiernej dawki chloru albo je likwidujemy w obrębie, stosowane w procesie sorpcji na węglu aktywnym- woda niestabilna. Jeśli badania wody pobranej z sieci wskazują na możliwość wtórnego zanieczyszczenia wtedy nadmiar chloru pełni funkcję dezynfekcji instalacji. Jeśli mamy rozległa się ci nie mamy chloroamin, wtedy może dojść do konieczności wprowadzania chloru jak w punkcie 2.
Ozonowanie wody- ozon jest trójatomową cząsteczką tlenu, jest gazem o charakterystycznym zapachu i bardzo silnych właściwościach utleniających. Działanie utleniające ozonu jest prawie 15 krotnie większe niż działanie utleniania chloru. Niestety działanie utleniania posiada tylko sam ozon, a nie jego produkty rozpadu. Do rozpadu ozonu dochodzi bardzo szybko i już same zanieczyszczenie wody uzdatnionej (np. Fe2+) może inicjować rozpadanie się ozonu. Ozon jako utleniacz jest też w mniejszym stopniu zależny od pewnych czynników niż chlor np. od temperatury. Zaletą a z drugiej strony i wadą jest to iż pozostałości ozonu po procesie dezynfekcji nie muszą być usuwane w sposób sztuczny jak dla chloru. Rozpad ozonu do tlenu nie zabezpiecza nam wody w trakcie przesyłu jej do instalacji. Jeśli zastosujemy ozonowanie, to musimy zabezpieczyć tę wodę chlorowaniem. Chlor i ozon wykorzystują się wzajemnie , czyli jeśli w uzdatnionej wodzie będzie chlor to spowoduje on zwiększenie zapotrzebowania na ozon i odwrotnie. Przed zastosowaniem tych utleniaczy należy je najpierw usunąć. Przeznaczyć 5 minut czasu na samoistny rozkład ozonu zawartego w uzdatnionej wodzie między ozonowaniem i chlorowaniem. Dawka ozonu, która zapewnia nam pozostałość ozonu w ilości 0,2-0,3 mg oznonu/l po okresie 10 minut kontaktu ozonu z wodą. Ozon uzyskiwany jest na stacji uzdatniania wody. Urządzeniami wytwarzającymi ozon na terenie stacji są ozonatory. Na terenie stacji powietrze przepływa przez system filtrów oczyszczających, odwadniających powietrze, wpływa do ozonatora i dopiero z ozonatora w postaci gazowej przepływa do komory mieszania wody uzdatnionej z ozonem.
Z uwagi na występowanie w wodach surowych coraz więcej większej liczby zanieczyszczeń organicznych oraz przekształconych tych zanieczyszczeń w trakcie procesu uzdatniania wody substancji częściowo toksyczne oraz osadu trudne do zagospodarowania poszukuje się metod nie powodujących zmiany składu fiz-chem wody oraz powstawania opadów.
Do metod takich zaliczamy procesy:
-membranowe- na dzień dzisiejszy znalazły najszersze zastosowanie w odsalaniu wody i usuwaniu twardości wody Coraz częściej zwraca się na te metody w konieczności usuwania w konieczności usuwania zanieczyszczeń refrakcyjnych i pochodzenia biologicznej. Do największych zalet do tych metod należą:*małe zużycie energii w porównaniu do metod trakcyjnych *małe wymiary urządzeń *duża elastyczność w zakresie wydajność i efektywność instalacji
Czynnikiem decydującym o uzyskanym stopniu zatrzymania zanieczyszczeń jest rodzaj zastosowanego procesu- rodzaj zastosowanej membrany
Membrana- cienka przegroda pozwalające na selektywny transport masy. Membrana może być wykonana z organicznym lub nie organicznym, syntetyczne lub naturalnych materiałów. W celu wykorzystania pełnej zdolności usuwania zanieczyszczeń, woda uzdatniania na membranie, powinna być pozbawiona zanieczyszczeń mogących uszkodzić membranę.
W techn. Uzdatniania wody membraną pracują w zespołach, zwanych modułami. Wyróżniamy moduły
1 membranami płaskimi do których zaliczamy membrany płytkowo- ramowe, spiralne i poduszkowe.
2Moduły z membranami o przekroju kołowym:*rurowy *kapilarny *z włóknami pustymi
Metoda odwracalnej osmozy RYS 5. Jeśli na układ różniący różniącymi się stężeniami, a oddzielony od siebie membranami zadziałamy ciśnień p> ciśnień osmotycznego, to spowodujemy przepływ rozpuszczony z roztworu o większym stężeniu do roztworu o mniejszym stężeniu. W wyniku zmiany kierunku przepływu rozpuszczonego, dochodzi do zatrzymywania zanieczyszczeń zawartych w roztworze na powierzchnie membrany.RYS 6 Odwrócona osmoza (przechodzi tylko rozpuszczone inne zanieczyszczenia są zatrzymywania może dojść do przejścia pojedynczych jonów 1-wartościowych)
Proces nanofiltracji Zatrzymywane są z wody wszystkie składniki organiczne o masie molowej>200g/mol Membrany nanofiltracyjne charakteryzują się jonoselektywnością- stosunkowo łatwo przepuszczają jony 1-wartościowe, zaś trudniej lub prawie wcale lub wielowartościowe. Jeśli mamy, kationy np. wodór, sód, potas, wapń, magnez i miedź. Wodór, sód, potas(będą przechodziły przez błonę w 60%). Wapń, magnez, i miedz(będą albo na błonie zatrzymywanego, albo przejdą w niewielkim stopniu max 5%). W tym procesie dokonujemy usunięcia z wody twardości wody, powodujemy odsalanie wody zatrzymywania na membranie zanieczyszczeń organicznych. Membrany do nanofiltracji są membranami kompozytowymi i posiadają swój własny ładunek ujemny, który jest generowany obecnością grup karboksylowych i sulfonowych, dlatego membrany nanofiltracyjnej najlepiej sprawdzają się przy uzdatnianiu wody o wysokiej twardości i wysokich stężeniach siarczanów.RYS 7
Procesy ultrafiltracji i mikrofiltracji.
Oba procesy różnią się między sobą zastosowanym cieśn. 0,3-1 MPa, zaś w mikrofiltracji stosujemy ciśnienie 0,1-0,3 MPa. Membrany zastosowane w obu procesach różnią się między sobą wielkością porów. Mikrofiltracja stosujemy do oddzielenia od uzd. wody zawiesiny, zaś ultrafiltrację stosujemy do rozdzielenia substancji niskocząsteczkowych od makrocząsteczkowych. Dodatkowo mikrofiltracja nie zmienia składu fiz-chem wody i oprócz zawiesin dochodzi do zatrzymania z wody dodatkowo ukł. koloidalnych i bakterii. Mikrofiltracja może być stosowana w przypadku gdy woda musi być poddawana procesowi sterylizacji, a ultrafiltracja- może być stosowana w celu oddzielenia zanieczyszczeń oleistych z mieszaniny wodno olejowej. RYS 8 Zarówno ultarfilt. jak i mikrofil. może być prowadzona w sposób: -statyczny -roztwór oczyszczonej wody jest kierowany na membranę prostopadle, woda ta niesie ze sobą zanieczyszczenia o różnych rozmiarach, zaś przez membranę przenikają mniejsze zanieczyszcz. a większe gromadzą się na membranie i tworzą na jej powierzchni warstwę nieprzepuszczalną powodującą kolmatację membrany. W wyniku tego zjawiska dochodzi do spadku efektywności procesu oczyscz. wody RYS 9. Dlatego korzystniejszym sposobem prowadzenia procesu jest sposób dynamiczny, w którym oczyszcz. woda jest kierowana do membrany. W wyniku tak prowadzonego procesu dochodzi także do odkładania się warstwy zanieczyszcz. cieczy powoduje okresowe odrywanie się warstwy zanieczyszcz. W takim układzie dochodzi do wytworzenia równowagi pomiędzy procesem odkładania się zanieczyszcz. Zapenia nam to ciągłą pracę membrany.
Elektrodializa: RYS 10 Jeśli w naczyniu, w którym umieszczona jest zanieczyszcz. woda zamontujemy katodę i anodę i poddamy je działaniu stałego napięcia elektrycznego to nastąpi przepływ elektronów w odpowiednim kierunku czyli kationy do katody a aniony do anody. Jeżeli dodatkowo przestrzeń naczynia podzielimy membranami jonowymiennymi, to dojdzie do wydzielenia w naczyniu przestrzeni z których będziemy mogli pobrać solankę i wodę uzdatnioną.
Oprócz zatrzymywania poszczególnych jonów, membrany przepuszczają pozostałe zanieczyszcz. czyli w uzdatnionej wodzie nadal będą zawarte zawiesiny oraz zanieczyszcz. bakteryjne. Wody podawanego do tego procesu powinny być pozbawione zanieczyszcz. nie powodujących powstawania kamienia membranowego(np. zawiesina, żelaza i manganu- są bardzo czułe na działanie chloru dopuszczalna dawka 0,1mg/dm³). Jedlnie nie przeprowadzimy wstępnego uzdatnienia wody, to spowodujemy zablokowanie pow. membrany. Membrana taka może być poddana procesowi oczyszczania poprzez jej płukanie, co spowoduje wzrost kosztów procesu i może doprowadzić do powstania odpadów w postaci osadu, który jest niepożądany.
Korozyjność wody Zgodnie z obowiązującymi rozporządzeniami woda przeznaczona na cele pitne może się charakteryzować twardością do 500g węglanu wapnia na m3, pH w granicach 6; 5-8,5, ponadto woda taka zawiera zawsze tlen rozpuszczony oraz chlor wodny, czyli woda taka zawiera depolaryzatory istotne dla przebiegu procesu korozji. Wśród wód przeznaczonych na cele pitne mamy wody charakteryzujące się agresywnością kwasowęglową, lub wody nieagresywne posiadające zdolność wytrącania nadmiernych ilości węglanu wapnia. Wytrącające się osady mogą być nieraz także czynnikiem powodującym powstawanie korozji szczególnie podosadowej korozji wżerowej. Głównymi skutkami niestabilności wody są:
a) Niszczenie materiałów przewodu sieci wodociągowej i urządzeń
b) zwiększenie chropowatości rurociągów
c) zmniejszenie średnicy wewnętrznej rurociągu
d) wzrost stężenia rozpuszczonych metali w wodzie i mogą wystąpić metale toksyczne czyli metale ciężkie
Korozją nazywamy stopniowe niszczenie tworzywa metalowego i niektórych materiałów niemetalowych w wyniku chemicznego lub elektrochemicznego oddziaływania środowiska korozyjnego. W wyniku tego oddziaływania zmienia się stan i właściwości niszczonego tworzywa. Korozja rozpoczyna się zawsze na powierzchni materiału i podąża w jego wgłąb. Pojęcie korozji dotyczy przeważnie metali głównie nieszlachetnych oraz ich stopów, ale może także dotyczyć materiałów niemetalowych tj. beton czy materiały ceramiczne. W zależności od czynników powodujących korozje oraz od warunków i przebiegu korozji rozróżniamy korozję chemiczną i elektrochemiczną.
Korozja chemiczna - spowodowana jest działaniem gazów suchych lub nieelektrolitów nie posiadających zdolności przewodzenia prądu elektrycznego, przykładem takiej korozji jest działanie tlenu na metal w podwyższonej temperaturze.
Korozja elektrochemiczna - wywołana działaniem elektrolitu najczęściej roztworów wodnych i ten rodzaj korozji jest wynikiem tworzenia się dużej liczby ogniw elektrycznych na powierzchni metalu. Ogniwa te tworzą się pomiędzy różnymi chemicznie składnikami metalu lub też niejednorodnymi strukturami fazy metalicznej.
Poza tymi dwoma typami korozji wyróżniamy: korozję biologiczną - zachodzącą z udziałem różnych mikroorganizmów, ale najbardziej za przebieg korozji biologicznej obwiniane są bakterie żelazolubne i siarkolubne. Ze względu na rozmiar korozji i wygląd uszkodzeń przez nią spowodowanych rozróżniamy następujące korozje:
a) korozja ogólna - cechująca się uszkadzaniem równomiernym całej powierzchni będącej w kontakcie z czynnikiem agresywnym;
b) korozja miejscowa lub skupiona - charakteryzuje się ona tworzeniem wzorów nierównomiernie rozrzuconych po całej powierzchni materiału;
c) korozja punktowa (selektywna) - charakteryzująca się wgłębnymi uszkodzeniami o średnicy do 1mm;
d) korozja międzykrystaliczna - przebiegająca na styku ziaren lub kryształów materiału;
e) korozja trans krystaliczna - uszkodzenia biegną wewnątrz kryształów lub ziaren
Najważniejsze czynniki powodujące korozję:
- woda
- para wodna wraz z zawartymi zanieczyszczeniami
- roztwory kwasów i zasad
- tlen
- dwutlenek węgla agresywny
- prądy błądzące
Przebieg korozji w środowisku wodnym jest procesem złożonym i niejednokrotnie jest wywoływany przez kilka czynników od siebie zależnych. Powierzchnia materiału nigdy nie jest zupełnie jednolita i te różnice mogą być spowodowane niejednorodnością struktury, co powoduje powstanie procesu korozji.
Proces ochronny polega na zatrzymaniu przedostawania się żelaza do wody oraz tlenu i wodoru do obszaru katodowego. W środowisku wodnym warstwa ochronna może posiadać grubość ok. 4μm. Jeżeli chodzi o skład takiego osadu to jest on niejednorodny i ulega zmianom wraz z głębokością osadu i w warstwach głębszych najbardziej przylegających do materiału dominują formy najbardziej zredukowane. Skuteczność warstw ochronnych uzależniona jest od stopnia nierozpuszczalności powstających osadów od jednorodności oraz od przyczepności do materiału korodującego. Niestety czasami w obszarze anodowym ma miejsce ponowna redukcja żelaza trójwartościowego do dwuwartościowego co zwiększa rozpuszczalność osadu a dodatkowa obecność chlorków w wodzie zmniejsza ich stabilność. Może to powodować zmniejszenie przyczepności osadu do materiału co w efekcie daje początek korozji podosadowej.
Stabilizacja - woda wodociągowa: Woda stabilna jest to woda która nie rozpuszcza i nie wytrąca węglanu wapnia. Wymóg ten spełnia woda zachowująca równowagę węglanowo-wapniową. Stopień stabilności wody określamy na podstawie wskaźnika intensywności agresywności kwasowęglowej, który może być oznaczany w różny sposób. Natomiast wszystkie obliczenia charakteryzuje indeks stabilności wody oznaczany zawsze dla wody uzdatnionej. Ponieważ w trakcie procesów uzdatniania wody jego wartość może się zmieniać. Jeżeli woda oczyszczona jest niestabilna to do układu technologicznego uzdatniania wody należy wprowadzić procesy zapewniające korektę wartości pH wody, twardości węglanowej oraz zawartości jonów wapniowych. Jednocześnie należy pamiętać że szczególnie w nowej instalacji wodociągowej należy w pierwszym okresie jej funkcjonowania pozwolić na wytrącenie się ciężkiej warstwy osadu węglanu wapnia w celu wytworzenia warstwy ochronnej. Proces taki możemy uzyskać w przypadku wód nieznacznie przesyconych węglanem wapnia. Natomiast w późniejszym okresie korzystania z sieci wody posiadające tendencję do struktury stopu lub odkładaniem się na powierzchni materiałów osadów.
W efekcie tego na powierzchni materiału tworzą się różnice potencjałów prowadzące do wytworzenia ogniw i w takim ogniwie korodujący metal jest anodą. Powstający osad zawierający tlenki lub jakąś nierówność na powierzchni materiału jest katodą. Woda z którą kontaktuje się metal przejmuje funkcje elektrolitu. W obszarze anodowym w wyniku utleniania się materiału generowane są elektrony które zużywane są w obszarze katodowym. Wykorzystywane są one do redukcji tlenu lub wodoru. RYS. (1- anoda; 2-katoda)
W zależności od pH środowiska w którym przebiega korozja elektrony mogą posiadać różne akceptory:
- przy pH<4 akceptorem elektronów jest wodór
- przy pH>4 akceptorem elektronów jest tlen rozpuszczony.
W wyniku przebiegu reakcji zachodzących w środowisku wodnym jony niszczonego metalu przechodzą do wody a w miejscu uszkodzenia powstaje wżer (rys). Do wody przechodzi żelazo dwuwartościowe - w trakcie przejścia do wody podlega ona hydrolizie tworząc wodorotlenek żelaza dwuwartościowego, a w środowisku alkalicznym tworzą się tlenki lub wodorotlenki żelaza trójwartościowego.
W miarę nasycania się wody wodorotlenkiem żelaza, działanie ogniwa stopniowo słabnie, a w stanie nasycenia może dojść do jego całkowitej polaryzacji. Wytrącające się tlenki lub wodorotlenki żelaza w wodach o podwyższonej twardości także węglany żelaza pokrywają korodujący materiał cienką warstwą
Wytrącanie nadmiernej ilości osadu węglanu wapnia możemy uzdatniać na drodze strącenia kwasem solnym, rzadziej siarkowym co powoduje zastąpienie twardości węglanowej niewęglanową. Dojdzie także do obniżenia wartości pH. Oczywiście dawki kwasu muszą być tak dobrane aby wody uzdatnione spełniły warunek równowagi węglanowo-wapniowej. Inną metodą zapobiegania wytrącania osadów węglanu wapnia jest wprowadzenie sub. chemicznych nazywanych inhibitorami. Inhibitory hamują proces korozji stabilizują twardość wody dyspersują zawiesinę. W zależności od mechanizmu działania inhibitory dzielimy na: * katodowe*anodowe*mieszane. Do inhibitorów katodowych zaliczamy sole metali które tworzą trudno rozpuszczalne tlenki, wodorotlenki lub węglany. Są to sole cynku, niklu, manganu, chromy III, wapnia i magnezu. Tworzące się osady osadzają się na katodzie uniemożliwiając dostęp danej powierzchni tlenu lub wodoru. Działanie inhibitorów katodowych uważane jest za bezpieczne ponieważ jeżeli zastosujemy je nawet w ilości niewystarczającej to zawsze zahamują one proces korozji. Inhibitory anodowe związki o właściwościach utleniających do których zaliczamy fosforany, chromiany, które wytwarzają trudno rozpuszczalne warstwy osadu i dodatkowo dochodzi do adsorpcji na powierzchni metalu związków z grupy nitrobenzoesanów. W porozumieniu z inhibitorami katodowymi skuteczność działania tych inhibitorów jest ograniczona jeżeli ilość zastosowanych związków spowoduje pasywację powierzchni całego chronionego metalu.
Dawka zbyt mała nie zahamuje procesu korozji. Inhibitory mieszane są to inhibitory wieloskładnikowe które zawierają jednocześnie sole cynku obok polifosforanów i chromianów i działają na zasadzie przyspieszenia powstawania powłoki ochronnej na powierzchni metalu która wytwarza się w postaci tlenku cynku i dodatkowy efekt antykorozyjny powodowany jest przez obecność fosforanów oraz sub.organiczych poprawiających działanie inhibitorów które przygotowywane są w postaci gotowych mieszanek.
Skuteczność działania inhibitorów zależy od składu wody, warunków pracy instalacji, konstrukcji urządzeń oraz od doboru i dawki odpowiedniego inhibitora.
Przygotowanie wody na cele przemysłowe
W gospodarce wodnej kotłowni wyróżniamy następujące rodzaje wód:
a) w. Surowe-pobierane z sieci wodociągowej bezpośrednio z ujęcia i stanowią surowiec do dalszego uzdatniania na cele kotłowe. B) w. kotłowa- znajdująca się w kotle i podawana procesowi podgrzewania. W trakcie podgrzewania woda w kotle ulega zagęszczeniu i może dochodzić w niej wytrącania osadów z zawartych zanieczyszczeń. C) w. zasilająca- którą uzupełniamy braki w kotle jest mieszaniną kondensatu i w. uzdatnionej surowej. Kondensat jest to skroplina pary wodnej wyprodukowanej wcześniej w kotle. Woda przeznaczona do kotłów musi posiadać określone parametry, którą określają najczęściej producenci kotłów. Można ją scharakteryzować w ten sposób, że nie powinna zawierać czynników korodujących, sub. Dających osady a także sub. Powodujących ich pienienie.
Za wytrącanie osadów najbardziej odpowiedzialne są sole Ca i Mg. Powstający osad może tworzyć kamień kotłowy, który zmniejsza przewodność ciepła czyli pogarsza sprawność kotła a nawet może spowodować jego awarię lub całkowite uszkodzenie.
Powodem pienienia jest występowanie w wodach związków organicznych, dużego zasolenia lub nadmiernej jej alkaiczności. Pienienie wody zagraża zanieczyszczenie pary powstającej w kotle, może doprowadzić do odkładania się osadów na łopatkach turbin lub zanieczyszczenie pary mogą zakłócić jej obieg w urządzeniu. Dlatego woda przed wprowadzeniem do kotła powinna być pozbawiona zanieczyszczeń, czyli tlenu rozpuszczonego i CO2 na drodze odpędzenia lub związania chemicznego.
Usuwanie zanieczyszczeń organicznych odbywa się najczęściej na drodze sorpcji, koagulacji z solami Al, Fe lub na drodze filtracji na filtrach namywanych okrzemkowych.
Usuwania soli Ca i Mg na drodze zmiękczania całkowitego lub na drodze dekarbonizacji. Zmiękczanie całkowite jest to usuwanie soli Ca i Mg powodujących twardość węglanową i nie węglanową.
Metoda dekarbonizacji- usuwanie z wody tylko twardości węglanowej.
Dekarbonizacja termiczna
Polega na rozpadzie kwaśnego węglanu wapnia i Mg na trudno-rozpuszczalny węglan wapnia i magnezu. Reakcje zachodzące w trakcie procesu:
![]()
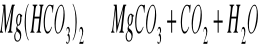
O ile obojętny węglan Ca jest osadem trudno-rozpuszczalnym i bardzo dobrze oddziela się od wody w postaci osadu, o tyle węglan Mg jeszcze dosyć dobrze jest rozpuszczany. Jego usunięcie z wody możemy uzyskać na drodze hydrolizy do wodorotleny Mg dopiero przy podwyższeniu pH środowiska do wartości około 11.
Proces dekarbonizacji termicznej uzależniony jest od zastosowania temperatury, oraz od czasu jej działania. Im wyższa temperatura tym dekarbonizacja szybciej zachodzi.
Dekarbonizacja chemiczna z wykorzystaniem wapnia
Jedna z najstarszych metod usuwania twardości. Polega na dodaniu do uzdatnionej wody wodorotlenku Ca w wyniku czego dochodzi do wytrącenia z wody obojętnych węglanów Ca i Mg. Węglan Mg hydrolizuje dalej do nierozpuszczalnego wodorotlenku Mg.
![]()
![]()
![]()
![]()
![]()
![]()
W trakcie dodawania Ca do uzdatnianej wody, jeżeli występują w niej oprócz węglanów siarczany, chlorki, CO2 lub związki żelaza to także dojdzie do ich związania co w efekcie w uzdatnionej wodzie spowoduje wzrost twardości Ca przy niewielkim obniżeniu twardości Mg. Jest to częściowo zjawisko niepożądane dodatkową wadą tej metody jest powstawanie dużej objętości osadów które dalej trzeba zagospodarować.
Dekarbonizacja wody kwasami
Metoda polega na dodawaniu do wody kwasu HCl lub H2SO4 Reakcje są następujące
![]()
![]()
![]()
![]()
W wyniku szczepienia wody kwasami dochodzi do zamiany węglanu Ca i Mg na siarczanek i chlorki które charakteryzują się większą rozpuszczalnością od węglanów i nie dają takiego zagrożenia powstawania osadów. Niestety metoda ta ma swoje ograniczenia ponieważ w uzdatnionej wodzie nie stwierdzamy obniżenia twardości ogólnej a wartość twardości węglanowej zmniejsza się na rzecz wzrostu twardości niewęglanowej. Dlatego metoda ta polecana jest jako metoda uzupełniająca wszędzie tam gdzie dekarbonizacja wapna nie daje zadowalających wyników a także polecana jest do przygotowania wody w obiegach chłodniczych w układach zamkniętych.
Metoda zmiękczania wody z wykorzystaniem zasady sodowej i węglanu sodu
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Metoda ta polecana jest do uzdatniania wody posiadającą niską twardość węglanową oraz wysoką twardość niewęglanową. W trakcie prowadzenia uzdatniania wody oprócz węglanu wapnia i wodorotlenku Mg pojawiają się węglany Na , które biorą udział w dalszych reakcjach dlatego prowadzenia zmiękczania tą metodą wymaga dobrej znajomości uzdatnionej wody w celu określenia optymalnej dawki reagenta. Wadą tej metody jest wysoki koszt zasady sodowej NaOH oraz możliwości wywołania w uzdatnionej wodzie zasadowości alkaicznej spowodowanej obecnością węglanu sodu, a objawiających się wzrostem twardości węglanowej ponad twardością ogólną. Możemy zmniejszyć koszty przez zastosowanie metody sodowo-wapniowej. W miejsce zasady sodowej wchodzi wodorotlenek wapnia.
![]()
![]()
![]()
![]()
![]()
Metoda łączy w sobie tanią dekarbonizację prowadzącą do usunięcia twardości węglanowej oraz usuwanie twardości niewęglanowej na drodze strącania węglanem sodu.
Usuwanie twardości na drodze dodawania do wody fosforanów
Charakteryzuje się ona największą skutecznością usuwania twardości. Reakcje przebiegają wg.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
W metodzie tej skutecznie usuwane jest zarówno twardość węglanowa i niewęglanowa. W wyniku przebiegających reakcji powstają fosforany Ca i Mg, które charakteryzują się bardzo małą rozpuszczalnością. Jedyną wadą tej metody jest wysoki koszt obojętnego fosforanu trój-sodowego, natomiast możemy zastosować w reakcji kwaśne fosforany czyli Na2HPO4 lub NaH2PO4. Ich skuteczność usuwania twardości jest nieznacznie mniejsza od fosforanu obojętnego. W celu zmniejszenia kosztów procesu zaleca się usuwanie wstępne twardości metodami tańszymi, a tylko zmiękczanie końcowe prowadzić metodą fosforanową. Najbardziej ekonomiczne zastosowanie tej metody mamy wtedy kiedy twardość ogólna uzdatnionej wody jest w granicach od 2 do 2,5 mval/l .
Metoda jonitowego zmiękczania i demineralizacji wody
Zmiękczanie jonitowe prowadzimy na wymiennikach jonowych. Wymienniki jonowe są substancją pochodzenia naturalnego lub sztucznego, są nierozpuszczalne w wodzie i posiadają zdolność wymiany jonów z roztworu na jony związane z organicznym rdzeniem wymieniacza zwanego jonitem. Wymienniki jonowe mogą posiadać charakter kwasów lub zasad. Jonity posiadające zdolność wymiany kationów nazywamy kationitami a posiadające zdolność wymiany anionów nazywamy anionitami. Jonity posiadające strukturę porowatą o silnie rozbudowanej powierzchni wewnętrznej. Jonity są hydrofobowe i charakteryzują się dużą elastycznością i rozciągliwością. Dzięki czemu jonity zanurzone w wodzie ulegają spęcznieniu.
Budowa chemiczna
Rdzeń wew. jonitu jest zawsze zbudowany z sub. Organicznej, na powierzchni tego rdzenia przyłączone są jony które przechodzą do uzdatnionej wody.
Podział jonitów
W zależności od grup funkcyjnych: * kationity obojętne lub słabo kwaśne które posiadają zdolność wyłapywania kationów w obojętnym lub słabo alkaicznym środowisku * silne kationity są one skuteczne w wyłapywaniu kationów w całym zakresie pH 1-14 * anionity- słabe- wymieniają aniony mocnych kwasów a nie wyłapują anionów kwasów słabych lub obojętnych. *silne anionity mają zdolność usuwania większości anionów a w szczególności anionów słabych kwasów.
Uzdatnianie wody
Prowadzimy ją na jonitach ustawionych szeregowo i możemy przepuszczać wodę przez 2 po sobie ustawione kationity o różnej mocy lub możemy dokonać pełnej demineralizacji wody w wyniku przepuszczenia wody przez ustawione po sobie kationity i anionity. Woda która kierowana jest na jonity musi być podana procesowi wstępnego uzdatniania w celu usunięcia zanieczyszczeń które mogły by być konkurencyjne dla jonów powodujących twardość wody( min. Fe w podwyższonych stężeniach i związki azotu)
Ściekami umownie nazywamy wszystkie wody zużyte i opadowe odprowadzane za pomocą kanalizacji z poszczególnych domów, zakładów przemysłowych, osiedli i miast. Porównywanie z wodami naturalnymi ścieki zawierają znacznie większy ładunek zanieczyszczeń organicznych. Niekiedy mogą zawierać też wolne kwasy i zasady, substancje trujące i materiały biologicznie aktywne.
W zależności od miejsca powstania ścieki dzielimy na:1. bytowo-gospodarcze 2. miejskie 3. przemysłowe 4. opadowe 5. infiltracyjne
Ad. 1 ścieki bytowo-gospodarcze stanowia wody zużyte głównie na terenie domostw i budynkow gospodarczych i składaja się one z wód wykorzystywanych w toaletach, łazienkach, pralniach i kuchni. Stanowią one nietrwały układ mieszaniny zw. organicznych oraz zanieczyszczeń pochodzenia mineralnego. Większość zanieczyszczeń zawartych w tych ściekach jest rozkładana na drodze biochemicznej.
Ad.2 ścieki miejskie posiadaja sklad uzależniony od charakteru miasta na terenie którego powstają, jeśli miasto nie jest uprzemysłowione to ścieki posiadają skład zbliżony do ścieków bytowo-gospodarczych. W przypadku miast na terenie których występuje przemysł skład ścieków może się zmieniać w wyniku mieszania ich z podczyszczonymi ściekami przemysłowymi. Ścieki takie powinny zawierać jednak zanieczyszczenia rozkładane na drodze biochemicznej.
Ad. 3 ścieki przemysłowe to wody odprowadzane z terenów zakładów przemysłowych, służą do uszlachetniania surowców pochodzenia mineralnego, zwierzęcego i roślinnego oraz wody wykorzystywane do wytworzenia gotowych produktów. Wody na terenie zakładu przemysłowego wykorzystywane są do wytwarzania ciepła i energii przy różnych procesach technologicznych, a także powstają w trakcie procesu mycia pomieszczeń, urządzeń. Skład ścieków powstających na terenie zakładu może być różny nawet przy tym samym przemyśle, ponieważ jest on uzależniony od zastosowanej technologii produkcji.
Ad. 4 ścieki opadowe - powstaja w trakcie opadów atmosferycznych w trakcie których dochodzi do zanieczyszczeń z różnych powierzchni. Ścieki te zawierają zanieczyszczenia organiczne i mineralne. W przypadku stosowania kanalizacji ogólnospławnej trafiają one do oczyszczalni, gdzie dochodzi do rozcieńczania ścieków, co w efekcie prowadzi do obciążenia hydraulicznego oczyszczalni.
Ad.5 wody infiltracyjne to wody pochodzące z odwadniania terenów, które są odprowadzane do kanalizacji lub dostają się do niej w wyniku nieszczelności. Wody te stanowią niepotrzebne obciążenie dla oczyszczalni.
Zanieczyszczenia zawarte w ściekach ze względu na ich właściwości możemy podzielić na 3 podstawowe grupy: 1. zanieczyszczenia mechaniczne 2. zanieczyszczenia chemiczne 3. zanieczyszczenia biologiczne
Ad.1 znajdują się w ściekach postaci ciał mineralnych lub organicznych, są to ciała nierozpuszczone w stanie pływających, zawieszonym lub koloidalnym. Wykazują one różne zdolności pozostawania w ściekach w zależności od ciężaru właściwego, stopnia rozdrobnienia, kształtu cząstek, prędkości przepływu ścieków oraz ich temp. Rozróżniamy ciala wleczone tj. piasek, czastki gliny oraz żużle; ciała pływające o ciężarze właściwym <= γ wody: papier, zanieczyszczenia organiczne oleiste; ciała posiadające γ>γ wody lecz taki kształt i wymiary, ze przy określonej prędkości przepływu ścieków pozostaja w nich w stanie zawieszonym. Wystepowanie zaniecz mechan w ściekach nadaje im mętność, opalizację, wystąpienie specyficznego zabarwienia. W przypadku przedostania się zaniecz mech do wód odbiornika dochodzi do procesu fermentacji w wyniku czego mamy pogorszenie parametrów fiz- chem wody.
Ad. 2 mogą wystepować w ściekach w postaci zw pochodzenia organicznego lub mineralnego w stanie rozpuszczonym lub nierozpuszczonym, zjonizowanym lub niezjonizowanym. Zawartość Zan chem charakteryzuje się dużymi wahaniami dobowymi, a duża różnorodność związków zmusza nas do stosowania oznaczeń umownych pozwalających określić stężenie Zan w ściekach. Do podstawowych Zan chem zaliczamy: - rozpuszczone substancje organiczne (białka ok. 40 -60%, węglowodany 25-50%, oleje i tłuszcze ok. 10%. Zanieczyszczenia te są pochodzenia byt - gosp głównie i prawie są one całkowicie rozkładalne na drodze biochemicznej; - rozpuszczone substancje mineralne charakterystyczna dla większości zużywanych wód (siarczany, chlorki i węglany różnego rodzaju gazy, tlen rozpuszczony, H2S); - zanieczyszczenia biogenne - pierwiastki i sole potrzebne do rozwoju żywych organizmow, do podstawowych biogenow zaliczamy azot i fosfor i występują one w ściekach zarówno nieoczyszczonych jak i oczyszczonych biologicznie. Zanieczyszczenia te przedostaja się do wod odbiornika, wzbogacaja jego wody w składniki pokarmowe, co może prowadzic do procesu eutrofizacji; - zanieczyszczenia refrakcyjne nie podlegaja lub podlegaja w niewielkim stopniu rozkładowi biologicznemu, do tego typu zanieczyszczen zaliczamy substancje mineralne(metale ciezkie), substancje organiczne(niektóre detergenty), substancje owadobójcze. Szczegolna grupe wśród zanieczyszcen frakcyjnych stanowia związki toksyczne, czyli pierwiastki i zw chemiczne lub substancje wywołujące w organizmach roślinnych lub zwierzęcych lub w organizmach ludzkich zaburzenia, mogące nawet spowodowac śmierć. Do groźnych trucizn zaliczamy metale ciężkie: Pb,Hg, kadm, pestycydy, wielopierścieniowe węglowodany aromatyczne, nitrozo aminy, dioksyny oraz substancje promieniotwórcze. Wymienione zanieczyszczenia posiadaja co najmniej 1 z posiadanych właściwości - oddziaływanie rakotwórcze, mutagenne, teratogenne oraz zdolność do biokumulacji w lancuchu pokarmowym zwierzat i ludzi. Większość subst toksycznych nie jest usuwana w procesach stosowanych na terenach oczyszcz miejskich a co wiec mogą spowodowac zahamowanie procesow biologicznych oczyszcz scieków, dlatego zaniecz tego typu o ile jest możliwość powinny być usuwane ze ściekami w miejscu ich powstawania.
Ad. 3 zanieczyszcenia biologiczne - mogą one występować w ściekach w postaci organizmow żywych takich jak bakterie, wirusy, nicienie czy tasiemce. Mogą tez występować w postaci form przetrwalnikowych. Dostaja się one do ścieków z wydalinami lub odpadami pochodzenia organicznego i gdy trafiaja na sprzyjające warunki tworza bogata mikrofaune. Ich przeżywalność zalezy od charakteru ścieków, zawartości substancji organicznych, temperatury i odczynu. Większość drobnoustrojow należy do typowych organizmow heterotroficznych, żyjących w przewodzie pokarmowym człowieka i zwierzat. Wśród tych gatunkow można spotkac tez organizmy chorobotwórcze wywołujące żółtaczkę, gruźlice czy dur brzuszny. Zanieczyszczenia te w trakcie oczyszczania ścieków na drodze biologicznej przechodza do osadow sciekowych w których dalej sa niszczone na drodze higienizacji. W przypadku pozostawania ich w sciekach niszczone sa na drodze chlorowania.
Możliwośc odzyskania surowcow ze ścieków.
Problem ten dotyczy ścieków przemysłowych, do których w trakcie produkcji przedostaja się niektóre surowce drogie, a jednoczesnie szkodliwe dla sieci kanalizacyjnej i oczyszczalni. Substancje takie należy pobierac ze ścieków i ponownie zwracac do ciagu technologicznego. Do zanieczyszczen takich można zaliczyc: miał weglowy, fenole, sole miedzi, arsenu, chromu oraz cyjanku.
Proces oczyszczania ścieków.
Caly ten proces sprowadza się do oddzielenia zanieczyszczen od wody. Umownie podzielono na 4 stopnie:1. oczyszczanie wstepne - wykorzystujemy procesy mechan oczyszcz ścieków 2. oczyszczanie biologiczne lub w przypadku ścieków nierozkładalnych na drodze biologicznej oczyszczanie chemiczne. Jednak na oczyszczalniach miejskich dominuje stopien oczyszczania biologicznego 3. doczyszczanie ścieków z substancji biogennych 4. odnowa wody - ponowne przywrocenie wody do uzytkowania w trakcie oczyszczania ścieków w stopniu 1 stosujemy proste procesy mechaniczne tj cedzenie, sedymentacja i flotacja.
W trakcie oczyszczania na stopniu 1 dochodzi do oczyszczania stalych zanieczyszcen pływających i wleczonych, zanieczyszczen mineralnych i organicznych w postaci zawiesiny, olejow i tłuszczow podanych na wydzielenie w postaci flotacji. Dodatkowo dochodzi do usuniecia zanieczyszcen organicznych tj zawiesiny ogolne, zanieczyszczenia organiczne wyrazone wartością BZT5, azt ogólny, fosfor ogólny oraz jaja robaków, bakterie.
W trakcie 1 stopnia oczyszczania ścieków dochodzi do zatrzymywania skratek na kratach i sitach, do zatrzymywania piasku w piaskowniku, zawiesin pochodzenia organicznego w osadnikach wstepnych oraz oddzielenia tłuszczów albo w piaskownikach albo w osadnikach wstepnych lub przy duzych stężeniach w wydzielonych urzadzeniach zwanych odtłuszczaczami. Procesy 1 oczyszcania ścieków maja za zadanie ochrone urządzeń przed duzymi zanieczyszczeniami (przepompownie) oraz przygotowanie ścieków do oczyszczalni ścieków na drodze biologicznej.
Stopien 2 oczyszczania ścieków jest to oczyszczanie na drodze biologicznej i jest on realizowany w urzadzeniach z osiadla lub wolnoplywajaca masa biologiczna.
Proces odbywa się na złożach biologicznych, w komorach osadu czynnego, a w przypadku oczyszczalni mniejszych w stawach biologicznych lub oczyszczalniach hydrobiologicznych. Zasadniczym zadaniem tych procesów jest zatrzymanie zanieczyszczeń organicznych węglowych charakteryzowane wielkością BZT5 i ChZT i OWU i rozkładu ich do wody i CO2 z wykorzystaniem mikroorganizmów w warunkach tlenowych lub beztlenowych. W trakcie drugiego stopnia oczyszczania ścieków dochodzi także do wstępnego usuwania zanieczyszczeń biogennych. Odbywa się to w większości przypadków na drodze biologicznej. Oczyszczanie ścieków trzeciego stopnia, czyli doczyszczanie ścieków ze związków biogennych.
Usuwa on związki biogenne w niewielkim stopniu. Dominują metody chemiczne (usuwanie fosforu za pomocą Fe i Al). Charakteryzuje się wysoką skutecznością, pozwalają na uzyskanie w ściekach oczyszczonych wymaganych stężeń fosforu, lecz niosą za sobą zagrożenia.
Dodatkowy osad, który powstaje w procesie oczyszczania.
Usuwanie fosforu na drodze biologicznej.
Polega na stosowaniu przemiennie warunków.
Związki azotu usuwamy na drodze alkalizacji ścieków do pH 11, odbywa się to z wykorzystaniem wapna. Oprócz azotu usuwamy również fosfor, metale ciężkie oraz zanieczyszczenia refrakcyjne.
Inna metodą preferowana dla ścieków przemysłowych jest usuwanie azotu na wymieniaczach jonowych oraz czwartego stopnia odnowy wody.
Przeprowadzamy w celu zawrócenia wody do układu technologicznego. W procesie tym dążymy do usunięcia z oczyszczenia wody pozostałości zanieczyszczeń refrakcyjnych oraz usunięcia zasolenia ścieków. Stosujemy również metody drogie oparte o procesy sorpcji membranowe oraz o wymianę jonową.
W procesie sorpcji na węglu aktywnym usuwamy zanieczyszczenia refrakcyjne, zaś zasolenie stosujemy procesy membranowe oraz wymianę jonitowa.
Woda odzyskana charakteryzuje się BZT5 w granicach od 1-5 mg O2/dm3. Procesy odnowy wody prowadzone są tylko wtedy, gdy jest konieczne i faza ta ma zastosowanie w przypadku ścieków przemysłowych niż bytowo-gospodarczych.
Biologiczne oczyszczanie ścieków.
W przypadku biol. oczysz. ściek. Wykorzystujemy metabolizm organizmów roślinnych i zwierzęcych do transformacji zanieczyszczeń organicznych i mineralnych zawartych w ściekach. Komorka jest podstawowa jednostka strukturalna, która posiada zdolność pobierani materii i energii z zewnątrz oraz przetwarzanie składników materii. Wyróżnimy dwa typy komórek:
- prokariota: komórki stanowiące samodzielne organizmy - budowę komórki maja wszystkie bakterie oraz sińce. Cechą charakterystyczną jest to, że ta komórka otoczona jest sztywną ścianą komórkową o grubości 10=20 nm. Ściana ta posiada zdolność przepuszczania cząstek z zewnątrz środowiska, w którym znajduje się Komorka oraz umożliwi wydostanie się produktów metabolizmu poza komórkę. Dodatkowo po zewnętrznej ścianie komórkowej dochodzi do wytworzenia otoczki składającej się ze śluzu zawierającej polimery cukru, aminokwasów i kwasów uranowych. Wytworzona otoczka śluzowata tworzy nie tylko ochronę komórki, ale zwiększa tez powierzchnie pobierania składników pokarmowych z otoczenia. Na powierzchni zachodzi proces sorbcji związków organicznych i mineralnych, a także proces koagulacji zanieczyszczeń koloidalnych. Wytworzony śluz stanowi jednocześnie bazę zapasowa dla komórki.
- komórki eukariotyczne - mogą być samodzielnymi organizmami (niektóre grzyby, glony, pierwotniaki) lub mogą Stanowic jakiś element większego skupiska organizmów. W odróżnieniu od prokariota w ich organizmie możemy wyróżnić struktury wewnętrzne. We wszystkich typach organizmów żywych zachodzą przemiany metaboliczne, na które składają się przemiany kataboliczne i anaboliczne.
Przemiany kataboliczne polegają na utlenieniu wewnątrz komórkowym substancji organicznych w celu uzyskania energii niezbędnej do przeprowadzenia procesów anabolicznych.
Anabolizm - to procesy, w których Komorka zużywa energię na swoje podstawowe procesy fizjologiczne (rozmnażanie, synteza składników komórkowych, transport substratów do komórki i metabolizmu z komórki).
Substancje proste (cukry proste, kwasy organiczne czy aminokwasy). Są pobierane przez komórkę do jej wnętrza i tam SA poddawane do jej rozkładu.
Związki złożone (wielocukry, czy inne złożone polimery). Są pocztowo hydrolizowane poza komórka za pomocą egzoenzymów i dopiero w formie prostej pobierane przez komórkę.
Dostępność do danego składnika pokarmowego zależy od typu enzymu wytworzonego przez ta komórkę. W przypadku oczyszczania ścieków wykorzystujemy organizmy heterotroficzne (organizmy, które zdobywają energię tylko w wyniku utleniania materii organicznej. Utlenianie tej materii może odbywać się w warunkach tlenowych lub beztlenowych).
Organizmy funkcjonujące w warunkach tlenowych i beztlenowych nazywają się fakultatywnymi beztlenowcami oraz autotroficzne ( organizmy pozyskujące energie w wyników procesów katabolicznych a także z zewnątrz. Wykorzystują one chemosyntezę. Zasiedlają one wszystkie te środowiska, gdzie znajdują takie związki jak NNH4, azotany, H2S, jony Fe i Mn.
W procesie oczyszczania ścieków najważniejszymi autotrofami są bakterie z grupy Nitrosomonas i Nitroba.
Na dzień dzisiejszy procesy biologiczne odgrywają jedną z najważniejszych ról usuwania ze ścieków substancji łatworozkladalnych. Proces biologicznego oczyszczania ścieków może być przeprowadzony w warunkach: * naturalnych *sztucznych
Dominują procesy tlenowego oczyszczania ścieków i w wyniku działalności mikroorganizmów dochodzi do rozkładu związków organicznych, do CO2 i H2O procesy naturalnego oczyszczania ścieków prowadzone są poprzez zalewanie trenów zielonych lub na polach infiltracyjnych. W procesie oczyszczania ścieków biorą udział rośliny, mikroorganizmy zasiedlające strukturę glebowa oraz mikroorganizmy namnażające się w postaci błony biologicznej.
Metody półnaturalne - zaliczamy: metody wykorzystujące środowisko biologiczne po niewielkich modyfikacjach. Wyróżnimy tu oczyszczanie ścieków metodą oczyszczania stawów biologicznych.
Metody sztuczne - zaliczamy: złoża biologiczne i osad czynny. Znajduje najszersze zastosowanie. W metodach tych wykorzystujemy mikroorganizmy występujące w formie osiadłej i w formie wolnopływającej. W przypadku urządzeń do sztucznego oczyszczania ścieków uzyskujemy niepełne oczyszczanie ścieków. Jest to uzależnione od stopnia obciążenia urządzeń (dla urządzeń niskoobciążonych uzyskujemy od 80-90% usunięcia zanieczyszczeń, dla urządzeń wysokoobiążonych efektywność procesów obniża się do 50%).
Złoża biologiczne - urządzenia do oczyszczania ścieków metoda biologiczna z wykorzystaniem błony biologicznej, składającej się z bakterii, pierwotniaków wolnopływających i osiadłych, grzybów oraz form wyższych często pasożytujących na organizmach wchodzących w skald błony biologicznej. Błona biologiczna powstaje na wypełnieniu w trakcie przepływu ścieków. Wyróżniamy w niej dwie strefy:
- I strefa położona najbliżej wypełnienia - strefa beztlenowa lub niedotleniona, zaś strefa zewnętrzna jest tlenowa - zapewnia kontakt mikroorganizmów z przepływającymi ściekami, posiada ona zabarwienie jasno brązowe do bezowego, strukturę gąbczastą ułatwiająca zatrzymywanie składników pokarmowych. Błona biologiczna ma swoją określoną żywotność i ulega okresowej wymianie. Błona starsza ulega oderwaniu od wypełnienia i przepływa wraz ze ściekami poza złoże biologiczne, gdzie ulega procesowi mineralizacji. Po 4 tygodniach następuje odtworzenie nowej błony biologicznej.
Rozwój złóż biologicznych:
Pierwsze konstruowane były konstrukcje złóż pracujących cyklicznie tzw. Złoża zalewane, pracowały one tak, ze pewna objętość ścieków wprowadzana była do urządzeń następnie po obniżeniu wartości BZT5 ścieków dochodziło do ich usunięcia ze złoża. Charakteryzują się dość niska efektywnością usuwania zanieczyszczeń, dodatkowo obserwowano zatykanie się przestrzeni pomiędzy elementami wypełnienia przez zawiesinę zawarta w ściekach. Wady tego typu złóż spowodowały wprowadzenie modyfikacji w postaci złóż zraszanych o pracy ciągłej. Przepływające ścieki przez złoże stanowią źródło składników pokarmowych, tlenu oraz są czynnikami usuwającym ze złoża obumarłą błonę biologiczna. Za złożami zraszanymi stosuje się osadniki wtórne w celu oddzielenia błony biologicznej od ścieków oczyszczonych. Procesy rozkładu związków organicznych węglowych zachodzą w górnych warstwach złoża ( tam dominują organizmy heterotroficzne ) zaś w głębszych partiach złóż zachodzą procesy nitryfikacyjne i denitryfikacyjne prowadzone przez organizmy autotroficzne. Pomiędzy heterotrofami a autotrofami prowadzona jest ciągła konkurencja o składniki pokarmowe oraz organizmy charakteryzujące się różną odpornością na działanie czynników zewnętrznych ( obciążenie hydrauliczne , obciążenie ładunkiem zanieczyszczeń , temperatura dopływających ścieków , pH , zawartość w ściekach składników toksycznych ). Większą czułością na występowanie substancji toksycznych charakteryzują się autotrofy . W momencie przedostania się do złoża substancji toksycznych w pierwszej kolejności obserwujemy zanik procesu nitryfikacji i denitryfikacji ,a dopiero później zanik reakcji heterotrofów .
Oczyszczalnie miejskie ( bytowo - gospodarcze) to obecnie w oczyszczalniach tych dominują reaktory z osadem czynnym - skupiska mikroorganizmów czynnych otoczone śluzowatą wydzieliną tworzące charakterystyczne drobiny w postaci kłaczków osadów. W reaktorze osadu czynnego ważne jest utrzymanie struktur osadu w ciągłym ruchu i kontaktu osadu ze ściekami . Zapewnia to proces napowietrzania komór albo proces napowietrzania komór beztlenowych. Proces oczyszczania metodą osadu czynnego może być prowadzony w układzie konwencjonalnym , gdzie mamy wprowadzanie ścieków surowych na początek komory osadu czynnego i stopniowe obniżanie wartości BZT 5 w trakcie przepływu ścieków przez komory . W układzie takim pod koniec przepływu ścieków przez komorę mamy znaczne obniżenie BZT 5 przy jednoczesnym obniżeniu tlenu rozpuszczonego w komorze. Inną metodą oczyszczania metodą osadu czynnego jest podział komory na kilka stref lub zastosowanie po sobie kilku komór o przemiennie warunkach beztlenowych , niedotlenionych , tlenowych. Zastosowanie takiego układu pozwala na połączenie usuwania ze ścieków zanieczyszczeń organicznych węglowych oraz zanieczyszczeń biogennych tj. azot i fosfor. Na prace osadu czynnego wpływają następujące czynniki :*obciążenie hydrauliczne komory *obciążenie ładunkiem zanieczyszczeń *temperatura i pH ścieków *mieszanie ścieków *sposób dostarczenia powietrza ( w takiej ilości aby zapewnić odpowiednie wymieszanie komory przy jednoczesnym pozostawieniu struktury kłaczka)
Zjawiskiem niepożądanym w przypadku osadu czynnego jest zjawisko pęcznienia ( puchnięcia) osadu. Jest ono spowodowane namnażaniem się bakterii nitkowatych. Objawia się tym , że osad czynny zamiast sedymentować zaczyna wypływać na powierzchnię komory osadu czynnego . Jest to proces niepożądany. Może spowodować wypływanie cząstek osadu ze ścieków oczyszczonych do wód odbiornika. Proces ten możemy zahamować poprzez zastosowanie chlorowania w celu zniszczenia bakterii nitkowatych. Dawka chloru nie powinna przekraczać 1,5 g. Cl / kg suchej masy osadu. Puchnięciu osadu sprzyjają czynniki: *niskie stężenie tlenu rozpuszczonego w komorze *dopływ ścieków zagniłych zawierających H2S *niska zawartość w ściekach dopływających Azotu i Fosforu *niskie pH < 6,0 *duża zmienność ładunku BZT 5 w dopływających ściekach
Usuwanie związków biogennych ze ścieków
Związki azotu i fosforu są wskaźnikami zanieczyszczenia wód naturalnych , ich obecność w wodach powierzchniowych stanowi poważne niebezpieczeństwo nasilania się procesu eutrofizacji. Granicznymi stężeniami obu tych pierwiastków przy których obserwujemy masowe namnażanie się glonów są wartości 0,3 mg N / litr i 0,1 PO4 / litr. Źródłem azotu i fosforu w wodach naturalnych mogą być między innymi ścieki bytowo gospodarcze i przemysłowe wprowadzane bez wcześniejszego oczyszczania. Dodatkowym problemem jest niewystarczające usuwanie tych pierwiastków na drodze biologicznej. Obecnie ścieki oczyszczane są z nadmiernej zawartości fosforu na drodze chemicznego strącania solami glinu i żelaza , które wraz z fosforanami tworzą nierozpuszczalne wytrącane osady . Najczęściej stosowanymi reagentami są siarczan Fe 2+, chlorek Fe 3+ oraz siarczan Al.
Al2 (SO4)3 X 18 H2O + 2 PO4 3- => 2 AlPO4 + 3 SO4 2- +18 H2O
Jeden mol Al2 (SO4)3 reaguje z dwoma molami PO4 3- zawierającego 62 g fosforu. Z tąd stosunek wagowy siarczanu glinu do fosforu wynosi 10,7 : 1 , a glinu do fosforu 0,87 : 1.
W praktyce jednak przyjmujemy wyższy stosunek molowy glinu do fosforu niż to wynika z zapisu reakcji i wynosi on zwykle 1,5 : 3,0 . Jest to spowodowane reakcjami przebiegającymi w ściekach równolegle z reakcją wiązania fosforu. Podstawowymi czynnikami od , których zależy dawka reagenta są: *zasadowość oczyszczonych ścieków *pH końcowe *dodatkowo ilość i charakter zawiesiny *stężenie siarczanu i sodu w oczyszczonych ściekach
Optymalna wartość pH przy strącaniu fosforu za pomocą Al2 (SO4)3 mieści się w granicach
5,5 - 6,5.W przypadku pH ścieków poza tymi granicami konieczne jest zwiększenie dawki reagenta
FeCl3 + PO4 3 - => FePO4 + 3 Cl -
3 FeSO4 + 2 PO4 3- => Fe3(PO4)2 + 3SO4 2-
Stosując sole Fe 3+ uzyskujemy stosunek molowy żelaza do fosforu 1 : 1 a stechiometryczny ( wagowy ) 1,8 : 1 , zaś w przypadku zastosowania soli Fe 2+ stosunek molowy żelaza do fosforu wynosi 3 : 2 , a wagowy 2,7 : 1 . W rzeczywistości ze względu na przebiegające reakcje towarzyszące stosunek molowy jest zawsze wyższy => 1,5 do 2,5 w zależności od zasadowości oczyszczanych ścieków. Istotną rolę odgrywa też pH oczyszczanych ścieków , które dla związków Fe 3+ jest optymalne w granicach 4,5 do 5,0 , a dla związków Fe 2+ optymalne pH wynosi około 8 .
Drugą metodą chemicznego usuwania fosforu jest strącanie fosforu z wykorzystaniem wapna.
W odróżnieniu od metod , w których wykorzystujemy związki żelaza i glinu. Strącanie wapnem nie jest uzależnione od zawartości fosforu w ściekach , ale zależy jedynie od pH i zasadowości . Stosujemy tu dwa typy dawkowania: (1). system małej dawki gdzie pH oczyszczanych ścieków doprowadzamy do wartości < 10. (2). system dużej dawki => pH = 11,0 - 11,5
W przypadku stosowania dużej dawki masa wapna jaką dozujemy do ścieków może dochodzić nawet do wartości 500g Ca(OH)2 / m3 ścieków. Obniżenie wartości fosforu w oczyszczanych ściekach uzyskujemy nawet do wartości 1 mg P/ litr. Jednak w metodzie tej konieczna jest ponowna korekta pH ścieków oczyszczanych odprowadzonych do odbiornika. Dodatkowo w metodzie tej powstają znacznie większe ilości osadów niż w metodzie strącania fosforu za pomocą soli żelaza i glinu.
Reagenty dodawane do ścieków mogą być dodawane w różnych punktach ciągu technologicznego i mogę być one wprowadzane do urządzeń istniejących lub mogą być budowane oddzielne komory reakcji . Wyróżniamy: 1*. strącanie wstępne gdzie dawkujemy reagenty do piaskownika lub pomiędzy piaskownik a osadnik wstępny. Metoda ta pozwala na dobre wymieszanie ścieków z reagentami , zapewnia usunięcie nie tylko fosforu ale też BZT5 i zawiesiny. Niestety metoda ta ,może spowodować zaburzenie dalszego biologicznego oczyszczania ścieków ( wapno) oraz dodatkowo nie zapewnia nam usuwania fosforu powstałego w trakcie biologicznego oczyszczania ścieków.2*. strącanie symultaniczne? Polega ono na wprowadzaniu soli glinu luz żelaza bezpośrednio do komory tlenowej osadu czynnego. Dodatkowo jeśli musimy usunąć wysokie stężenie fosforu zalecane jest aby reagenty dodawane były w kilku punktach komory. 3*. strącanie wtórne reagenty wprowadzane są przed osadnikiem wtórnym albo w układzie jest oddzielna komora defosfatacji. W porównaniu z wcześniejszymi metodami stosujemy tu znacznie mniejsze dawki reagentów i dokładnie można dobrać dawkę do oczekiwanego efektu oczyszczania , niestety metoda ta jest najdroższa ze względu na wysokie koszty dodatkowych urządzeń.
Sole glinu i żelaza Zalety : uznaje się te metody za łatwe i proste w eksploatacji , stężenie fosforu w ściekach oczyszczanych zależne jest od dawki reagenta. Dodatkowo zastosowane chemikalia poprawiają właściwości sedymentacyjne powstających osadów . Dodatkowo oprócz fosforu usuwane zanieczyszczenia charakteryzowane wartością BZT 5 i zawiesiny. Wady: w porównaniu z metodami biologicznymi strącanie chemiczne obciążone jest wyższym kosztem eksploatacyjnym. Dodatkowo koszt reagentów zmienia się każdego roku , co powoduje wzrost kosztów usuwania fosforu. Wzrasta zasolenie ścieków oczyszczanych , a co za tym idzie wzrastają ich właściwości korozyjne .
Wapno Zalety: niski koszt reagenta , prosty sposób dawkowania (oparty na pH) , oprócz usuwania związków fosforu usuwanie ze ścieków metali ciężkich Wady : konieczność ponownej korekty pH ścieków oczyszczonych , duża objętość powstających osadów i wysoki koszt urządzeń stosowanych do dawkowania oraz koszt pomieszczeń służących do magazynowania reagenta.
Biologiczne usuwanie fosforu W normalnych warunkach pracy osadu czynnego konwencjonalnego , uzyskujemy jedynie 2% zatrzymywania fosforu w przeliczeniu na suchą masę bakterii. Odkryto jednak że istnieją pewne grupy bakterii posiadające zwiększoną zdolność zatrzymywania fosforu , jeśli zapewni im się odpowiednie warunki rozwoju. Jeśli natrafią one na takie warunki potrafią zatrzymać fosfor nawet w ilościach do 25 % suchej masy komórkowej.Warunki jakie musimy im zapewnić to przemienne warunki beztlenowo - tlenowe w kom orze , występowanie w ściekach produktów fermentacji ( uzyskane przez doprowadzanie do komory osadu czynnego ścieków zagniłych lub cieczy z komory fermentacji. Dodatkowo w ściekach nie powinno być azotanów , a stosunek zanieczyszczeń węglowych wyrażanych wartością BZT 5 do fosforu powinna wnosić od 20 do 25 w ściekach dopływających do KOC. Przy zapewnieniu tych warunków bakterie w strefie beztlenowej pobierają ze ścieków produkty fermentacji co zapewnia im odpowiednia energię życiową . Następnie mikroorganizmy przedostając się do strefy tlenowej gdzie istniej silna rywalizacja o pokarm , korzystając z wcześniej zgromadzonych produktów fermentacji i tworzą nowe produkty w trakcie budowy których pobierają fosfor rozpuszczony w ściekach. Ścieki kierowane są do osadnika wtórnego ( następuje rozdział osadu czynnego od ścieków oczyszczonych ) dla prowadzenia procesu musimy zapewnić prawidłowe funkcjonowanie osadnika , który zapewni nam dokładne rozdzielenie ścieków od osadów , oraz odpowiedni czas przetrzymywania ścieków oczyszczonych w osadniku , ponieważ nadmierny czas przetrzymywania może spowodować wtórne uwalnianie fosforu do ścieków oczyszczonych.
Usuwanie azotu Na terenie oczyszczalni byt- gosp obecnie odbywa nie na drodze biologicznej. Proces amonifikacji - polega na przemianie azotu organicznego do azotu amonowego i przebiega w warunkach zarówno tlenowych jak i beztlenowych i rozpoczyna się już w trakcie przesyłu ścieków do oczyszczania dlatego nie ma konieczności budowania oddzielnych urządzeń a prędkość procesu przewyższa wielokrotnie prędkość procesu nitryfikacji . Proces nitryfikacji to proces tlenowy , polegający na przejściu azotu amonowego w postać azotanową . Proces przebiega z udziałem dwóch grup mikroorganizmów . Pierwsza reakcja odbywa się z udziałem bakterii Nitrosmonas i polega na przemianie azotu amonowego do azotynów . Po czym azotyny pobierane są przez bakterie Nitrobacter i przemieniane są w azotany. Wzrost Nitrobacter jest o wiele większy niż wzrost Nitrosononas , dlatego pierwsza reakcja jest reakcją limitującą przebieg nitryfikacji Proces ten uzależniony jest od następujących czynników; *temperatura procesy *stężenia tlenu rozpuszczonego od 1 do 2 mgO2/ litr
pH od 7,5 do 8,5 *występowania substancji toksycznych w oczyszczanych ściekach *zawartości związków azotu . Proces nitryfikacji przebiega w temperaturze 5 do 30 0 C . Optymalna temperatura to 25 - 28 0 C wtedy prędkość reakcji jest największa. Spadek temperatury powoduje stopniowe zahamowanie procesu a spadek poniżej 5 0 C może całkowicie zahamować proces.
Bakterie nitryfikacyjne jako autotrofy charakteryzują się dużą wrażliwością na substancje toksyczne. Efektem występowania substancji toksycznych w ściekach może być całkowite zahamowanie procesu nitryfikacji . Sam azot amonowy może być substancją szkodliwą dla mikroorganizmów . Przyjmuje się ze optymalne stężenie N NH4+ dla wzrostu mikroorganizmów to 7 mg NNH4+/ litr. Proces denitryfikacji - proces zachodzi w warunkach beztlenowych proces dysymilacji azotu , czyli przejścia azotanów do azotu gazowego z udziałem mikroorganizmów heterotroficznych ( bakterie z grupy Achromobacter) Proces ten zależy od :*temperatury 20 0 C ; przebiega jeszcze w temperaturze 5 0C , ale jego efektywności jest mniejsza o 20 % niż w temperaturze optymalnej *pH 6,5 do 7,5 *stężenia tlenu rozpuszczonego < lub = 0,5 mg O2 / litr. Zahamowanie procesu denitryfikacji obserwujemy przy spadku pH < 6 oraz przy wzroście pH > 8.
Proces fermentacji - proces beztlenowego oczyszczania ścieków zalecany do oczyszczania ścieków przemysłowych posiadających skłonności do zagniwania . Na terenie dużych oczyszczalni miejskich proces fermentacji wykorzystujemy do przeróbki osadów ściekowych. Proces ten prowadzony jest w komorach fermentacyjnych otwartych lub zamkniętych . Obecnie dominują komory fermentacyjnie zamknięte.Przemiany biochemiczne odpowiadające za proces fermentacji prowadza do rozkładu zanieczyszczeń organicznych do substancji prostych metanu i CO2. Proces fermentacyjny dzielimy na dwie fazy:1 faza kwaśna osad przyjmuje strukturę śluzowatą , kleistą o nieprzyjemnym zapachu , produktami tej fazy są kwasy i alkohole
Tlenowa stabilizacja osadów - ma ona doprowadzić do pozbawienia osadów zdolności do zagniwania czyli trzeba doprowadzić do rozkładu zw. organicznych zawartych w osadach.
Tlenową stabilizację odpadów można prowadzić:
- przez stabilizację chemiczną
- przez stabilizację biologiczną
~Stabilizacja chemiczna polega na utlenianiu zw. organicznych za pomocą tlenu dostarczanego z zewnątrz źródłem takiego tlenu są zw. chemiczne tj. chromiany, podchloryny, czy nadmanganian potasu lub gazy tj. czysty tlen czy powietrze.
~Biologiczna stabilizacja tlenowa - polega na tlenowym rozkładzie substancji organicznych z udziałem mikroorganizmów, rozkładowi ulegają tylko substancje przyswajalne przez mikroorganizmy. Proces odbywa się w komorach o konstrukcji podobnej do osadu czynnego, ale proces przebiega w sposób odmienny. Osad wprowadzany jest do komory w której poddawany jest intensywnemu mieszaniu i napowietrzaniu, proces ten prowadzony jest tak długo aż dojdzie do całkowitej mineralizacji zw. organicznych - po tym okresie usuwany z komory stabilizacji.
Zmniejszenie objętości osadu - uzyskujemy przez usunięcie wody z osadu. Wody które występują w osadach charakteryzują się różnym stopniem powiązania z tym osadem w zależności od łatwości usuwania wody: a) proces zagęszczania grawitacyjnego - polega na wykorzystaniu sił grawitacji, przeprowadzany w zagęszczaczach może być przeprowadzany w sposób cykliczny, polegający na wprowadzeniu osadu do zagęszczacza, następnie rozdzielenie osadu z nadcieczy osadowej -> opróżnienie zagęszczacza - czyli oddzielne wydzielenie osadu i wody nadosadowej. b) zagęszczanie ciągłe - w sposób ciągły wprowadzamy do urządzenia osad w sposób ciągly doprowadzamy wydzielony osad i wodę nadosadową Proces zagęszczania zależy od: *charakteru osadu *stopnia jego uwodnienia *zawartości substancji mineralnych *zastosowania czynników wspomagających *od tempa procesu. c) proces zagęszczania może być także prowadzony met. filtracji w przypadku osadów wykazujących opadanie flotacyjne prowadzi się w sposób ciągły w zagęszczaczach o komorach wyposażonych w system doprowadzania powietrza przyspieszającego proces flotacji d) Metoda odwaniania osadów jest odwadnianiem osadów w warunkach naturalnych - wykorzystuje się proces filtracji i parowania. Proces odwadniania naturalnego można prowadzić w lagunach i poletkach osadowych.
LAGUNY - cykl odwadniania trwa 3 lata, są zbiornikami najczęściej ziemnymi w których gromadzony jest osad, dno laguny wyposażone jest w system drenów odprowadzających wody oddzielające się od osadów
Cykl pracy laguny:* w 1 roku wypełniana jest osadem, osad składany na ogół ok. 2m. *w 2 roku dochodzi do odwodnienia osadu * w 3 roku poświęcony opróżnianiu laguny i jej renowacji, odchodzi się do ich stosowania
POLETKA OSADOWE - są to wydzielone tereny na których położony jest system drenów obsypanych warstwą żwiru, na żwirze ułożona jest warstwa piasku, osad wylewany jest jednorazowo warstwą o grubości ok. 20-30 cm. Różny okres odwadniania - do 5 miesięcy, potem osad powinien posiadać zapach ziemisty, a jego struktura powinna przypominać strukturę ziemi, potem osad zbierany z poletka, poletko czyszczone i dalej zalewane. Na terenach gdzie występują duże ilości opadów zaleca się stosowanie zadaszenia poletek w celu skrócenia procesu suszenia.
W odwadnianiu osadów na poletku najpierw proces filtracji - potem proces parowania
W przypadku środków trudno usuwalnych z osadu stosujemy mechaniczne odwadnianie osadu - polega ono na filtracji osadu w warunkach wymuszonych lub na drodze odwirowania.
Proces filtracji w warunkach wymuszonych uzyskujemy w warunkach podciśnienia albo nadciśnienia filtracja taka przeprowadza się w prasach gdzie osad umieszczany jest w specjalnych komorach lub pomiędzy dwoma pasmami tkanin filtracyjnych i następnie poddawany procesowi ściskania w wyniku tego działania dochodzi do odfiltrowania z osadu wód które nie ulegają samoistnemu odpływowi.
Odwirowanie - w wirówkach, których osad poddawany działaniu sił odśrodkowych, które prowadzą do wydzielenia osadu na wewnętrznym bębnie wirówki
Odwadnianie termiczne - suszenie osadów, w procesie suszenia usuwane są pozostałości wody w wyniku procesu odparowania, proces odparowania w piecach, suszenie w wyniku doprowadzania ciepła z zewnątrz. Czynnikiem suszącym - podgrzewane powietrze w procesie suszenia.
Oprócz ubytku wody dochodzi do czasowego rozkładu substancji organicznych oraz do zniszczenia mikroorganizmów z osadu ostateczne unieszkodliwienie osadów w celu wykorzystania właściwości osadu i zagospodarowanie w ten sposób aby nie był uciążliwy dla środowisk:
(*)1met. Proces kompostowania który polega na mineralizacji i humifikacji substancji organicznych zawartych w osadzie . Osad do kompostowania poddany jest procesowi higienizacji polegającej najczęściej na wapnowaniu, następnie osad mieszany z substancją wzbogacającą go w składniki węglowe (słoma lub trociny) tak przygotowany osad układany jest w kopiec w którym rozpoczyna się proces kompostowania
~1 etap - samoczynny, gruntowny wzrost temperatury do ok. 70oC któremu towarzyszy rozwój bakterii termofilnych oraz rozkład substancji białkowych, węglowodanowych, tłuszczowych występujących w osadnikach. Proces trwa od 10-14 dni.
~2 etap - spadek do temp 40-60 oC któremu towarzyszy proces mineralizacji i humifikacji, powstanie próchnicy, rozwoju bakterii, grzybów, trwa od 4-8 tygodnia
~3 etap - powolne obniżanie się temp złoża kompostowego do temp otoczenia któremu towarzyszy zmniejszenie ilości bakterii termofitowych i mezofilowych - okres dojrzewania kompostu. Wskaźnikiem zakończenia procesu jest pojawienie się w kompoście azotanów lub fosforanów oraz osiągnięcie odpowiedniego stosunku węgla do azotu, węgla do fosforu (C-N 20:1, C-P 100:1). Dojrzały kompost poddawany analizie chemicznej pod względem składników nawożonych ale także zawierających metali ciężkich oraz jaj pasożytów. W zależności od tych parametrów kompost może być przeznaczany do nawożenia terenów rolniczych lub nierolniczych
(*)2met - ostateczne zagospodarowanie osadów jest wykorzystaniem jego właściwości cieplnych - polega na spaleniu osadu w temp 720-750 oC za pomocą doprowadzanego gorącego powietrza w wyniku czego uzyskujemy gorące powietrze, natomiast objętość osadu zmniejsza się wielokrotnie a masa osadu zamienia się w popiół, który po osiągnięciu może być składowany na wysypiskach lub mieszany z kompostem i dalej zagospodarowany
Na dzień dzisiejszy są to 2 dominujące drogi zagospodarowania osadu.
Rysunek - proces koagulacji
Rys.1 :
Rys 2
RYS 3
RYS 4.
RYS 5
RYS 6
M- membrana
\ -rozpuszczalnik - czysta woda niezawierająca zanieczyszczeń
……… jony jednowarstwowe
------------ jony dwuwarstwowe lub o większym ładunku. Wielkość cząsteczek ok. 1 m
***** cząsteczki o wielkości 1-10 m
RYS 7
RYS 8
RYS 9
RYS 10
- . - . -. - . oznaczona jest membrana aniono wymienna
- - - - - membrana kationo wymienna
S - solanka roztwór zagęszczonych jonów
WU woda uzdatniona pozbawiona zanieczyszczeń
Wyszukiwarka
Podobne podstrony:
kulka egzam, technologia wody i scieków
wersja do nauki, Studia - inżynieria & ochrona środowiska (inż. mgr.), Technologie wody i ścieków, P
analiza wody, technologia wody i sciekow Jachimko
ZWIĄZKI REFRAKCYJNE I METODY ICH USUWANIA ZE ŚCIEKÓW, Technologia Wody i Ścieków
spr woda3 próbki, technologia wody i sciekow Jachimko
azotany, Technologia Wody i Ścieków
Technologia sciekw Wyklady-sciaga, do Szkoły, matura, praca mgr i podyplom., encyklopedie, ściągi, T
Uzdatnianie wody - Odgazowanie (1), Technologia Wody i Ścieków
Projekt oczyszczalni sciekow Lukasz Jankowsk-Kate made, Technologia Wody i Ścieków
KOAGULACJA1sd, technologia wody i sciekow Jachimko
Technologia wody i ścieków - podziemnaKuba
technol sciaga, technologia wody i scieków
Przebieg linii ciśnień i energii wzdłuż przewodu, Technologia Wody i Ścieków
Wyznaczanie wskaźników stabilności wody i napowietrzanie wody, Ochrona środowiska, Technologie wody
Złoże biologiczne, Technologia Wody i Ścieków
TECHNOLOGI WODY I ŚCIEKÓW, KOAGULACJA - M˙tno˙˙ lub barw˙ wody powoduj˙ cz˙stki sta˙e - zawiesiny or
adsorpcja, technologia wody i sciekow Jachimko
więcej podobnych podstron