INSTYTUT TECHNOLOGII NIEORGANICZNEJ I NAWOZÓW MINERALNYCH
WYDZIAŁ CHEMICZNY
POLITECHNIKA WROCŁAWSKA
Technologia chemiczna - surowce i procesy przemysłu nieorganicznego
Ćwiczenie: Przygotowanie wody do celów przemysłowych
Spis treści: strona
Wprowadzenie 2
Sposoby wykonania oznaczeń 4
Część obliczeniowa ćwiczeń 7
Wyjaśnienia do części obliczeniowej ćwiczeń 9
Wzór sprawozdania 10
Wrocław 2010
Opracował dr inż. Izydor Drela
1. Wprowadzenie
Woda stanowi nie tylko ważny element naturalnego środowiska, lecz posiada bardzo istotne znaczenie gospodarcze, ze względu na jej szerokie zastosowanie w przemyśle, energetyce, gospodarce rolnej i leśnej, a także w gospodarstwach domowych. Wartość pH wód naturalnych jest zawarta najczęściej w granicach 6,5-8,5, a przewodność właściwa w granicach 3,3·10-4 - 1,3·10-3 S/cm. Różnice te są spowodowane przede wszystkim zawartością CO2 oraz soli kwasu węglowego w wodzie. Dzięki ich obecności wody naturalne wykazują zdolność zobojętniania mocnych kwasów (zasadowość) oraz mocnych zasad (kwasowość). Rozróżnia się dwa rodzaje kwasowości i dwa rodzaje zasadowości wód. Zależności pomiędzy obecnością w wodzie różnych domieszek, a wartością pH oraz poszczególnymi rodzajami kwasowości i zasadowości, przedstawiono w tabeli 2. W tabeli tej podano również reakcje zachodzące przy oznaczaniu zasadowości i kwasowości.
Tabela 2. Wpływ domieszek na odczyn i właściwości wody.
Wartość pH |
4,6 8,3 |
||
Rodzaj wskaźnika |
Metyloranż Fenoloftaleina |
||
Kolor roztworu |
różowożółty← →żółty bezbarwny← →czerwony |
||
Rodzaj zasadowości |
|
||
|
|
||
Domieszki powodujące zasadowość |
|
HCO3- |
CO32- CO32- + HCO3- CO32- + OH- OH- |
Reakcje podczas oznaczania zasadowości |
|
HCO3- + H+ = H2CO3 = H2O + CO2 |
OH- +H+ = H2O CO32- + H+ = HCO3- |
|
kwasowość ogólna |
||
|
|
||
Domieszki powodujące kwasowość |
silne kwasy miner. (HCl, H2SO4), hydrolizujące sole silnych kw. i słabych zasad (np. FeSO4) |
CO2, (H2CO3)*, |
|
Reakcje podczas oznaczania kwasowości |
H+ + OH- = H2O |
CO2 + OH- =HCO3- |
|
* H2CO3 stanowi nieznaczną część CO2 rozpuszczonego w wodzie.
Ditlenek węgla, wodorowęglany i węglany zawarte w wodach naturalnych, pochodzą z atmosfery, z procesów mineralizacji związków organicznych oraz z procesów rozpuszczania skał węglanowych.
Do określenia łącznej zawartości CO2 H2CO3, HCO3- i CO32- w wodzie używa się pojęcia ogólny ditlenek węgla. Schemat układu rodzajów ditlenku węgla w wodach naturalnych przedstawiono na rys. 1. Związany ditlenek węgla występuje w postaci jonów CO32- i HCO3-, natomiast wolny ditlenek węgla - w postaci H2CO3 (ok. 1%)i rozpuszczonego CO2 w wodzie(ok. 99%). Część wolnego ditlenku węgla, niezbędna do utrzymania w roztworze rozpuszczonego Ca(HCO3)2 nazywa się ditlenkiem węgla przynależnym (równowaga węglanowo-wapniowa), natomiast pozostała część ditlenku węgla wolnego to ditlenek węgla agresywny w stosunku do betonów i metali. Równowagę węglanowo-wapniową opisują równania (1) i (2):
Ca(HCO3)2 ↔CaCO3↓ + H2O +CO2↑ (1)
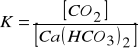
(2)
Z równania (2) wynika, że stężenie ditlenku węgla przynależnego jest wprost proporcjonalne
do stężenia jonów wodorowęglanowych. Ditlenek węgla agresywny (różnica między CO2 ogólnym
i przynależnym) jest zdolny do reakcji z CaCO3, będącym składnikiem betonu. Przebieg tej reakcji powoduje tzw. korozję węglanową betonu.
Rys. 1. Charakterystyka ditlenku węgla występującego w wodach naturalnych
Jednym z podstawowych wskaźników charakteryzujących wodę jest jej twardość. Jest ona powodowana obecnością kationów wieloładunkowych, głównie wapnia i magnezu, które zdolne są do tworzenia kamienia kotłowego. W wodach naturalnych dominują sole wapnia i magnezu, natomiast inne kationy powodujące twardość występują w znacznie mniejszych ilościach. Rozróżnia się więc twardość wapniową, magnezową oraz twardość ogólną, będącą sumą twardości wywołaną przez wszystkie kationy wielowartościowe. Podczas ogrzewania wody zawarte w niej wodorowęglany rozkładają się wg równań reakcji:
Ca(HCO3)2 = CaCO3↓ + H2O + CO2↑ (3)
Mg(HCO3)2 = MgCO3↓ + H2O + CO2↑ (4)
MgCO3+ H2O = Mg(OH)2↓ + CO2↑ (5)
Powstający w wyniku tych reakcji węglan wapniowy i wodorotlenek magnezowy oraz mogący się tworzyć siarczan wapniowy osadzają się na ściankach urządzeń, w których ogrzewa się wodę, tworząc tzw. kamień kotłowy.
Do celów przemysłowych i komunalnych używane są wody powierzchniowe i gruntowe. Tylko w niewielu przypadkach woda pobierana ze źródła nadaje się bezpośrednio do użycia - zwykle należy ją przed użyciem uzdatnić. Stosowane są różne metody uzdatniania wody ale zwykle najwięcej kłopotów sprawiają wody zawierające znaczne ilości substancji organicznych.
Zastosowanie wody w przemyśle jest bardzo różnorodne. Woda stanowi bowiem:
środowisko reakcji prowadzonych w roztworach wodnych
surowiec chemiczny
nośnik ciepła w procesach ogrzewania i chłodzenia
środek pomocniczy w różnych procesach technologicznych.
Największa część wody zużywanej przez przemysł to woda chłodząca. Przenoszenie ciepła podczas chłodzenia odbywa się tu najczęściej przy małych różnicach temperatury. Osady tworzące się na powierzchniach chłodzonych powodują więc znacznie większe pogorszenie wymiany ciepła, niż podczas odparowania w kotłach parowych, kiedy różnica temperatury jest znacznie większa.
W zależności od zastosowania, woda musi spełniać odpowiednie wymogi ujęte w normach. Szczególnie wysokie wymagania stawiane są wodzie stosowanej w energetyce. Jakość użytej wody decyduje często nie tylko o wskaźnikach ekonomicznych produkcji, ale wpływa również w istotny sposób na trwałość oraz niezawodność aparatów i urządzeń.
Stosowanie wody w energetyce jako nośnika ciepła jest powszechne. Wody naturalne w stanie surowym na ogół nie nadają się do zastosowania w energetyce. Ich zanieczyszczenia powodują tworzenie się kamienia kotłowego, zaburzenia w odparowaniu wody oraz korozję urządzeń. Przygotowanie wody naturalnej do zastosowania w energetyce wymaga zwykle przeprowadzenia wielu operacji, mających na celu usunięcie z niej pewnych zanieczyszczeń lub korektę jej właściwości, przy niewielkich zmianach składu. W celu usunięcia osadów i zawiesin wodę rzeczną przepuszcza się przez filtry piaskowo-żwirowe. Po filtracji uzyskuje się wodę surową, którą poddaje się dekarbonizacji, a następnie koagulacji, dodając wodorotlenek wapniowy i substancje, które hydrolizując, wytwarzają cząstki koloidalne o przeciwnych ładunkach elektrycznych, w stosunku do cząstek znajdujących się w wodzie. Cząstki koloidów (obecne w wodzie i wytworzone w wyniku wprowadzania koagulantów) łączą się w aglomeraty, które można oddzielić na filtrach. Między innymi zachodzą wtedy następujące reakcje:
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3↓ + 2H2O
FeSO4 + 2H2O = Fe(OH)2(koloid) + H2SO4
Al2(SO4)3 +6H2O = 2Al(OH)3 (koloid) +3H2SO4
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
Otrzymuje się wodę skoagulowaną i zdekarbonizowaną, którą dalej przerabia się na dwa sposoby, prowadząc zmiękczanie lub demineralizację. Zmiękczanie wody ma na celu usunięcie kationów wielowartościowych (głównie wapnia i magnezu), które prowadzi się na wymieniaczach jonowych kationitowych, pracujących w cyklu sodowym:
![]()
Demineralizacja wody następuje kolejno w wymieniaczach kationitowych, pracujących w cyklu wodorowym i anionitowych, pracujących w cyklu wodorotlenowym. Zachodzą tu następujące procesy:
![]()
![]()
W wyniku przepuszczenia wody dodatkowo przez złoże węgla aktywnego następuje ponadto oczyszczenie wody z substancji organicznych.
Końcowym etapem przygotowania wody kotłowej jest zwykle jej odgazowanie (usunięcie tlenu i resztek ditlenku węgla) oraz regulowanie jej zasadowości (korekta pH). Obecność nawet niewielkich ilości tlenu i ditlenku węgla w wodzie kotłowej powoduje duże zagrożenie korozyjne dla kotłów parowych, szczególnie przy niskich wartościach pH wody. Tlen spełnia tu rolę depolaryzatora w procesie korozji (roztwarzania) metalowych elementów kotłów i dlatego w większości przypadków musi być niemal całkowicie usunięty.
Odgazowanie wody prowadzi się najczęściej metodą termiczną. Wodę spływającą przez dziurkowane płyty w kolumnie odgazowywacza podgrzewa się przeciwprądowo przegrzaną parą, w wyniku czego następuje jej rozbijanie na drobne kropelki i usuwanie z nich gazów. Resztki tlenu usuwa się z wody za pomocą substancji redukujących (np. siarczanyIV, SO2, hydrazyna). Korektę pH wody (utrzymanie jej alkaliczności w pewnych granicach) prowadzi się dodając NaOH (200-500 mg/dm3 czystej wody).
2. Sposoby wykonania oznaczeń
Oznaczanie przybliżonej zawartości soli rozpuszczonych w wodzie metodą konduktometryczną
Zasada oznaczania
Oznaczenie polega na wyznaczeniu przewodnictwa właściwego badanej wody w określonej temperaturze oraz określeniu na tej podstawie zawartości soli rozpuszczonych w wodzie.
Przyrządy i sprzęt
konduktometr
zlewka (100cm3)
tryskawka
Wykonanie oznaczenia
Wykonać pomiar przewodnictwa właściwego badanej próbki zgodnie z instrukcją przyrządu.
Obliczanie wyników
Obliczyć wynik korzystając z zależności:
C = 750 · κ , mg/dm3
gdzie: κ - przewodnictwo właściwe próbki, mS/cm
C - stężenie soli rozpuszczonych w wodzie, mg/dm3.
2.2. Oznaczanie wartości pH
Przyrządy, sprzęt i odczynniki
pH-metr
wzorce pH
zlewki
tryskawka
Wykonanie oznaczenia
Wykonać kalibrowanie pH-metru i pomiar pH badanej próbki zgodnie z instrukcją przyrządu.
2.3. Oznaczanie kwasowości mineralnej i węglanowej oraz zasadowości F i M
Zasada oznaczania
Oznaczanie polega na zobojętnieniu próbki wody roztworem 0,1 M NaOH lub 0,1 M HCl odpowiednio wobec metyloranżu (zasadowość M) i fenoloftaleiny (zasadowość F).
Sprzęt i odczynniki
kolba stożkowa (200-300 cm3)
cylinder miarowy (100 cm3)
dwie biurety (25-50 cm3)
0,1 M roztwór wodny NaOH
0,1 M roztwór wodny HCl
0,1% roztwór alkoholowy fenoloftaleiny
0,1% roztwór wodny metyloranżu
Wykonanie oznaczenia kwasowości mineralnej i węglanowej
Do kolby stożkowej odmierzyć 100 cm3 wody i dodać 3 krople metyloranżu. Jeżeli woda zabarwi się na kolor czerwony, to posiada ona kwasowość mineralną. W celu oznaczenia kwasowości mineralnej miareczkuje się przygotowaną próbkę 0,1 M roztworem NaOH do zmiany barwy czerwonej na pomarańczową. Natomiast jeżeli woda po dodaniu metyloranżu zabarwi się od razu na kolor żółty , wówczas nie posiada ona kwasowości mineralnej.
W celu oznaczenia kwasowości ogólnej należy odmierzyć 100 cm3 badanej wody do butelki lub kolbki z doszlifowanym szklanym lub gumowym korkiem i dodać ok. 3 krople roztworu fenoloftaleiny. Jeżeli woda nie zabarwi się na kolor różowy, należy miareczkować 0,1 M roztworem NaOH do pojawienia się lekko różowego zabarwienia, utrzymującego się nie krócej niż 3 minuty.
Obliczanie wyników kwasowości mineralnej i węglanowej
Wyniki oznaczeń kwasowości mineralnej i ogólnej (K) oblicza się ze wzoru:
![]()
, mVal/dm3,
gdzie: a - objętość 0,1 M roztworu NaOH, zużyta do miareczkowania, cm3,
V - objętość próbki, cm3.
Wyniki oznaczania kwasowości węglanowej oblicza się odejmując kwasowość mineralną od kwasowości ogólnej.
Wykonanie oznaczenia zasadowości F i M
Do kolby stożkowej odmierzyć 100 cm3 wody i dodać 4 krople roztworu fenoloftaleiny. Jeżeli woda zabarwi się na różowo lub czerwono, to posiada ona zasadowość F. W celu jej oznaczenia należy przygotowaną próbkę zmiareczkować 0,1 M HCl do zaniku różowego zabarwienia. Jeżeli woda po dodaniu fenoloftaleiny nie barwi się na kolor różowy, to nie posiada zasadowości F.
W celu oznaczenia zasadowości M należy dodać do próbki, w której oznaczono zasadowość F,
3 krople metyloranżu i miareczkować 0,1 M HCl do zmiany barwy z żółtej na pomarańczową. Jeżeli próbka wody po dodaniu metyloranżu zabarwia się od razu na kolor pomarańczowy lub czerwony, to woda nie posiada zasadowości M.
Obliczanie wyników zasadowości F i M
Zasadowość F i M oblicza się ze wzoru:
![]()
, mVal/dm3,
gdzie: a - objętość 0,1 M roztworu HCl, zużytego do zmiareczkowania próbki wody wobec
fenoloftaleiny, cm3,
b - suma objętości 0,1 M roztworu HCl, zużytego do zmiareczkowania próbki wobec
fenoloftaleiny oraz wobec metyloranżu, cm3,
V - objętość próbki wody, cm3.
2. 4. Oznaczanie wolnego CO2
Zasada oznaczania
Oznaczanie polega na zobojętnieniu próbki wody roztworem wodorotlenku sodowego wobec fenoloftaleiny.
Sprzęt i odczynniki - jak w punkcie 6.3.
Wykonanie oznaczenia - jak w oznaczaniu 6.3.
Obliczanie wyników
Zawartość wolnego CO2 podaje się w mg/dm3. Korzysta się z otrzymanej uprzednio wartości kwasowości węglanowej (Kwęglan.), a wynik oznaczania wolnego CO2 (XCO2) oblicza się ze wzoru:
XCO2 = Kwęglan.⋅ 44 , mg/dm3.
2.5. Oznaczanie wapnia i magnezu oraz twardości ogólnej w wodzie
Zasada oznaczania
Oznaczenia polegają na zmiareczkowaniu składników zawartych w próbce wody o odpowiednio skorygowanej wcześniej wartości pH, za pomocą wersenianu sodowego wobec odpowiednich wskaźników.
Sprzęt i odczynniki
kolbki stożkowe (200-300 cm3)
cylinder miarowy (100 cm3)
cylinder miarowy (10 cm3)
biureta (25-50 cm3)
pipeta szklana (5 cm3)
roztwór wodny wersenianu sodowego 0,05 M
roztwór HCl 0,1M
roztwór NaOH 2,5 M
kwas solny (1:1)
roztwór NH3 25%
czerń ET roztarta z NaCl w stosunku 1:100
mureksyd roztarty z NaCl w stosunku 1:100
Wykonanie oznaczenia wapnia
Do 100 cm3 badanej wody dodać taką ilość 0,1 M roztworu HCl, jaką zużyto przy oznaczaniu zasadowości F, dodać szczyptę mureksydu i po dokładnym wymieszaniu dodać 2 cm3 2,5 M NaOH,
a następnie miareczkować roztworem wersenianu do zmiany barwy różowej na fioletową. Ilość zużytego roztworu wersenianu odpowiada zawartości jonów wapnia w wodzie.
Wyniki
Stężenie jonów wapnia w wodzie (X1) oblicza się wg wzoru:
![]()
, mg/dm3,
gdzie: a - ilość cm3 wersenianu zużytego do miareczkowania
V - objętość próbki wody, cm3.
Wykonanie oznaczenia magnezu
Po oznaczeniu zawartości jonów wapnia do tej samej próbki wody dodać 7 cm3 kwasu solnego 1:1
i dokładnie wymieszać. Próbka wody powinna ulec odbarwieniu. Następnie dodać 7 cm3 stężonego amoniaku (odmierzyć cylindrem miarowym na 10 cm3) oraz szczyptę czerni ET i miareczkować roztworem wersenianu do zmiany barwy fioletowej na niebieską. Zużycie roztworu wersenianu odpowiada tu zawartości jonów magnezu w wodzie.
Wyniki Stężenie jonów magnezu w wodzie(X2) oblicza się wg wzoru:
![]()
, mg/dm3,
gdzie: a - ilość cm3 roztworu wersenianu zużytego do miareczkowania
V - objętość próbki wody, cm3.
Wykonanie oznaczenia twardości ogólnej
Do 100 cm3 badanej wody dodać 3 krople metyloranżu, taką objętość 0,1 M roztworu HCl, jaką zużyto przy oznaczaniu zasadowości M, 1 cm3 roztworu amoniaku oraz szczyptę wskaźnika czerni ET
i natychmiast miareczkować roztworem wersenianu sodowego do zmiany barwy z czerwonej na zieloną.
Wyniki
Wartość twardości ogólnej (Twog) oblicza się wg wzoru:
![]()
, °twardości,
gdzie: a -ilość cm3 zużytego wersenianu sodowego
V - objętość próbki wody, cm3.
3. Część obliczeniowa ćwiczeń
W tej części ćwiczeń należy wykonać obliczenia ilości chemikaliów niezbędnych do uzdatnienia
1 m3 wody do celów chłodniczych wybranymi metodami. Do tych obliczeń należy wykorzystać wyniki analiz składu wody, uzyskane w części analitycznej. Woda stosowana do celów chłodniczych nie powinna zawierać większej ilości zawiesin, drobnoustrojów i składników powodujących wytrącanie się osadów na powierzchniach grzewczych. Nie powinna wykazywać także właściwości korozyjnych w stosunku do materiałów konstrukcyjnych instalacji, czyli m.in. nie powinna zawierać wolnych kwasów. Woda ta powinna wykazywać tzw. stabilność i termostabilność.
Stabilność wody charakteryzuje indeks stabilności I:
![]()
gdzie pHo i pHw są to odpowiednio wartości pH wody bez dodatków i wody po wytrząsaniu z węglanem wapniowym, zmierzone w tej samej temperaturze. Jeżeli:
I = 1 woda jest stabilna
I > 1 z wody może wytrącić się CaCO3
I < 1 w wodzie może się rozpuszczać CaCO3, czyli jest agresywna (korozyjna).
Termostabilność wody ocenia się badając, czy wydziela się z niej CaCO3 przy zmianach temperatury w zakresie 293-313 K.
Wody niestabilne i korozyjne , a także nietermostabilne, przed użyciem do celów chłodniczych wymagają uzdatnienia, czyli usunięcia czynników korozyjnych i obniżenia twardości węglanowej. Obniżenie twardości węglanowej wody można uzyskać w wyniku:
tzw. szczepienia wody kwasem
dekarbonizacji wody wapnem.
Szczepienie wody kwasem powoduje zamianę twardości węglanowej na niewęglanową i polega na dodawaniu do wody mocnego kwasu mineralnego. Zachodzą wówczas reakcje:
nCa(HCO3)2 + 2HnX = CanX2 + 2nCO2↑ + 2nH2O (1)
nMg(HCO3)2 + 2HnX = MgnX2 + 2nCO2↑ + 2nH2O (2)
Potrzebną ilość kwasu wyliczamy z oznaczonej wcześniej twardości węglanowej oraz twardości węglanowej, którą chcemy uzyskać. Aby uniknąć przedawkowania kwasu pozostawia się w wodzie szczątkową twardość węglanową rzędu 0,7 mval/dm3.
Dekarbonizacja wody wapnem polega na wytrąceniu CaCO3 przy użyciu Ca(OH)2. Zachodzą wówczas reakcje:
CO2 + Ca(OH)2 = CaCO3↓ + H2O (3)
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3↓ + 2H2O (4)
Metodę tę stosuje się do dekarbonizacji wód o dużej twardości wapniowej i małej twardości magnezowej.
Związki magnezu zawarte w wodzie ulegają wtedy przemianom:
Mg(HCO3)2 + 2Ca(OH)2 = Mg(OH)2↓ + 2CaCO3↓ + 2H2O (5)
MgSO4 + Ca(OH)2 = Mg(OH)2↓ + CaSO4 (6)
MgCl2 + Ca(OH)2 = Mg(OH)2↓ + CaCl2, (7)
co oznacza, że twardość spowodowana obecnością wodorowęglanu magnezowego zostaje z wody usunięta, a twardość magnezowa spowodowana obecnością chlorku i siarczanu magnezowego zostaje zastąpiona twardością wapniową niewęglanową.
Podczas procesu dekarbonizacji następuje obniżenie twardości wody. Po tym procesie woda posiada tylko twardość wapniową, niewęglanową. Ten rodzaj twardości można usunąć przy użyciu sody. Zachodzą wówczas reakcje:
CaSO4 + Na2CO3 = CaCO3↓ + Na2SO4 (8)
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl (9)
Wykorzystując wyniki analiz próbki wody należy obliczyć:
dawkę kwasu solnego o stężeniu 35% wagowych, niezbędną do przemiany twardości węglanowej na twardość niewęglanową dla 1 m3 wody surowej,
dawkę wapna hydratyzowanego o zawartości 70% wagowych CaO, niezbędną do dekarbonizacji 1 m3 wody,
dawkę sody o zawartości 97% Na2CO3, niezbędną do usunięcia pozostałej po dekarbonizacji, twardości wody.
4. Wyjaśnienia do części obliczeniowej ćwiczeń
1. Obniżenie twardości węglanowej podczas szczepienia wody kwasem
Twardość węglanową [mVal/dm3] określa oznaczona w trakcie ćwiczeń zasadowość M (p. 2.3.), przy czym:
[mVal/dm3] = [miligramorównoważnik/dm3],
[mVal/dm3] = [Val/m3] = [gramorównoważnik/m3],
[gramorównoważnik] = [mol/wartościowość jonu].
Z równań (1) i (2) wynika, że na 1 mol jonów HCO3- potrzeba 1 mol HCl. Wartościowość obydwu reagentów jest równa 1, więc w tym przypadku 1 gramorównoważnik = 1 mol.
Aby wyliczyć masę HCl , potrzebną do obniżenia twardości węglanowej wody surowej (pamiętając o pozostawieniu twardości szczątkowej), należy więc zasadowość M [mol/m3] pomnożyć przez masę cząsteczkową HCl. Uzyskany wynik należy przeliczyć na dawkę 35% HCl.
2. Dekarbonizacja wody
a. Na podstawie zawartości wolnego CO2 w wodzie, obliczyć zapotrzebowanie Ca(OH)2 w reakcji (3).
b1. Na podstawie oznaczonej zasadowości M [mVal/dm3] obliczyć zawartość jonów HCO3- w wodzie
[mg/dm3].
b2. Na podstawie oznaczonej zawartości jonów Ca2+ obliczyć, ile jonów HCO3- powinno się
znajdować w wodzie, gdyby cały wapń był związany w postaci Ca(HCO3)2.
Jeśli wartość w p. b2. > od watości w p. b1., to oznacza, że część wapnia jest związana w postaci innych soli (chlorki, siarczany).
c. Znając zawartość w wodzie wapnia, obliczyć ile jonów Ca2+ jest związanych w postaci Ca(HCO3)2,
a ile w postaci innych soli.
d. Obliczyć zapotrzebowanie Ca(OH)2 w reakcji (4). Jeżeli jonów HCO3- brakuje dla oznaczonego
w wodzie wapnia, to oznacza, że magnez jest związany w postaci innych niż wodorowęglany soli
(chlorki, siarczany).
e. Obliczyć zapotrzebowanie Ca(OH)2 w reakcji (6) lub (7).
Suma z punktów a + d + e = całkowite zapotrzebowanie Ca(OH)2.
Biorąc pod uwagę, że czysty Ca(OH)2 zawiera (56/74)·100 = 75,68% CaO
{Mcz CaO = 56, Mcz Ca(OH)2 =74}, przeliczyć uzyskany wynik na dawkę wapna hydratyzowanego, zawierającego 70% CaO. [mg/dm3] = [g/m3].
3. Usuwanie twardości wapniowej niewęglanowej wody za pomocą sody.
Twardość tę powodują obecne w wodzie inne niż wodorowęglany związki wapnia. Pojawia się ona również w wyniku reakcji, innych niż wodorowęglany, związków magnezu z wapnem (CaOH)2 - reakcje (6) i(7).
Obliczyć zapotrzebowanie Na2CO3, wynikające z zawartości w wodzie wapnia, związanego w postaci innych soli, niż wodorowęglany (pkt 2.c) - reakcje (8) lub (9).
Obliczyć zapotrzebowanie Na2CO3 na podstawie zawartości oznaczonego w wodzie magnezu {reakcje (6) i (8) lub (7) i (9)}.
Suma dla punktów 3.a. + 3.b. = całkowite zapotrzebowanie Na2CO3. Uzyskany wynik należy przeliczyć na dawkę sody zawierającej 97% Na2CO3.
WZÓR SPRAWOZDANIA
Nazwisko i imię ...........................
Nr próbki wody ............................
I Wyniki części laboratoryjnej
Nr oznaczenia |
Rodzaj oznaczenia |
jednostki |
Wynik oznaczenia |
1. 2. 3. ... ... ... |
|
|
|
II Wyniki części obliczeniowej
Dawka 35% HCl, niezbędnego do przemiany twardości węglanowej w niewęglanową,
dla 1 m3 wody............Dawka wapna hydratyzowanego o zawartości 70% CaO, niezbędna do dekarbonizacji 1m3 wody........
Dawka sody o zawartości 97% Na2CO3, niezbędna do usunięcia twardości wody, pozostałej po procesie dekarbonizacji........
2
Związany w postaci CO32- ditlenek węgla
Półzwiązany w postaci HCO3- ditlenek węgla
Przynależny
ditlenek węgla
Agresywny ditlenek węgla
Związany ditlenek węgla
Wolny ditlenek
węgla
Ogólny ditlenek węgla
Wyszukiwarka
Podobne podstrony:
,Technologia chemiczna – surowce i procesy przemysłu nieorganicznego S,Czystsze technologie chemiczn
Hoffmann, Technologia chemiczna surowce i procesy przemysłu nieorganicznego S, pigmenty nieorganicz
Hoffmann, Technologia chemiczne surowce i procesy przemysłu nieorganicznego, notatki z wykładu (2)
Hoffmann, Technologia chemiczna surowce i procesy przemysłu nieorganicznegoprzemysł siarkowyx
Hoffmann, Technologia chemiczna surowce i procesy przemysłu nieorganicznegoprzemysł fosforowyx
Hoffmann, Technologia chemiczna surowce i procesy przemysłu nieorganicznegowoda dla?lów przemysłowy
Hoffmann, Technologia chemiczna surowce i procesy przemysłu nieorganicznegoprzemysł azotowyx
Hoffmann, Technologia chemiczna surowce i procesy przemysłu nieorganicznego S, METALURGIA MIEDZI (1
Hoffman,Technologia chemiczna surowce i procesy przemysłu nieorganicznego, opracowanie zagadnieńx
Hoffmann, Technologia chemiczna surowce i procesy przemysłu nieorganicznegoprzemysł sodowyx
Hoffmann, Technologia chemiczna surowce i procesy przemysłu nieorganicznego S, Odpylanie gazów prze
Hoffmann, Technologia chemiczna surowce i procesy przemysłu nieorganicznegoprzemysł solny
Metody absorpcyjne NOx instr, Technologia chemiczna - surowce i procesy przemysłu nieorganicznego
,Technologia chemiczna – surowce i procesy przemysłu nieorganicznego S,Odnawialne źródła energiix
hoffmann, Technologia chemiczn surowce i procesy przemysłu nieorganicznego, egzamin 10 pytania
Hoffmann, Technologia chemiczna surowce i procesy przemysłu nieorganicznegoochrona środowiska w tech
hoffmann, Technologia chemiczna – surowce i procesy przemysłu nieorganicznego L,OTRZYMYWANIE PRODUKT
Hoffmann, Technologia chemiczna surowce i procesy przemysłu nieorganicznego S, Chemiczne metody oczy
Hoffmann, Technologia chemiczna surowce i procesy przemysłu nieorganicznegobiologiczne metody oczysz
więcej podobnych podstron