KINETYKA - ZADANIA Z PRZYKŁADAMI ROZWIĄZAŃ
1. Obliczyć ile razy wzrośnie stała szybkości reakcji w wyniku ogrzania układu reagującego od temperatury 0°C do temp. 100°C, jeżeli energia aktywacji reakcji jest równa: a) 50 kJ/mol oraz b) 200 kJ/mol.
a)
T1= 0oC=273K
T2= 100oC=373K
E=50 kJ/mol=50*103J/mol
R= 8,31 J/mol*K
Korzystając ze wzoru:
![]()
wyliczamy:
![]()
stąd:
![]()
Przykład b) rozwiązujemy analogicznie.
Odp. a) 368,7 b) 1,85*1010
2. Ile razy zwiększy się stała szybkości reakcji spełniającej regułę van't Hoffa w wyniku ogrzania układu o 100°C, jeżeli temperaturowy współczynnik reakcji jest równy: a) 2, b) 4?
Odp. a) 1024 b) 1048576
3. Badając wpływ temperatury na szybkość rozkładu pewnego środka znieczulającego stwierdzono, że stała szybkości rozkładu tego anestetyka ma wartość 8.6 · 10-4 h-1 w temp. 363 K i 21.9 · 10-4 h-1 w temp. 373 K. Znaleźć wartość współczynnika temperaturowego Q10 dla tego procesu.
Odp. Q= 2,55
4. Pewna reakcja w temp. 298 K przebiega do końca w czasie 100 min. Obliczyć, w jakiej temp. ta sama reakcja przebiegnie do końca w ciągu 20 min. Współczynnik temperaturowy reakcji Q10 =3.
T1 =298K
t1 =100min
t2 =20min
Regułę van't Hoffa na zależność szybkości reakcji od temperatury można zapisać w postaci:
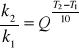
po zlogarytmowaniu:
![]()
czyli 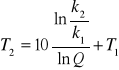
Biorąc pod uwagę, ze dla tej samej reakcji w różnych temperaturach szybkości reakcji są proporcjonalne do ich stałych szybkości, stała k2 jest 5 razy większą od stałej k1, podstawiając do wzoru mamy:
![]()
T2= 312,6K
Odp. T2 = 312,6K
5. Stała szybkości rozkładu N2O5
N2O4 + ½ O2 w temp. 273 K wynosi 4.72 · 10-5 min-1. Znaleźć okres półtrwania dla tej reakcji oraz ilość N2O5 jaka zostanie rozłożona po 20 godzinach. Reakcja jest I rzędu.
k = 4.72 · 10-5 min-1=7.86*10-7 s-1
T=273 K
T=20h=72000s
T1/2=![]()
![]()
stąd ![]()
![]()
![]()
skoro co stanowi początkowe stężenie substancji a więc 100%, aktualne stężenie substratu wynosi c = ![]()
i stanowi x%
co - 100%
![]()
_ x%
x= 94,5%
Czyli przereagowało 100%-94,5%= 5,48%
Odp. T1/2- 8,8 *105 s ; 5,48%
6. Podczas reakcji hydrolizy 17% roztworu sacharozy w obecności HCl o stężeniu 0.01 mol/l w temp. 308 K otrzymano następujące wyniki:
Czas, min |
9,83 59,6 93,2 143 295 589 |
Niezhydrolizowana sacharoza w % |
96,5 80,3 71,0 59,1 32,8 11,1 |
Oblicz stałą szybkości reakcji.
Odp. k = 6,34 * 10-5 s-1
7. Badano szybkość przemiany pewnej substancji A w roztworze. Po 600 s przereagowała połowa początkowej ilości tej substancji. Oblicz, jaka część substancji A pozostanie niezmieniona po 900 s, jeżeli reakcja jest: a) I rzędu, b) II rzędu.
a)
skoro po 600s przereagowała połowa początkowej ilości to T1/2=600s
k=![]()
=1,155*10-3s-1
Znając stałą szybkości reakcji możemy obliczyć ile substancji przereagowało po t=900s
k=![]()
![]()
→ ![]()
stąd: ![]()
c= 0,354co
czyli po 900s pozostanie 35.46% początkowej ilości substancji.
b)
Korzystając ze wzoru na stałą szybkości reakcji II rzędu:
k=![]()
oraz z przekształcenia wzoru na okres półtrwania:
T1/2=![]()
→ k=![]()
Otrzymujemy układ równań:
k=![]()
k=![]()
po rozwiązaniu którego otrzymujemy c=0,4co,
czyli po 900s pozostanie 40% początkowej ilości substancji .
Odp. a) 35,46% b) 40%
8. Gdyby początkowe stężenie substancji A wynosiło 1.0 mol/l, to w przypadku reakcji I rzędu po 900 s stężenie tej substancji zmniejszyłoby się do 0.353 mol/l. Oblicz czas po upływie którego szybkość reakcji I rzędu A
B zmaleje do połowy w porównaniu z szybkością początkową; k=2· 10-3 s-1.
Odp. t= 3,47 * 102 s
9. Stała szybkości reakcji II rzędu rozkładu aldehydu octowego w fazie gazowej wzrasta od 0,105 mol-1s-1 w temp. 759 K do 0,343 mol-1s-1 w temp. 791 K. Oblicz Ea tej reakcji oraz przypuszczalną stałą szybkości w temp. 836 K.
k1=0,105 mol-1s-1
T1=759 K
k2=0,343 mol-1s-1
T2=791 K
Korzystając z równania:
![]()
wyliczamy E:
![]()
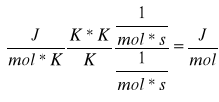
E= 1,845*105 J/mol
Przypuszczalna stałą szybkości k3 w temperaturze T3= 836 K obliczamy korzystając z tego samego wzoru, co powyżej, rozwiązując układ równań:
![]()
![]()
stąd k3= 1,55 mol-1s-1
Odp. E= 1,845*105 J/mol ; k3=1,55 mol-1s-1
10. Zakładając, że cząsteczka A reaguje jednostopniowo z dwoma cząsteczkami B tworząc AB2 oblicz czemu równa się stała szybkości tej reakcji jeżeli początkowa szybkość powstawania AB2 wynosi 2,0· 10-5 mol l-1s-1 oraz początkowe stężenie A i B wynoszą 0,3 mol/l.
Odp. k= 7,41*10-4 l2mol-2s-1
11. Wiadomo, że penicylina G (benzylopenicylina) jest nietrwała w środowisku kwaśnym, ponieważ ulega hydrolizie. Niemniej jednak matka życzy sobie, aby tabletki penicyliny G rozkruszyć i podać dziecku w soku pomarańczowym. Oblicz jaki ułamek dawki otrzyma dziecko, jeżeli proces przygotowywania roztworu trwa 2 minuty, a τ1/2 dla procesu hydrolizy (reakcja I rzędu) ma wartość 3,5 min.
t= 2min=120s
T 1/2=3,5 min= 210s
Proces hydrolizy jest procesem I rzędu a wiec:
![]()
stąd wyliczamy k= 3,3*10-3mol-1s-1
Korzystając z wzoru:
![]()
wyliczamy:
![]()
c=0,673co
Czyli dziecko otrzyma ułamek równy 0,673 początkowej dawki leku.
Odp. x = 0,673
12. Rozwiązać ten sam problem (zad.11) dla sytuacji, w której tabletki rozpuszczono o godz. 8:00, a lek podawano przez cały dzień. Ile penicyliny było w tym roztworze o godz. 18:00?
Odp. x=2,54*10-52
13. Jeden z sulfonamidów traci swoje właściwości terapeutyczne, gdy zawartość substancji czynnej zmaleje o 30 %. Początkowe stężenie badanej próbki tego leku było równe 5 mg/l, a po upływie 20 miesięcy zmalało o 4,2 mg/l. Obliczyć czas dopuszczalnego przechowywania tego leku wiedząc, że proces rozkładu jest procesem I rzędu.
Odp. t=41 miesięcy
14. Rozkład związku A jest procesem I rzędu, którego Ea = 52,3 kJ/mol. W temp. 283 K 10% roztwór tego związku ulega rozkładowi w 10% w ciągu 10 min. W jakim stopniu (w ilu procentach) ulega rozkładowi 20% roztwór tego związku w temp. 293 K.
Odp. 20 %
Szybkość tworzenia NO w reakcji:
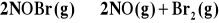
, wynosi 1,6*10-5mol/l*s. Jaka jest szybkość zaniku NOBr i szybkość reakcji powst.Br2?
Odp. d[NOBr]/dt= 1,6*10-5mol/l*s d[Br2]/dt=8*10-6 mol/l*s
Szybkość zużywania rodników CH3* w reakcji tworzenia etanu zgodnie z równaniem reakcji 2CH3*(g)= CH3CH3 w pewnych warunkach wynosi 2,4 mol/dm3s. Jaka jest w tych warunkach szybkość tworzenia etanu?
Odp. d[CH3CH3]/dt= 1,2 mol/l*s
17. Reakcję aminokwasu tyrozyny (Tyr) z jodem opisuje równanie kinetyczne: V=k[J2][Tyr]. Jaki jest rząd reakcji ze względu na aminokwas, jod oraz całkowitą rzędowość reakcji.
Ile razy zwiększy się stała szybkości reakcji spełniającej regułę van't Hoffa w wyniku ogrzania układu o 100 K, jeżeli współczynnik temperaturowy jest równy 2 i 4.
Q=2
ΔT=100oK
Regułę van't Hoffa na zależność szybkości reakcji od temperatury można zapisać w postaci:
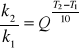
po zlogarytmowaniu otrzymujemy:
![]()
stąd:
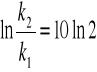
![]()
Przykład b) analogicznie.
Odp. a) 1024 b) 1048576
19. Pewna reakcja przebiega w temperaturze 300 K w ciągu 100 min. W jakiej temperaturze ta sama reakcja przebiegnie w ciągu 10 min, współczynnik temperaturowy dla tej reakcji wynosi 3.
Odp T2 = 320,96 K
Stała szybkość rozkładu pewnej substancji w temperaturze 370K wynosi 8*10-4min-1, natomiast w temperaturze 390K wynosi 30,3*10-4min-1. Jaka jest energia aktywacji i współczynnik temperaturowy tej reakcji.
Odp. E= 7,98*104 J/mol ; Q=1,94
Badając utlenienie etanolu katalizowane dehydrogenazą alkoholową, stwierdzono, że jest to reakcja pierwszego rzędu i że stężenie alkoholu maleje z 220 mmol/dm3 do 56 mmol/dm3 po 1,22*104 s. Wyznacz stałą szybkości reakcji.
Odp. k = 1,12*10-4 s-1
W kwaśnym roztworze wodnym sacharoza rozkłada się na: glukozę i fruktozę w reakcji pseudopierwszego rzędu. W pewnych warunkach (pH i temperatura) czas połowicznego zaniku wynosi 30 min. Ile czasu potrzeba, aby stężenie sacharozy w roztworze zmalało z 10 mmol/l do 1 mmol/l?
Odp. t = 5,98*103 s
Substancja A reaguje dając w dwóch równoległych reakcjach o stałych szybkości k1 i k2 dwa produkty B i C. Stosunek stężeń tych produktów w mieszaninie poreakcyjnej wynosi w temperaturze 300K cB/cC=2, a w temperaturze 350K cB/cC=6. Jaka jest różnica energii aktywacji obu reakcji?
Skoro mamy do czynienia z reakcjami równoległymi to produkty będą powstawać z
szybkością proporcjonalną do stałych szybkości. A wiec
T1=300K
T2=350K
![]()
=2
![]()
=6
![]()
![]()
ΔE= EB-EC= 2,303R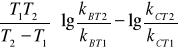
Pamiętając, że
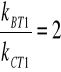
![]()
ΔE= EB-EC= 2,303R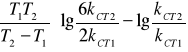
![]()
∆E=19167,32 J/mol
Odp. ΔE = 19167,32 J/mol
25. Stała szybkości I rzędowej reakcji konwersji cyklopropanu do cyklopropenu w temp. 400 0C wynosi 1.16 · 10-6 s-1 a początkowe stęż. substratu wynosi 1.00· 10-2 mol/l. Jakie będzie stężenie tej substancji po 24 godzinach?
Odp. 9,045*10-3 mol/l
Wyszukiwarka
Podobne podstrony:
4184
4184
4184
4184
4184
4184
4184
więcej podobnych podstron