Enzymatyka cd.
(Wykład 13)
Regulacja aktywności specyficznej enzymu, aktywności molowej:
Aktywność molowa - ilość substratu jaką jest on w stanie przerobić w czasie 1s, zależy od rodzaju enzymu. Może ona podlegać pewnej regulacji. Wyróżniamy dwa mechanizmy regulacji aktywności enzymu:
Regulacja sprawności katalitycznej enzymu poprzez modyfikacje kowalencyjne.
Regulacja allosferyczna.
Modyfikacje kowalencyjne:
Enzym może występować w formie aktywnej, nisko aktywnej a czasem nieaktywnej.
Np.:
Forma nieaktywna - podstawowa forma enzymu, w której centrum aktywne nie jest przystosowane do przyjęcia substratu.
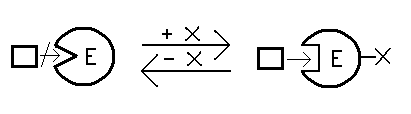
Forma aktywna - enzym zostaje zmodyfikowany poprzez przyłączenie jakiejś grupy chemicznej do którejś z reszt aminokwasowych, następuje zmiana konformacji enzymu, w wyniku tego centrum aktywne przybiera taki kształt, że może akceptować substrat. Wiązanie kowalencyjne
Forma nieaktywna Forma aktywna
Znamy również przypadki odwrotne, gdzie modyfikacja chemiczna prowadzi do powstania formy nieaktywnej:
Forma aktywna - forma podstawowa enzymu, substrat może wiązać się bez przeszkód z miejscem katalitycznym.
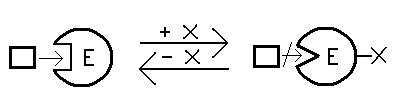
Forma nieaktywna - enzym zostaje zmodyfikowany, następuje przyłączenie jakiejś grupy chemicznej do któregoś aminokwasu w łańcuchu polipeptydowym tego enzymu, enzym zmienia konformację, w wyniku tego miejsce aktywne pasuje do substratu.
Forma aktywna Forma nieaktywna
Z punktu widzenia regulacyjnego wartość mają modyfikacje odwracalne - grupa chemiczna modyfikująca związek może być przyłączana i odłączana.
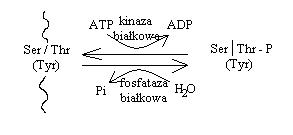
Najbardziej pospolitym typem takich reakcji jest: FOSFORYLACJA i DEFOSFORYLACJA.Pewne reszty aminokwasowe (aminokwasów hydroksylowych takich jak: Ser, Thr, czasem Tyr) podlegają, przy udziale
specjalnych enzymów zwanych kinazami białkowymi, fosforylacji z udziałem ATP jako źródła reszt kw. ortofosforowego. Następuje fosforylacja grupy estrowej - powstaje wiązanie estrowe pomiędzy resztą fosforową pochodzącą z ATP a grupą hydroksylową aminokwasu.
Jest to typowy przykład modyfikacji odwracalnej - proces defosforylacji może zachodzić dzięki fosfatazą białkowym (zazwyczaj specyficznym wobec konkretnych enzymów).
Znamy wiele enzymów regulowanych poprzez fosforylację i defosforylacji.
Enzymy aktywowane przez fosforylację:
fosforylaza glikogenowa - uczestniczy w wew. kom. rozpadzie glikogenu (odłącza reszty glukozy w postaci reszt glukozo-1-fodforanu).
niektóre lipazy.
wiele kinaz białkowych - tzw. kinazy II rzędu.
Enzymy inaktywowane przez fosforylację:
syntaza glikogenowa - uczestniczy w jednym z ostatnich etapów biosyntezy glikogenu (fosforylacja prowadzi do zahamowania aktywności syntazy i aktywacji fosforylazy).
karboksylaza acetylo-CoA - enzym występujący na szlaku biosyntezy kw. tłuszczowych, katalizuje przekształcenie acetylo-CoA w wyniku karboksylacja do malonylo-CoA (ważna reakcja na szlaku biosyntezy kw. tłuszczowych).
kinaza pirogronianowa - jeden z enzymów szlaku glikolitycznego.
Reakcje fosforylacji katalizuje duża rodzina enzymów zwanych kinazami białkowymi (kinazami białek).
Nomenklatura enzymów: podajemy typ enzymu a następnie w formie przymiotnikowej substrat lub produkt np.: dehydrogenaza mleczanowa.
W genomie ludzkim jest nieco ponad 100 genów kodujących różne kinazy białkowe. Są one klasyfikowane według tego co je aktywuje.
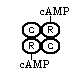
KLASYFIKACJA KINAZ BIAŁKOWYCH:Aktywowane przez cAMP (kinazy A, PKA)
są to tetramery zbudowane z dwóch podjednostek regulacyjnych i dwóch katalitycznych - taka forma jest formą nieaktywną.
jeśli cAMP zostanie przyłączony do podjednostek regulatorowych (wiązanie niekowalencyjne) to następuje dysocjacja takiego kompleksu, w wyniku tego uwalniane są aktywne już jednostki katalityczne.
Aktywowane przez cGMP (kinazy G, PKG)
aktywowane przez analog cAMP -> cGMP (cykliczny guanozynomonofosforan)
Aktywowane przez Ca
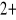
- kalmodulinę.aktywowane przez jony wapnia, a właściwie przez kompleks jonów wapnia z białkiem zwanym kalmoduliną.
Aktywowane przez diacyloglicerol (kinazy C, PKC)
Są bardzo ważne w transdukcji sygnałów przez błony.
REGULACJA POZIOMU GLIKOGENU W KOMÓRKACH (przykład regulacji przez fosforylację i defosforylację)
P pirofosforylaza UDP syntaza
glukoza glikozydowa glikogenowa
![]()
![]()
Glc-1-P UDP-Glc glikogen
glukoneogeneza UTP PPi UDP
fosforylaza
glukoza glikogenowa
np.: w kom. wątroby glikoliza Pi
szlak pentozofosforanowy Glc-1-P
Substratem wyjściowym do produkcji glikogenu jest Glc-1-P. Może on powstać w wyniku fosforylacji glukozy lub w procesie glukoneogenezy. W wyniku działania enzymu, pirofosforylazy UDP-glukozowej i przy udziale UTP przekształca się on w UDP-glukozę (nukleotydo cukier) - jest ona przenośnikiem reszt glukozy służącym do biosyntezy glikogenu. Syntaza glikogenowa wykorzystuje reszty glukozy z
UDP-glukozy do wydłużania łańcuchów cukrowych w cząsteczkach glikogenu (żeby powstała dojrzała cząsteczka glikogenu musi zadziałać enzym Q, który wprowadza rozgałęzienia do cząsteczki).
Podczas degradacji glikogenu w komórce główną rolę odgrywa fosforylaza glikogenowa: do wiązania glikozydowego na nieredukującym końcu cząsteczki glikogenu przyłącza resztę kw. ortofosforowego, w wyniku czego terminalna reszta glukozy jest odłączana w postaci Glc-1-P, który może wchodzić w szlak glikolityczny lub pentozofosforanowy, może również przekształcić się w glukozę.
Syntaza glikogenowa oraz fosforylaza glikogenowa są głównymi enzymami biorącymi udział w regulacji poziomu glikogenu w kom.
Syntaza glikogenowa - może występować w dwóch formach:
„I” - nieufosforylowana, aktywna katalitycznie.
„D” - ufosforylowana, w normalnych fizjologicznych warunkach -> nieaktywna (wymaga bardzo dużego stężenia glukozy).
Fosforylaza glikogenowa - również występuje w dwóch formach, co do aktywności sytuacja odwrotna:
„b” - nieufosforylowana, nieaktywna.
„a” - ufosforylowana, aktywna.
Regulacja poziomu glikogenu w komórce odbywa się za pośrednictwem substancji hormonalnych, a szczególną rolę pełnią dwa hormony:
adrenalina - wydzielana przez rdzeń nadnerczy w warunkach stresowych pod wpływem bodźców nerwowych. Pochodna aminokwasowa.
glukagon - peptyd, produkowany przez komórki α trzustki w odpowiedzi na głód (obniżenie poziomu glukozy we krwi).
adrenalina (stres) glukagon (głód)
receptory błonowe
aktywacja cyklazy adenylanowej
ATP cAMP
aktywacja kinazy białkowej typu A(PKA)
ATP ATP
ADP
kinaza fosforylazy ADP
ATP
syntaza „I” syntaza-P
ADP „D”(nieaktywna)
fosforylaza fosforylaza-P
„b” „a”(aktywna) fosfataza
+
fosfataza insulina
Oba te hormony są w stanie wiązać się z białkami receptorowymi (inne dla adrenaliny i glukagonu) w błonach komórkowych komórek docelowych (np.: wątroby, mięśni gdzie przechowywany jest glikogen). Hormony te za względu na swoją hydrofilność nie są w stanie spenetrować błon komórkowych. Dzięki przyłączeniu hormonu do receptora błonowego następuje zmiana konformacji tego białka receptorowego co powoduje aktywację enzymu - cyklazy adenylanowej występującej po wew. stronie błony kom. Cyklaza adenylanowa katalizuje reakcję przekształcenia ATP w cAMP (odszczepienie PPi oraz cyklizacja). Wzrasta poziom cAMP w komórce, który aktywuję kinazę białkową typu A (aktywacja w wyniku dysocjacji kompleksu nieaktywnego).
Zaktywowana kinaza białkowa typu A(kinaza białkowa I. rzędu) jest w stanie katalizować fosforylację kinazy fosforylazy glikogenowej (typowa kinaza II. rzędu). Kinaza fosforylazy może fosforylować bezpośrednio enzym docelowy - fosforylazę glikogenową (forma nieufosforylowana, nieaktywna -> forma ufosforylowana, aktywna).
Proces odwrotny katalizowany jest przez specjalną fosfatazę białkową, która jest w stanie odszczepić reszty fosforanowe; jest ona regulowana w inny sposób.
Z drugiej strony aktywacja PKA prowadzi do tego, że syntaza glikogenowa może ulegać fosforylacji przy udziale tej kinazy (nieufosforylowana, aktywna forma syntazy „I” -> forma „D” nieaktywna, ufosforylowana).
Zarówno adrenalina jak i glukagon wywołują tą samą kaskadę wydarzeń, w wyniku której dochodzi do ufosforylowania fosforylazy glikogenowej (jej aktywacji) i ufosforylowania syntazy glikogenowej (jej inaktywacji). Prowadzi to do hamowania syntezy glikogenu i aktywowania jego rozpadu.
Proces defosforylacji syntazy glikogenowej jest aktywowany przez inny hormon - insulinę (hormon polipeptydowy wytwarzany przez komórki β trzustki), która również działa za pomocą kaskady kinaz białkowych.
Insulina jest antagonistą glukagonu i adrenaliny.
Fosforylacja i defosforylacja są najbardziej rozpowszechnionymi formami modyfikacji kowalencyjnych białek, które prowadzą do zmiany ich aktywności.
ADENYLACJA - inny typ modyfikacji kowalencyjnej (istotny w przypadku bakteryjnego enzymu syntazy glutaminowej - przekształca kw. glutaminowy, glutaminian w jego amid - glutaminę przy udziale ATP jako źródła energii)
Z cząsteczki ATP na reszty tyrozyny (jej grupy -OH) przy udziale odpowiedniego enzymu przenoszona jest reszta AMP, tak że reszta fosforanowa z AMP tworzy wiązanie estrowe z grupą -OH tyrozyny:
Tyr-OH + ATP Tyr-O-AMP +PPi
ADP-RYBOLYZACJA - inny przykład dość często spotykanej modyfikacji, która prowadzi do zmiany aktywności enzymu.
Regulacja bakteryjnej polimerazy RNA - ważny enzym uczestniczący w biosyntezie cząsteczek RNA.
Znamy kilka typów rybozylacji, ale w tym przypadku chodzi o następujący przebieg: na grupę aminową występującą w łańcuchu bocznym argininy zostają przeniesione reszty ADP-rybozy z cząsteczki NAD, w wyniku tego z NAD uwalnia się amid kwasu nikotynowego. Budowa NAD:
Arg-NH2 + NAD+ Arg-NH-ADP-ryboza + amid kwasu nikotynowego
MOSTKI DISIARCZKOWE (wytwarzanie lub ich rozpad) - kolejny rodzaj modyfikacji kowalencyjnych.
Niektóre enzymy są aktywne w formie zredukowanej - kiedy występują cysteiny z wolnymi grupami -SH, a inne enzymy mają aktywną formę gdy pomiędzy resztami cysteiny powstają mostki disiarczkowe.
Mostki mogą być wewnątrzłańcuchowe lub międzyłańcuchowe.
Potrzebny jest jakiś utleniacz lub reduktor żeby reakcja mogła zajść w przeciwnym kierunku.
Od potencjału red-ox zależy w jakiej formie (zredukowanej czy utlenionej) będą występowały enzymy.
Częściej forma aktywną jest forma zredukowana
utleniacz
![]()
Cys-SH Cys-S
![]()
Cys-SH Cys-S
reduktor
PALMITOILACJA BIAŁEK - odwracalna modyfikacja kowalencyjna, mająca wpływ na aktywność enzymów; przyłączenie reszt kwasu palmitynowego do reszt cysteiny za pomocą wiązania tioestrowego (umożliwia to wiązanie się białka z błona).
REGULACJA ALLOSTERYCZNA:
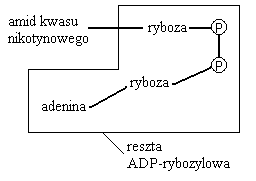
Modyfikacja białka enzymatycznego o charakterze NIE kowalencyjnym ale w wyniku oddziaływania z drobną cząsteczką.
Enzym obok centrum aktywnego posiada miejsce allosteryczne, do którego może przyłączać się efektor allosteryczny, powodujący zmniejszenie lub zwiększenie aktywności enzymu.efektorem jest ściśle określony związek powodujący zmianę konformacyjną w obrębie cząsteczki enzymu: centrum aktywne przestaje lub zaczyna pasować do substratu.
Efektor negatywny = ujemny: ograniczona możliwość wytworzenia kompleksu enzym - substrat, ograniczenie możliwości zachodzenia reakcji.
Zasadnicza różnica między zjawiskiem allosterii a zjawiskiem modyfikacji kowalencyjnych polega na tym, że w przypadku modyfikacji allosterycznych mamy do czynienia z sytuacją kiedy drobna cząsteczka przyłącza się niekowalencyjne do enzymu, ale mamy odzielne miejsce dla aktywatora i inhibitora. (?)
Efektorami allosterycznymi mogą być różne związki:
cAMP (bardzo często) - w przypadku kinaz białkowych typu A -> cAMP przyłącza się do podjednostek regulatorowych w wyniku czego następuje uwolnienie jednostek, które stają się aktywne katalitycznie.
cGMP, AMP, ADP, ATP, PPi:
równowagę między tymi związkami opisuje pojęcie ładunku energetycznego
komórki: ładunek jest wysoki jeżeli jest dużo ATP a mało ADP, AMP i PPi; niski jest za to gdy mamy mało ATP oraz dużo ADP, AMP i PPi (produktów rozpadu ATP).
regulacja allosteryczna za pomocą przyłączania tego typu związków jest reakcją na sytuację energetyczną w komórce. Enzymy aktywowane przez ATP to zazwyczaj enzymy związane ze szlakami biosyntezy, a aktywowane przez przyłączenie AMP, ADP czy PPi to enzymy zwykle uczestniczące w procesach katabolicznych.
często efektorami allosterycznymi mogą być substraty lub produkty danego szlaku enzymatycznego.
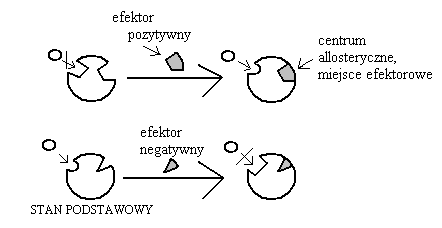
ENZYMY HOMOTROPOWE: szczególny przypadek allosterii.
Są to enzymy dla których efektor allosteryczny jest tym samym czym ich substrat naturalny (substrat = efektor).
Charakteryzują się zazwyczaj budową podjednostkową, np.: mogą być tetra-metryczne, każda z podjednostek zawiera miejsce do przyłączenia efektora allosterycznego i miejsce katalityczne; często może być taka sytuacja, że miejsce allosterycznego jest tożsame z miejscem katalitycznym.Przyłączenie substratu do jednej z podjednostek powoduje wzrost powinowactwa miejsc allosterycznych w pozostałych podjednostkach.
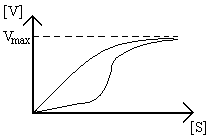
Charakteryzują się nietypową kinetyką działania - typowym wykresem zależności aktywności enzymatycznej (wykres Michaelisa- Menton), określającym zależności między stężeniem substratu a szybkością reakcji jest hiperbola.W zakresie niskich stężeń mamy do czynienia z wprost proporcjonalnością szybkości reakcji w zależności od stężenia substratu; z chwilą gdy większa część cząsteczek enzymu jest wysycona substratem mamy do czynienia z sytuacją gdy szybkość reakcji prawie się nie zmienia wraz ze wzrostem stężenia substratu.
W przypadku homotropowych enzymów allosterycznych, dla których efektorem allosterycznym jest ich własny substrat, kinetyki mają charakter signoidalny - w bardzo niskich stężeniach substratu praktycznie reakcja nie zachodzi, dopiero od pewnego miejsca nagle wzrasta szybkość reakcji enzymatycznej, aby potem doszło do wysycenia enzymu i „zagięcia” wykresu.
Sensem tych enzymów jest by nie dopuścić aby enzym działał gdy jest mało substratu - jest to istotne gdyż czasem ten sam substrat służy kilku szlakom metabolicznym, które o niego konkurują; ten mechanizm pozwala kontrolować, który szlak w danym momencie ma być uruchomiony.
Zjawisko homotropowości nie jest powszechne, dotyczy tylko niektórych enzymów allosterycznych.
Modyfikacje kowalencyjne oraz allosteryczne dotyczą różnych białek, a nie tylko białek enzymatycznych.
W przypadku allosterii często jako model białka allosterycznego przedstawia się hemoglobinę
Cztery podjednostki, każda ma hem wiążący tlen - przyłączenie tlenu do jednej z podjednostek powoduje wzrost powinowactwa pozostałych podjednostek do tlenu. Tam gdzie jest wysokie stężenie tlenu (płuca) - tlen przyłącza się bardzo łatwo (przyłączenie lawinowe), a w tkankach obwodowych, gdzie stężenie tlenu jest niskie oddysocjonowuje on od pierwszej podjednostki co lawinowo powoduje wzrost zdolności do odłączania tlenu przez pozostałe podjednostki (spadek powinowactwa podjednostek do tlenu).
Przykłady zjawiska allosterii:
REGULACJA BIOSYNTEZY KWASÓW TŁUSZCZOWYCH:
liaza karboksylaza
cytrynianowa acetylo-CoA
cytrynian acetylo-CoA malonylo-CoA palmitoilo-CoA
efektory pozytywne: cytrynian i ATP
efektory negatywne: długo-łańcuchowe acylo-CoA
Enzymem kluczowym jest karboksylaza acetylo-CoA. Jest to enzym, który przekształca acetylo-CoA w wyniku jego karboksylacja w malonylo-CoA, ponieważ dopiero malonylo-CoA jest substratem do syntezy długo-łańcuchowych kwasów tłuszczowych.
U eukariontów głównym źródłem acylo-CoA dla tej reakcji są mitochondria, a sam ten proces zachodzi na terenie cytoplazmy; dlatego też acetylo-CoA musi być wytransportowany z mitochondrium na teren cytoplazmy. Odbywa się to dzięki przekształceniu acetylo-CoA i szczawiooctanu w cytrynian, który posiada własny przenośnik w błonie mitochondrialnej - może migrować na teren cytoplazmy gdzie znajduje się enzym (liaza cytrynianowa), który jest odpowiedzialny za rozpad cytrynianu na acetylo-CoA i szczawiooctan (przy udziale ATP jako źródła energii). Szczawiooctan po odpowiednich przekształceniach wraca do mitochondrium.
Acetylo-CoA jest wykorzystywany jako substrat dla karboksylazy acetylo-CoA. Enzym ten jest regulowany nie tylko allosteryczne.
Pozytywnymi efektorami, aktywatorami allosterycznymi są:
Cytrynian - jest na terenie cytoplazmy prekursorem całego tego szlaku, jego pojawienie uaktywnia syntezę kwasów tłuszczowych; wąskie gardło katalizowane przez karboksylazę acetylo-CoA zostaje uaktywnione.
ATP - jego wysoki poziom świadczy o tym, iż komórka ma zaspokojone potrzeby metaboliczne i powinna zająć się biosyntezą związków zapasowych a nie katabolizmem. ATP jest jednocześnie efektorem i substratem w reakcji karboksylazy acetylo-CoA.
Negatywnym efektorem są długo-łańcuchowe acylo-CoA np.: palmityno-CoA. Nagromadzenie się tych związków świadczy o ich słabym, z jakiegoś powodu, dalszym wykorzystaniu np.: do syntezy strukturalnych czy zapasowych lipidów. Skoro brak jest wykorzystania nie ma sensu ich dalej syntetyzować - ujemne sprzężenie zwrotne.
(niestety nie zdążyłam przepisać wykłady do końca przed pierwszym terminem egzaminu, zapewne zrobię to przed drugim terminem)
- 1 -
Max
Wyszukiwarka
Podobne podstrony:
5401
5401
987650 5401
5401
5401
5401
5401
5401
więcej podobnych podstron