SATLA BARTOSZ |
Ćwiczenie nr C4 Temat: Wyznaczanie ciepła metodą Clementa -Desormesa |
||
FIZYKA I ROK |
Ocena z kolokwium |
Ocena ze sprawozdania |
Ocena końcowa |
|
|
|
|
Dr E. Jakubczyk
|
|
|
|
CZĘŚĆ TEORETYCZNA
Równanie stanu gazu doskonałego.
Gazem doskonałym nazywamy tylko gaz:
składający się z poruszających się chaotycznie cząsteczek o bardzo małych rozmiarach (mają one cechy punktów materialnych)
cząsteczki te oddziałują ze sobą podczas zderzeń sprężystych (oddziaływanie na odległość można zaniechać)
Stan gazu jest określany przez podanie jego trzech parametrów: temperatury T, objętości V, i ciśnienia p, pod jakim gaz się znajduje. Tych trzech wielkości nie można zmieniać w sposób dowolny, jeżeli masa gazu pozostaje bez zmian. Są one związane ze sobą tzw. równaniem gazu doskonałego.
Dla gazu doskonałego równanie stanu gazu, tj. zależność miedzy ciśnieniem, objetością i temperaturą ma postać:
![]()
Wzór ten wynika z trzech doświadczalnie znalezionych praw: prawa Boyle'a Mariotte'a, prawa Gay -Lussaca i ptawa Charlsa.
Z równania stanu gazu doskonałego wynika, że dla stałej masy gazu parametry jego stanu mogą się zmieniać, jednak iloczyn ciśnienia i objętości podzielony przez temperaturę musi mieć stałą wartości (czyli zmiana któregokolwiek z parametrów musi spowodować zmianę pozostałych wielkości tak aby wyrażenie nie zmieniało wartości).
PRZEMIANY GAZOWE
Jeżeli ulegają zmianie przynajmniej dwa z trzech parametrów opisujące stan termodynamiczny określonej masy gazu, to mówimy że gaz ten podlega przemianie termodynamicznej. Szczególnym przypadkiem przemian gazowych są izoprzemiany (przemiana izotermiczna, izobaryczna, izochoryczna).
Przemiana izotermiczna T=const
Oprócz stałej masy gazu stała jest temperatura (T1=T2), zmienia się ciśnienie i objętość.
p1V1=p2V2
Prawo Boyle'a Mariotte'a
W stałej temperaturze ciśnienie danej masy gazu doskonałego jest odwrotnie proporcjonalne do jego objętości.
p
V
Krzywa (hiperbola) przedstawiającą zależność ciśnienia gazu od jego objętości w stałej temperaturze można nazywa się izotermą.
Podczas przemiany izotermicznej energia wewnętrzna gazu nie zmienia się. Z pierwszej zasady termodynamiki wynika, że przy izotermicznym sprężaniu siły zewnętrzne wykonują nad gazem pracę, natomiast gaz oddaje ciepło w ilości równej wykonanej nad nim pracy. W czasie izotermicznego rozprężenia gaz pobiera ciepło i wykonuje pracę o wartości równej pobieranemu ciepłu.
![]()
![]()
bo T=const.
Dla izotermicznego sprężania:0
O=W-Q więc ![]()
Dla izotermicznego rozprężania:
O=-W+Q więc ![]()
Przemiana izobaryczna p=const.
Oprócz stałej masy gazu, stałe jest ciśnienie (p1=p2), zmienia się temperatura i objętość.
![]()
Prawo Gay-Lussaca p = const.
Przy stałym ciśnieniu objętość danej masy gazu doskonałego jest wprost proporcjonalna do jego temperatury bezwzględnej, tzn.
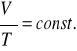
![]()
lub ![]()
![]()
objętość gazu w temp 00C
T
p1
p2<p1
V
Pół prosta przedstawiająca zależność gazu od temperatury w stałym ciśnieniu nazywa się izobarą. Podczas izobarycznego ogrzewania gaz pobiera ciepło i wykonuje pracę, przy czym wartość popranego ciepła jest większa od wartości wykonanej pracy wzrost temp czyli wzrost energii. wew.)
![]()
![]()
więc![]()
w czasie izobarycznego oziębiania gaz oddaje ciepło, a siły zewnątrzne wykonująnad nim pracę (sprężają go) przy czym wartość oddanego ciepła jest większa niż wartość wykonanej pracy.
![]()
![]()
![]()
![]()
więc![]()
Przemiana izochoryczna V=const.
Oprócz stałej masy gazu stała jest objętość (V1=V2), zmienia się temperatura i ciśnienie.
![]()
Prawo Charlesa
W stałej objętości ciśnienie danej masy gazu doskonałego jest wprost proporcjonalne do jego temperatury bezwzględnej tzn.:
![]()
![]()
lub ![]()
![]()
ciśnienie gazu w temp 273K
p V2<V1
V1
T
Półprosta przedstawiająca zależności ciśnienia gazu od temperatury w stałej objętości nazywa się izochor. W przemianie izochorycznej praca nie jest wykonywana (stała objętość), więc zmiana energii wew. odbywa się wyłącznie przez wymianę ciepła.
-izochoryczne ogrzewanie prowadzi do wzrostu energii wew.
![]()
-izochoryczne oziębienie obniża energię wew.
![]()
Przemiana adiabatyczna
Jest to taka przemiana podczas której nie następuje przemiana wymiana ciepła z otoczeniem a więc kiedy przemiana zachodzi bardzo szybko lub kiedy gaz jest odizolowany cieplnie od otoczenia.
![]()
, 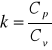
p
adiabata
Ciśnienie wzrasta szybciej w przemianie adiabatycznej niż w izotermicznej
izoterma
T
W przemianie adiabatycznej zmiana energii wewnętrznej odbywa się wyłącznie przez pracę
Q=const.
-dla adiabatycznego sprężania (energia wew. rośnie)
ΔEw=W
-dla adiabatycznego rozprężania (energia wew. maleje)
ΔEw=-W
Podstawowy wzór teorii kinetyczno molekularnej gazów.
Ciśnienie wywierane przez gaz na ścianki naczynia jest wprost proporcjonalne doliczby częsteczek w jednostce objętości i do ich średniej energii kinetycznej
![]()
![]()
lub ![]()
Ciepło molowe gazu.
Ciepłem mollowym substancji nazywamy ilość ciepła potrzebną do ogrzania 1 mola tej substancji o 1K
![]()
Ciepło molowe w przemianie izobarycznej (Cp) i izochorycznej (Ch)
Podczas ogrzewania gazu mogą ulegać zmianie wszystkie jego parametry, można go również ogrzewać przy stałej objętości (przemiana izochoryczna) lub pod stałym ciśnieniem (przemiana izobaryczna).
W każdym z tych przypadków 1 mol gazu ogrzewając o 1K pobierze określoną ilość energii.
Cp>Cv
Ciepło molowe w przemianie izobarycznej (Cp) jest większe niż w przemianie izochorycznej (Cv), ponieważ przy ogrzewaniu gazu w stałej objętości całe dostarczone ciepło zużywane jest wyłącznie na podniesienie jego temperatury, natomiast w stałym ciśnieniu część dostarczanego ciepła jest zużyta na wykonanie pracy czyli podniesienie tłoka w celu zachowania stałego ciśnienia i tylko część na podwyższenie temperatury. Dla gazu doskonałego zachodzi zależność:
Cp-Cv=R, R- stała gazowa (8,31![]()
)
2) CZEŚĆ DOŚWIADCZALNA
Lp. |
h1 [mm] |
h2 [mm] |
h1-h2 [mm] |
|
1. |
16,5 |
3,5 |
13 |
1,26 |
2. |
16 |
3,5 |
12,5 |
1,28 |
3. |
16,5 |
4 |
12,5 |
1,32 |
4. |
18 |
4,5 |
13,5 |
1,33 |
5. |
16 |
3 |
13 |
1,23 |
6. |
14 |
2,5 |
11,5 |
1,21 |
7. |
15 |
3 |
12 |
1,25 |
8. |
17 |
3,5 |
13,5 |
1,25 |
9. |
16 |
3 |
13 |
1,23 |
10. |
16 |
3,5 |
12,5 |
1,28 |
Obliczam średnią arytmetyczną ℵ:
![]()
![]()
(1,26+1,28+1,32+1,33+1,23+1,21+1,25+1,25+1,23+1,28)=1,271
Obliczam błąd pomiaru metodą Studenta Fishera
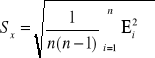
![]()
![]()
= 1,271-1,26=0,0011 ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
0,000121+0,000081+0,002401+0,003481+0,001681+0,003721+0,000441+0,000441
+0,001681+0,000081=0,01413
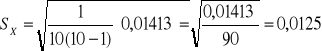
ℵ=1,271![]()
0,012 =[1,259:1,283]
Wnioski:
Ćwiczenie mające na celu wyznaczenie ℵmetodą Clemanta- Desormesa w pełni odzwierciedla zamierzony cel.
Błąd pomiaru ℵ=1,271+-0,012 nie jest duży a jego przyczyną mogą być złe odczytanie wyniku oraz niedokładne przyrządy.
1
Wyszukiwarka
Podobne podstrony:
C4, Studia, Pracownie, I pracownia
Badanie wahadła skrętnego, Studia, Pracownie, I pracownia, 7 Badanie drgań wahadła skrętnego {torsyj
ciurla,Podstawy Zarządzania II,Motywowanie pracowników
24 - oddane 21.04.2010, Studia, Pracownie, I pracownia, 24 Wyznaczenie mechanicznego równoważnika ci
Wstęp 59, Studia, Pracownie, I pracownia, 59 Rezonans elektromagnetyczny, Waldek
m5 NP, Studia, Pracownie, I pracownia
OSCYLOSK, Studia, Pracownie, I pracownia, 51 Pomiary oscyloskopowe, Ludwikowski
Wstęp teoretyczny 32, Studia, Pracownie, I pracownia
Sprawozdanie M7w, Studia, Pracownie, I pracownia
25, Studia, Pracownie, I pracownia, 25 Wyznaczanie współczynnika rozszerzalności cieplnej metali za
76, Studia, Pracownie, I pracownia, 76 Rozpady promieniotwórcze
teor 76, Studia, Pracownie, I pracownia
wnoiski 57, I rok, II semestr, pracownia fizyczna I
ZAGADN1, Studia, Pracownie, I pracownia, 1 Dokładność pomiaru długości, Marek
cw30, Studia, Pracownie, I pracownia, 30 Wyznaczanie względnej gęstości cieczy i ciał stałych, Ludwi
Sprawozdanie 49, Studia, Pracownie, I pracownia, 49 Charakterystyka tranzystora, Waldek
Wstęp teoretyczny 1, Studia, Pracownie, I pracownia
Instrukcja, Studia, Pracownie, I pracownia, 76 Rozpady promieniotwórcze
więcej podobnych podstron