Równowaga w roztworach elektrolitów.
Doświadczenie 1.
Badanie pH roztworów za pomocą wskaźników i uniwersalnych papierków wskaźnikowych.
Sprzęt i odczynniki:
-probówki
-wskaźniki:
-fenoloftaleina
-oranż metylowy
-czerwień metylowa
-błękit bromotymolowy
a)
Otrzymałem roztwór do zbadania jego pH. Roztwór rozlałem do 5 probówek. Do 4 probówek dodałem wskaźników, do 5-tej probówki wrzuciłem papierek uniwersalny. Na podstawie zabarwienia wskaźników mogłem w przybliżeniu określić pH roztworu.
Nr probówki |
Wskaźnik |
Barwa roztworu |
Wartość pH |
|||
1 |
fenoloftaleina |
bezbarwna |
pH< 8,0 |
|||
2 |
oranż metylowy |
żółta |
pH>4,4 |
|||
3 |
czerwień metylowa |
żółta |
pH>6,2 |
|||
4 |
błękit bromotymolowy |
Niebiesko - zielony |
pH <7,6 |
|||
5 |
papierek uniwersalny |
Pomarańczowo - żółty |
PH ok. 7 |
|||
b)
Próbkę roztworu z błękitem bromotymolowym porównałem ze wzorcem. Dla otrzymanego zabarwienia odpowiadała wartość pH wzorca równa 7,05
Doświadczenie 2.
Porównanie pH mocnego i słabego kwasu o tym samym stężeniu.
Sprzęt i odczynniki:
-zlewki
-pehametr
-kwas octowy 0,1 molowy
-kwas solny 0,1 molowy
Za pomocą pehametru zbadałem pH kwasu solnego, a następnie octowego. Otrzymałem następujące wyniki pomiarów:
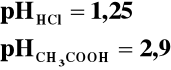
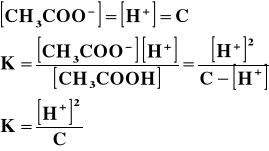
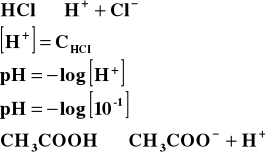
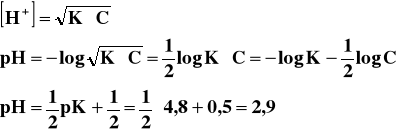
Jak widać oba te kwasy, pomimo że mają takie same stężenia, to ich pH jest różne. Jest to spowodowane tym, iż kwas solny, jest mocnym kwasem, jest prawie całkowicie zdysocjowany i jego pH policzone ze wzoru jest przybliżone do rzeczywistego pH, liczonego dla takiego stężenia. Kwas octowy jest słabym kwasem, dysocjuje częściowo, dostarcza więc do roztworu mniej kationów wodorowych niż kwas solny o tym samym stężeniu, więc jego pH jest wyższe.
Licząc pH słabego kwasu, uwzględniamy we wzorze jego stałą dysocjacji.
Doświadczenie 3
Porównanie właściwości buforowych wody destylowanej i wodociągowej.
Sprzęt i odczynniki:
-zlewki
-bagietki
0,01M HCl
0,01M NaOH
Celem doświadczenia jest porównanie właściwości buforowych wody wodociągowej i destylowanej.
Do dwóch zlewek odmierzyłem po 200cm3 wody destylowanej, a do następnych dwóch po 200cm3 wody wodociągowej.
Zmierzyłem pH za pomocą pehametru we wszystkich zlewkach. Następnie do jednej zlewki z wodą destylowaną i do jednej z wodą wodociągową dodałem po 5cm3 0,01 molowego HCl, a do dwóch pozostałych zlewek po 5cm3 0,01 molowej NaOH.
Wymieszałem roztwory bagietką i zmierzyłem pH. Wyniki zestawiłem w tabeli:
woda |
pH |
pH po dolaniu kwasu |
pH po dolaniu zasady |
ΔpH |
β |
destyl. |
5,36 |
3,39 |
________ |
1,97 |
0,001269 |
destyl. |
5,34 |
________ |
7,40 |
2,06 |
0,0012135 |
wodoc. |
7,13 |
5,80 |
________ |
1,33 |
0,0018796 |
wodoc. |
7,14 |
________ |
7,23 |
0,09 |
0,0277777 |
β=Δn/ΔpH
1dm3 - 0,1 mol
0,005dm3 - x mol
x=0,0005 mola
do badania użyliśmy po 0,2 dm3 wody, a wiec na 1dm3 buforu przypada Δn=5x moli dodanego kwasu lub zasady
Δn=0,0025 mola
β1=0,0025/1,97=0,001269
β2=0,0025/2,06=0,0012135
β3=0,0025/1,33=0,0018796
β4=0,0025/0,09=0,0277777
Zauważamy że woda wodociągowa ma większą pojemność buforową niż woda destylowana. Jest to spowodowane tym że woda wodociągowa zawiera bufor węglanowy w postaci układu HCO3- i H2CO3. Dodanie jonów H+ powoduje że zachodzi reakcja
HCO3- + H+ H2CO3
A dodanie jonów OH- powoduje że zachodzi reakcja
H2CO3 + OH- HCO3- + H2O
Woda destylowana nie zawiera tych związków dlatego też dodatek niewielkiej ilości kwasu lub zasady zmienia pH w większym stopniu niż w przypadku wody wodociągowej.
Doświadczenie 4
Badanie wpływu składu roztworu buforowego na jego pojemność buforową.
Sprzęt i odczynniki:
-zlewki
-cylindry miernicze
-pipety z podziałką
-bagietka szklana
-0,1M kwas octowy
-0,1 kwas roztwór octanu sodowego
Celem doświadczenia jest zbadanie wpływu składu roztworu buforowego na jego pojemność buforową.
W 6 zlewkach przygotowałem roztwory buforowe z 0,1M kwasu octowego i 0,1M roztworu octanu sodowego. Roztwory dokładnie wymieszałem i zmierzyłem pH za pomocą pehametru. Następnie do każdej zlewki dodałem po 5cm3 0,1 molowego HCl i po wymieszaniu ponownie zmierzyłem pH. Wyniki zestawiłem w tabeli.
Nr zlewki |
Ck/Cz |
VCH3COOH [cm3] |
VCH3COONa |
pH |
pH po dod HCl |
Δn HCl |
ΔpH |
β |
1 |
0,25 |
8,0 |
32,0 |
5,06 |
5,01 |
0,0125 |
0,05 |
0,25 |
2 |
0,5 |
13,3 |
26,7 |
4,68 |
4,64 |
------- |
0,04 |
0,3125 |
3 |
1 |
20,0 |
20,0 |
4,32 |
4,29 |
------- |
0,03 |
0,416 |
4 |
2 |
26,7 |
13,3 |
3,95 |
3,91 |
------- |
0,04 |
0,3125 |
5 |
3 |
30,0 |
10,0 |
3,74 |
3,69 |
------- |
0,05 |
0,25 |
6 |
4 |
32,0 |
8,0 |
3,59 |
3,54 |
------- |
0,05 |
0,25 |
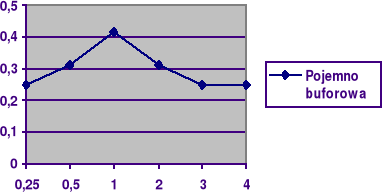
Zauważamy, że największą pojemność buforową ma bufor w którym stężenie kwasu równa się stężeniu soli, ponieważ pk=pH. Wynika to z równania na pH buforu: pH=pK -log(Ck/Cs), Ck/Cs=1 to -log1=O. Sporządzamy wykres zależności:
β=f(Ck/Cs).
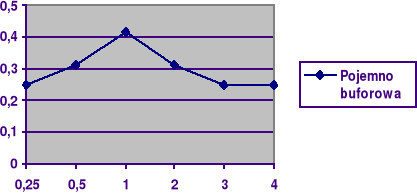
![]()
F(Ck/Cs)
Doświadczenie 5
Badanie wpływu sumarycznego stężenia składników buforu na jego pojemność buforową.
Sprzęt i odczynniki:
-zlewki
-pipeta Mohra
-pipety z podziałką
-bagietka szklana
-kwas octowy 0,1M
-octan sodu 0,1M
-0,1M kwas solny
-woda destylowana
Celem doświadczenia jest zbadanie wpływu sumarycznego stężenia składników buforu na jego pojemność buforową.
Sporządziłem roztwory buforowe o różnych stężeniach sumarycznych i zbadałem ich pH za pomocą pehametru, następnie do dałem do każdego po 5cm3 0,1M HCl i ponownie zbadałem pH. Wykonałem obliczenia i wyniki zestawiłem w tabeli.
Nr zlewki |
Ck+Cs [mol/dm3] |
VCH3COOH [cm3] |
VCH3COONa [cm3] |
VH20 [cm3] |
pH |
pH po dod HCl |
Δn HCl |
pH |
β |
1 |
0,025 |
10 |
10 |
60 |
4,45 |
4,01 |
0,0625 |
0,44 |
0,14 |
2 |
0,050 |
20 |
20 |
40 |
4,44 |
4,20 |
------ |
0,24 |
0,26 |
3 |
0,075 |
30 |
30 |
20 |
4,45 |
4,30 |
------ |
0,15 |
0,42 |
4 |
0,100 |
40 |
40 |
0 |
4,43 |
4,33 |
------ |
0,10 |
0,63 |
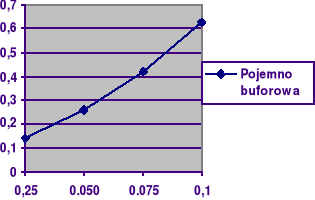
Im wyższe jest stężenie sumaryczne składników buforu, tym większą pojemność posiada taki bufor. Spowodowane jest to tym że dany bufor posiada więcej jonów CH3COO- z którymi reagują jony H+ pochodzące z dodanego kwasu solnego.
Sporządzam wykres zależności: β=f(Ck + Cs)
![]()
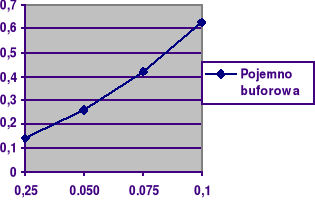
F(Ck+Cs)
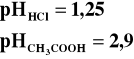
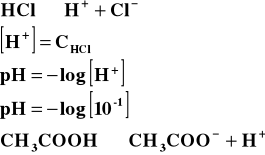
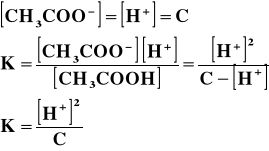
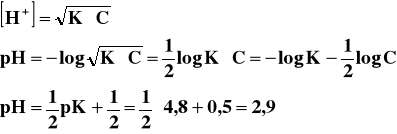
![]()
![]()
Wyszukiwarka
Podobne podstrony:
Chemia spraw.3(3), Studia, Chemia, chemia od Ines(1)
Chemia spraw.4, studia
Chemia spraw.13, Studia, Chemia, chemia7
Chemia spraw. 12, Studia, Chemia, chemia7
Zestaw nr 6, Studia, chemia
Zestaw 7, Studia, chemia
tos2-2013d, Studia, chemia egzaminy
wapno, Budownictwo-studia, chemia
2 kationy, Studia, Chemia, chemia7
Reakcje jądrowe-podstawowe pojęcia, Studia, chemia jądrowa
chf wykład 6, Studia, Chemia, fizyczna, wykłady
ćw7 - Refrakcja i wyznaczanie momentu dipolowego, studia, chemia fizyczna
I Pracownia - zakres materiału, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA ORGANICZN
KOLOS kwasy tłuszcze 5, STUDIA, Chemia
nieorgany-pytania2, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA labora
pytania z examinu, Studia, Chemia, ogólna, examin
więcej podobnych podstron