M E C H A N I Z M Y G A Ś N I C Z E
1. Oddziaływanie fizyczne na płomień polega na : •••Energetyczne •ochładzaniu strefy reakcji •chłodzenie paliwa
Przestrzenne •rozcieńczaniu reagentów w strefie reakcji - odsuwaniu od siebie cząsteczek •izolowanie paliwa i utleniacza •odłączenie strefy spalania ••Chemiczne •blokowanie wolnych rodników przez cząsteczki środków gaśniczych (przechwytyw) •katalizowanie rekombinacja •zmniejszenie energii wolnych rodników (efekt trzeciej cząsteczki) •oddziaływanie jonów chlorowców(halony) Działanie fizyczne polega na obniż. temp. płomienia poniżej temp. krytycznej i ustaniu procesu spalania. Działanie chemiczne powoduje podwyższenie minimalnej temp. apropagacji płomienia powyżej temp. adiabatycznej.
W O D A
2. Par.fiz wody wpływaj korzystnie i niekorzystnie na jej skutecz gaśn ••• KORZYSTNE: •duża odległość podawania •bardzo duża wydajność podawania •znaczna eneria kinetyczna - przenikanie i penetrowanie •działanie dynamiczne - rozbicie słabych elem. •nietoksyczność •możliwość działania punktowego. ••NIEKORZYSTNE: •krótki kontakt z materiałem •spływanie •zbyt szybkie odparowanie •niezwilżanie mat hydrofobowych •niska temp krzepnięcia •korozja •gaszenie urządz elektr •piroliza wody w wysokich temperat (wydzielenie wodoru) • opory przepływu - straty na wydajności, zasięgu
3. W jakich przypadkach gaszenie wodą może być nieskuteczne ? Gaszenie materiałów dydrofobowych
•zbyt krótki kontakt, spływanie •szybkie parowanie •niezwilżanie (brak możliwości penetracji) Gaszenie cieczy •brak możliwości izolowania (tonięcie wody w cieczy lżejszej) •słabe chłodzenie powierzchni (ciecz pali się powierzch.) Gaszenie gazów •brak możliwości chłodzenia paliwa Pożary metali •reakcja chemiczna zwiększająca zagrożenie.
4. W jakich przypadkach gaszenie wodą może zwiększyć zagrożenie? •Obecność w zasięgu pożaru substancji reagujących z wodą:• z wydz. palnych gazów •wydz. egzoterniczne • gazów toksycznych •W przypadku pożarów zbiorników naftowych gromadzenie się wody na dnie zbiorników, co po osiągnięciu przez ciecz temp. wyższej od wrzenia wody może spowod wybuch fizycz. •Gaszenie instal elektr. pod napięciem.
5. Najważniejsze przyczyny możliwej nieskuteczności gaszenia wodą pożarów grup A i B Pożary grupy A ••nieskuteczność gaszenia wodą z powodu: •krótkiego kontaktu z materiałem •spływanie •zbyt szybkie parowanie •niezwilżenie materiałów hydrofobowych. Pożary grupy B •brak możliwości izolowania (tonięcie wody w cieczach lżejszych) •słabe chłodzenie powierzchni (spalanie cieczy odbywa się powierzchniowo)
6. Trzy podstawowe sposoby zwiększenia skuteczności gaśniczej wody Sposoby podnąszące skuteczność gaśniczą
wody: •poprawa zwilżalności obniżenie nap. powierz. wody - stosowanie ZPC •poprawa właśc izolujących - stosow. śr. pian.
7. Najważniejsze środki stosowane jako dodatki do wody do celów gaśniczych •••ZPC: obniżają napięcie powierzchniowe Jonowe •anionowo czynne (alkanosulfoniany, alkilosiarczany itp.) •kationowo czynne (sole aminowe amin alifatycznych, sole zasad cyklicznych) •amfolityczne (sulfobetainy, karboksybetainy) Niejonowe (oksyetylowane alkohole, oksyetylowane alkilofenole) ••Śr. pian. (proteinowe, fluoroproteinowe, syntetyczne, fluorosyntetyczne, alkoholoodporne) •••Związki obniżaj temp. krzpenięcia wody (dodatki soli NaCl, a także glikolu propylenowego, gliceryny) •••Śr. obniżające prężność pary wodnej (zmniejszanie szybkości odparowania wody) •••Śr. zagęszczające - zwiększenie lepkości wody ••Śr. zmniejszające opory przepływu - tlenek etylenu - uporządkow. ruchu cząsteczek wody.
8. Od czego zależy zdolność wnikania cieczy w materiały porowate ? Warunkiem, aby mogło nastąpić wnikanie cieczy w materiał porowaty jest zwilżanie tego materiału przez ciecz cos θ > 0. Natomiast wnikanie cieczy w materiał porowaty zależy od: •••wytworzonego ciśnienia kapilarnego, którego wartość zależy od: •napięcia powierzchniowego cieczy •promienia kapilary •••przeciwdziałającego mu ciśnienia hydrostatycznego uzależnionego od: •gęstości cieczy •wysokości słupa wchodzącej cieczy •••parametrów fizycznych materiału poro-watego: •porowatości •powierz właściwej •przepuszczalności.
ZWIĄZKI POWIERZNIOWO-CZYNNE /ZPC/
9. Ze względu na ich zachowanie w wodzie możemy sklasyfikować ZPC na : ••jonowe ••niejonowe. Jonowe ZPC dysocjują w wodzie i w zależności od tego, które jony mają aktywność powierzchniową, nazywa się je:
a). anionowo czynne (grupa hydrofobowa występuje w anionie); najważniejsze klasy tej grupy to: •alkanosulfoniany o wzorze ogólnym R CH2 SO3 •alkilobenzenosulfoniany R C6H4 SO3 •alkilosiarczany R CH2 OSO3 •definosulfoniany R CH2 CH = CH CH2 SO3 b).kationowo czynne (grupa hydrofobowe występuje w kationie) najważniejsze z nich to: •sole amonowe amin alifatycznych •sole zasad cyklicznych c).amfolityczne, których charakter jest zależny od pH środowiska - w kwasowych są kationowo czynne, zaś w zasadowych anionowo czynne. Ważniejsze związki w tej grupie to pochodne betainowe: •sulfobetainy •karboksybetainy.
Związki, które rozpuszczając się w wodzie nie tworząc jonów nazywane są niejonowymi.
10. Izoterma adsorpcji powierzchniowej ZPC Gibbsa.
•Γ-stężenie powierzchniowe •c-stężenie roztworu •Γ= - (c/RT) (dδ/dc), •dc-zmiana stężenia •dσ-zmiana napięcia powierzchniowego •R-uniwersalna stała gazowa •T-temperatura.
Teoretyczny przebieg zależności nadmiaru powierzchniow. od stężenia przedst wykres.
W przypadku rozpuszczenia określonej substancji w cieczy cząsteczki substancji mogą przechodzić w głąb lub gromadzić się na powierzchni rozdziału faz powodując zmiany napięcia powierzchniowego. Gdy dδ/dc < 0 to substancję naz powie-rzchniowo czynną jeżeli ≤ 0 -naz powierzchn nieczynną. Stężenia przy których osiąga się minimalne napięcie powie-rzchniowe zależą: długości łańcucha alkilowego i zmniejszają się ze wzrostem łańcucha
11. Krytyczne stężenie micelarne ZPC w roztworach
Krytyczne stężenie micelarne (KSM) - jest to takie stężenie ZPC przy którym stężenie powierzchniowe już nie przyrasta. KSM zależy od: •temperatury - w niskich może nie zostać w ogóle osiągnięte •długości łańcucha węglowodorowego dla danego rodzaju ZPC - maleje ze wzrostem długości łańcucha węglowo-dorowego •zawartości elektrolitów w wodzie •rodzaju ZPC
P I A N A
12.Zjawiska powodujące nietrwałość pian
Niestabilność pian wyraża się przez trzy zjawiska: •wyciekaniu cieczy (synereza) spowodowane jest wyciekaniem roztworu przez kanały Plateau pod wpływem grawitacji: (∂p/∂n) + ρ . g = 0 •dyfuzyjny transport gazu - ciśnienie w pęcherzykach jest odwrotnie proporcjonalne do promienia pęcherzyka, w wyniku czego powstaje różnica ciśnień pomiędzy większym pęcherzykiem i mniejszym Δp. = 2 σ (1/r1 - 1/r2). - pod wpływem tej różnicy następuje dyfuzja gazu z mniejszych pęcherzyków do większych. W wyniku czego następuje zanik mniejszych pęche-rzyków •pękanie pęcherzyków - błona po uzyskaniu określonej krytycznej wartości pęka. Pękanie zachodzi na skutek tworzenia się w pęcherzyku otworu o krytycznym rozmiarze. • wzrost wielkości pęcherzyków Mechanizm rozrywania grubych błonek: •stopniowe zmniejszenie grubości błonki •skokowe pojawienie się fragmentów o grubości mniejszej niż pozostała •powstanie w błonie otworu rozszerzając się z dużą szybkością.
13. Zjawiska podtrzymujące stabilność pian
Efekt Marangoniego cienkie błonki są zdolne do reagowania na lokalne zmiany swojej grubości → pozwala to na "wzmocnienie" osłabionego fragmentu; •• przyczyna: przepływ cieczy z obszarów o niskich napięciach powierzchniowych do obszarów o wyższych napięciach powierzchniowych, jeżeli przy zmniejszaniu grubości błonki następuje zwiększanie napięcia powierzchniowego spowodowane lokalnym zmniejszeniem stężenia; ••inna droga samoodtwarzania błonki w wyniku migracji cząsteczek ZPC z wnętrza fazy ciekłej do warstwy powierzchniowej (nie prowadzi to jednak do zmniejszenia grubości błonki - bo liczba cząstek w ciekłej części błonki jest niewystarczająca); ••szybkość odbudowy fragm. o zmniejszonej grubości tym wyższa im większa aktywność powierzchniowa ZPC i im wyższa różnica stężeń w normalnej i zmienionej błonce; oraz im więcej objętości cieczy przylegającej do warstwy powierzchn. → tym efekt maleje
Efekt Gibbsa - wpływ lokalnych różnic napięcia powierzchniowego spowodowanych mechanicznymi lub termicznymi zakłóceniami powodującymi rozciąganie błonki; ••nap. powierz. rozciągniętej części błonki wzrasta, jeżeli wzrost powierzchni powoduje zmniejszenie stężenia ZPC w warstwie powierzchniowej → różnica napięć powierzchniowych powoduje powstanie strumienia cząsteczek ZPC w kierunku niższych stężeń - do rozciągniętej części błonki; ••błonka jest elastyczna - przy rozciąganiu zwiększa się napięcie powierzchniowe, ujawnia się sprężystość prowadząca do ściągnięcia błonki E = 2 S (dδ/dS) E-sprężystość błonki jeżeli E>0 to błonka odporna na dowolne lokalne zakłócenia
14. Strukturalno-mechaniczne czynniki stabilności •jeżeli warstwa adsorpcyjna ma małą trwałość - stabilność pęcherzyka jest największa dla niewielkich stężeń ZPC •przy podwyższaniu trwałości warstwy adsorpcyjnej - max. stabilność przesuwa się w stronę większych stężeń •stabilność błonek i pian zmienia się w miarę starzenia roztworów → zachodzą reakcje chemiczne •w bardzo stabilnych pianach rozrywanie błonek nie zachodzi w pierwszych 10÷20 minutach
15. Sposoby zwiększania stabilności pian •dodanie do roztworów ZPC niewielkich ilości stabilizatora np. alkoholu tłuszczowego lub rozpuszcz. w wodzie polimer. → następuje wzrost lepkości warstwy adsorpcyjnej i błonki - nadmiar stabilizatora obniża zdolność pianotwórczą •dodanie do roztworu niejonowych ZPC → stabilizuje pianę w wyniku przenikania ich do warstw adsorpcyjnych --ze wzrostem stężenia ZPC stabilność pian zwiększa się osiągając max. dla krytycznego stężenia mi-celi a potem obniża się (dla pian niestabilizowanych) •wprowadzenie elektrolitu podwyższa stabilność (przy warstwie adsorpcyjnej nie nasyconej ZPC) --niewielkie stężenie fazy stałej powoduje podwyż stabilności (ale zwiększenie synerezy)
16.Czynniki zewnętrzne ograniczające trwałość pian •temp. powietrza •temp. wody - wzrost temp. wody powoduje zwiększenie szybkości synerezy •stężenie roztworu - charakterystyczne max. trwałość •stan techniczny urządzeń dozujących - wpływ na LS , wielkość pęcherzyków piany, jednorodność piany ogólnie jakość piany •rodzaj wody •dodatki stabilizujące •dyspersja •ciśnienie atmosferyczne
17. Omówić wpływ temp. wody na wytwarzanie pian i ich jakość. Temp.wody wpływa zarówno na zdolność pianotw. Roztworów ja i na stabilność wytworz.pian. Przy niskich temp. Wody drastycznie spada zdolność pianotwórcza wody i wydajn.piany. Wzrost temp. wody powoduje zwięszenie szybkości synerezy. Dla roztworu Deteoru 1000 wpływ temp jest mniejszy niż dla Spumogenu M .
18. Rodzaje środków pianotwórczych
Ze względu na bazę surowcową: •proteinowe (P) •fuoroprote-inowe (FP) - środki proteinowe z dodatkiem detergentów fuorowanych •syntetyczne (S) - zawierające syntetyczne detergenty •fluorosyntetyczne, tworzące film wodny (AFFF) w których detergenty zawierają perfluorowany rodnik alkilowy (tzw. lekka woda) •fluoroproteinowe, tworzące film FFFP w których znajdują się środki typu FP z dodatkiem detergentów typu AFFF ••alkoholoodporne (AR) - zawierające środki pianotwór powyższych typów z dodatkami zabezpieczającymi przed niszczącym zwykłą pianę działaniem cieczy polarnych
19. Jakościowy skład środków pian.
•jeden lub więcej związków powierzchniowo czynnych •rozpuszczalniki organiczne •woda •substancje obniżające temp. krzepnięcia •stabilizatory piany •dodatki antykorozyjne •dodatki poprawiające wzajemną rozpuszczalność składników
20. Parametry pozwalające ocenić przydatność środka pian.
Liczba spienienia - stosunek objętości piany do objętości roztworu, z którego ta piana została wytworzona
LS = Vp/ Vr Ze wzrostem LS stabilność pian rośnie (szybkość synerezy maleje) Dyspersyjność - parametr określający stopień rozdrobnienia pęcherzyków piany; im wyższa średnica pęcherzyków tym mniejsza jest dyspersyjność. Im wyższa dyspersyjność piany, tym trwałość jest większa
Płynność - zdolność do rozpływania się po powierzchni ciał stałych lub cieczy. Ale im więcej zawiera ta piana wody (im bardziej jest płynna) tym następuje szybsza synereza.
Trwałość - synereza ••wart. pięciominutowa W5 - ułamek obj. roztworu wyodrębnionego z piany w ciągu 5 minut od jego wytworzenia ••wart.dwudziestopięcioprocentowa W1/4 - czas wydzielenia się z piany 25% zawartego w niej roztworu ••wart. połówkowa W1/2 - czas wydzielenia się z piany połowy zawartego w niej roztworu
•V obj roztworu wydziel z piany w czasie τ •Vo-początk obj roztworu w pianie
21.We wspólnym układz.: Metan- powietrze- CO2 - Metan- Powietrze -Halon 1211
Różne stężenia gaśnicze tj halon, CO2,powietrze(z przewagą azotu). Mają różne ciepła właściwe (Cp). Różne właściwości przewodzenia ciepła. Środek gaśniczy jest w tej samej fazie co środek palny.
22. SYSTEM CAFS sposób działania zalety i wady
System wytwarzania piany za pomocą sprężonego powietrza. Powietrze jest doprowadzane do roztworu środka pod ciśnieniem przez kompresor. Zastosowanie dużej energii do mieszania roztworu śr.pian. i powietrza skutkuje powstaniem drobnych pęcherzyków piany. ZALETY •Większa trwałość • zdolność do przylegania do pionowych powierzchni • wykorzystuje niższe stężenie poniżej 1 % • niska masa węży WADY • mała wydajność • brak precyzyjnych dozowników i zasysaczy (niskie stężenia)
23. Warunek tworzenia filmu wodnego na powierzchni paliwa
Warunkiem tworzenia filmu wodnego jest odpowiedni rozkład napięć powierzchniowych i międzyfazowych: δ paliwo - δ roztwór > δpal-roz gdzie: δ paliwo- nap.p. paliwa δ roztwór - nap.p roztworu środka pian. δ pal-roz - nap.międzyfazowe na graznicy faz: paliwo- roztwór śr.pian.
GAZY OBJĘTOŚCIOWE
24. Jakie środki stosuje się do gasz. objętościowego? •gazy gaśnicze (obojętne+halony) •piany lekkie •para wodna
25. Mechanizm działania gaśniczego gazów obojętnychGazy inertne ich działanie polega na rozcieńczeniu powietrza i obniżeniu stężenia tlenu do wartości przy której zahamowane zostają procesy Uboczny mechanizm gaśniczy gazów to schładznie- czyli pochłanianie ciepła przez gaz.
26. Działanie gaśnicze gazów obojętnych
Działają one fizycznie •efekty energetyczne : pochłanianie i przewodzenie ciepła (CO2) •efekty przestrzenne : rozcieńczone, izolacja paliwa i utleniacza; odłączenie strefy reakcji (zdmuchnięcie - podawanie środka z gaśnicy
27. Definicje stężeń gaszących i inertujących
Stężenie gaszące - najniższe stężenie gazu w powietrzu powodujące zgaśnięcie płomienia dyfuzyjnego paliwa. Stężenie inertujące-najniższe stężenie gazu gaśniczego przy którym dany gaz lub pary cieczy nie zapala się przy dowolnym stężeniu Stężenie gaszące < stężenie inertujące
27a.Oblicznie minimalnego zapotrzebowania gazu gaśniczego
X=Vpom · n gdzie x- ilość potrzebnego gazu, Vpom - objetość pomieszcz n - współcz. wypełniania gazem np. dla CO2 wynosi od 0,75 do 2,0 kg/m3 objęt. chronionej
A R E O Z O L E
28. Zasada działania i mechanizm gaśniczy aerozoli
Aerozole otrzymuje się w wyniku spalania ładunku pirotechnicznego ze środkiem gaśniczym/npsole nieorganiczne/ w wyniku tego powstaje mieszanina cząstek stałych w gazie o składzie :• nierozłożone sole nieorganiczne, •tlenki metali, •metale alkaiczne. Części stałe mają małe wymiary ok. φ2 μm, więc dużą skuteczność gaśniczą. Główne działanie gaśnicze to inhibicja, poboczne tłumiące.
H A L O N Y
29. Działanie gaśnicze halonów zawierających brom
Halony (również te zawierające brom) działają głównie chemicznie ••wychwytują wolne rodniki ••katalizują rekombinację ••oddziaływują poprzez jony chlorowców, ułatwiają rekombinacje przez efekt trzeciej cząsteczki. Przykład:
CF3Br + H → CF3 + HBr H + HBr → H2 + Br
Br + H + M → HBr + M Działać one mogą również poprzez efekt fizyczny: •inhibitory o dużej pojemności cieplnej obniżają temperaturę (dotyczy to inhibitorów o trwałej cząsteczce)
Z A M I E N N I K I HALONÓW
30. Działanie środków PERFLUOROWANYCH (np. C4F10)
Są to zamienniki halonów, środki antykatalityczne - działanie podobne jak przy halonach (ale większe stężenie gaszone) podobne stężenie toksyczne, "zerowa ODP".INERGEN - mieszanina gazów nie posiadających właściwości inhibicyjnych działa tylko gasząco. SKŁAD (N2,Ag,CO2 dp≅1 FM200 - C3HF7, CEA410 - C4F16, CYA614 - C5F14
•1. Rocieńczanie •2. Efekty cieplne •3.Działanie chemiczne - •wychwyt wolnych rodników • katalizowanie i rekombinacja wolnych rodników •ułatwienie rekombinacji przez 3 obiekt •••Tylko Halony 1211, 1301, 2402
P R O S Z K I 31.Podstawowe składniki proszków gaśniczych
Od składu chemicznego bazy proszku zależy jego skuteczność gaśnicza i zakres stosowania: ••proszki BCE - do gaszenia pożarów płomieniowych; skład : węglany, wodorowęglany metali alkalicznych, siarczany ••proszki ABCDE - do gaszenia pożarów płomieniowych, bezpłomieniowych oraz płonących metali; skład : ortofosforany amonowe, siarczany i wodorosiarczany amonowe ••proszki specjalne - do gaszenia pożarów metali; skład : chlorki sodu lub potasu, czteroboran sodowy, grafit, mikrogranulki węglowe, wysokotopliwe żywice.
32.Jak działają środki gaśnicze przeznaczone do gaszenia pożarów płomieniowych ?
Proszki gaśnicze przeznaczone do gaszenia materiałów spalających się płomieniowo działają poprzez wytworzenie obłoku proszkowego. W tym przypadku proszek jest inhibitorem reakcji spalania tzn. powoduje on wychwytywanie wolnych rodników warunkujących ciągłość spalania; katalizują reakcje rekombinacji (ogólnie: hamują proces spalania; proszki te oddziaływują na płomień).
33.Jakie parametry fizyczne proszku wpływają na jego skuteczność ? PARAMETRY UŻYTK.
•skład ziarnowy i związana z nim gęstość nasypowa, powierzchnia właściwa •gęstość właściwa - zależna od składu chemicznego proszku •własności hydrofobowe •odporność na niską temperaturę •skuteczność gaśnicza •sypkość (płynność - zdolność do przemieszczania się pod wpływem sił ciężkości) •możliwość współdziałania z pianą •przewodnictwo elektryczne •odporność na składowanie w warunkach wahającej się temperatury i wilgotności •odporność na wstrząsy (związane ze zmniejszaniem objętości)
SORBENTY I NEUTRALIZATORY
34. Materiały sorpcyjne stosowane w działaniach PSP.
Sorbenty nieorganiczne sztuczne - wełna szklana, wełna mineralna, pumeks ••naturalne - piasek, popioły, talk, wapień, wysuszona glina Sorbenty organiczne naturalne - słoma, siano, trociny, wysuszony torf, otręby, ielona kora drzew, liście, trzcina, makulatura itp. ••sztuczne - polimery w postaci spienionej, włóknistej, granulowanej, pylnej, np. polietylen, polipropylen, poliuretany, polistylen. Sorbenty działające na zasadzie chemiczno-fizycznej - polimer który pod wpływem wody zmienia strukturę tworząc wolne przestrzenie zdolne do zatrzymania dużych ilości wody cieczy; jest on chemicznie nieaktywny (np. UNI-SAFE)
35. Zjawiska zachodzące przy stosowaniu różnych sorbentów
Nasycenie cieczą swojej struktury kapilarnej - zjawisko samorzutne, możliwe gdy ciecz zwilża dane ciało. Adsorpcja - zjawisko powierzchniowe, polegające na występowaniu różnicy stężeń określonego składnika wewnątrz fazy i w warstwie powierzchniowej ••adsorpcja fizyczna - wywołana siłami międzycząsteczkowymi van der Wadlsa; jest to proces odwracalny ••adsorpcja chemiczna - jeżeli dochodzi do wytworzenia wiązania chemicznego między cząsteczką adsorbowaną i powierzchnią ••Absorpcja - proces dyfuzyjnego przenikania składnika jednej fazy (absorbat) w głąb drugiej (absorbent), zachodz. podczas bezprzeponoweg zetknięcia obu faz.
36. Kryteria wyboru sorbentów ••czy środek „wszechstronny” czy „wyspecjalizowany” ••czy jest w danym przypadku chemicznie obojętny ••dostępność (łatwość i taniość) ••rodzaj wchłanianego materiału (ciecz itp.) ••rodzaj powierzchni z jakiej następuje sorpcja ••możliwość późniejszej utylizacji ••możliwość dodatkowej roli identyfikatora (przy wszechstronnych)
Obj. Pary wodnej w temp. 100oC 200 oC = 2,15m3
![]()
R= 0,082 [m3·atm/kmol·K] M=18 [kg/mol] p=1 [atm]
Qpar = G· Ww · Wo · Cpary · (tp-100)
Równanie Lapace`a ΔP=δ(1/R1+1/R2 δ-nap.pow.wody
ΔP-ciśnienie kapilarne
•Γ= - (c/RT) (dδ/dc), •Γ-stężenie powierzchniowe •c-stężenie roztworu •dc-zmiana stężenia •dσ-zmiana napięcia powierzchniowego •R-uniwersalna stała gazowa •T-temperatura.
Równanie Poiseuille`a - przez pionową kapilarę 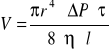
[V obj. η-lepkość l- długość r- -promień τ=czas ΔP różnica ciśnień . Średnia liniowa szybk w kapilarze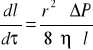
Synera . War. równowagi ![]()
[-Gradient ciśn. po wysok. w kanale Plateau ρ - gęstość cieczy g-przyśpieszenie
Dyfuzyjny transport gazu Δp=2δ{1/r1-1/r2) dla r1<r2
Zad.1 Oblicz max ilość ciepła jaką może odebrać ze strefy pożaru 5 kg wody. Temp. powietrza 20OC. Pominąć ogrz pary wodnej.
- Ciepło parowania wody Qodp = G · Ww · Wo · ΔHp Qodp = 5 kg/s · 2257 kJ/kg = 11 285 kW
- Ciepło ogrzania wody Qogrz = G· Ww · Wo · Cw ·Δt Qogrz = 5 kg/s ·4,19 kJ/kg·deg · (100-20) = 1 676 kW
Suma
Q całk = Qodp + Qogrz = 11 285 +1 676 = 12 961 kW
Odp. 5 kg wody może odebrać 12961 kW
Zad 2 Jaka min ilość śr.pian. potrzeba do wypełnienia pianą lekką w LS=500 pomieszczenia o wym 10x5x3.
Jeżeli stosuje się roztwór o stężeniu ∝2 %.
![]()
m3 = 3000 l ![]()
litrów
Odp. Potrzeba 60 l śr.pian.
Wyszukiwarka
Podobne podstrony:
9500
1 niemiecki 2010 zad ppid 9500 Nieznany (2)
9500
9500 mxc datasheet
9500
9500
Odkrycie zatopionego miasta sprzed 9500 lat u wybrzezy Indii, W ஜ DZIEJE ZIEMI I ŚWIATA, ●txt RZECZY
Pioneer TX 9500 II Schematic
Pioneer TX 9500 Brochure
PL FAQ czesto zadawane pytania do odbiornika Opticum 9500 HD 2CI 2CX E 21 IV 2009
9500 mpr datasheet
Recarga Toner Okidata C9000 9500 Uninet
Nokia 9500 Service Manual Tino96
więcej podobnych podstron