Adam Buczkowski |
Ćwiczenie nr C2 Temat: Wyznaczanie ciepła właściwego powietrza metodą rozładowania kondensatora. |
||
OŚ I ROK |
Ocena z kolokwium |
Ocena ze sprawozdania |
Ocena końcowa |
|
|
|
|
Dr B. Wszołek
|
|
|
|
CZEŚĆ TEORETYCZNA
Gaz doskonały - hipotetyczny gaz obdarzony następującymi cechami:
cząstki gazu są punktami materialnymi lub sztywnymi układami punktów materialnych, atomów (mających pomijalnie małą objętość własną),
zderzenia między cząsteczkami gazu są doskonale sprężyste,
między cząsteczkami nie występują oddziaływania z wyjątkiem chwil zderzeń,
między kolejnymi zderzeniami cząsteczki poruszają się ruchem jednostajnym prostoliniowym w dowolnych kierunkach.
Gazy rzeczywiste w wysokich temperaturach i przy niskich ciśnieniach można traktować jak gazy doskonałe. Z wszystkich rzeczywistych gazów hel jest najbliższy ideałowi gazu doskonałego.
Równanie stanu gazu doskonałego - wzór łączący trzy parametry: ciśnienie, objętość i temperaturę bezwzględną masy stałej gazu przed przemianą (p0, V0, T 0) i po przemianie (p, V, T):
![]()
Równanie Clapeyrona - równanie opisujące stan gazu doskonałego, które wiąże ze sobą podstawowe parametry gazu: ciśnienie p, objętość V, temperaturę T i ilość materii (wyrażoną w molach) n:
![]()
R - uniwersalna stała gazowa:
![]()
Przemiany gazowe:
* Przemiana izotermiczna - przemiana termodynamiczna zachodząca przy stałej temperaturze ( T = const).
Prawo przemiany izotermicznej gazu doskonałego:
W izotermicznej przemianie stałej masy gazu iloczyn jego ciśnienia p i objętości V jest stały:
![]()
Możemy też powiedzieć, że ciśnienie gazu jest odwrotnie proporcjonalne do jego objętości. Wykres tej zależności nazywa się izotermą (jest nią w układzie (p,V) hiperbola).
Prawo Boyle'a-Mariotte'a - prawo przemiany izotermicznej dla gazu doskonałego.
* Przemiana izochoryczna - przemiana termodynamiczna zachodząca przy stałej objętości (V = cosnt).
Prawo przemiany izochorycznej gazu doskonałego:
W izochorycznej przemianie stałej masy gazu ciśnienie jest wprost proporcjonalne do jego temperatury bezwzględnej:
![]()
Wykres tej zależności nazywa się izochorą (jest nią w układzie (p,T) linia prosta przechodząca przez początek układu).
wskazówka, że skala temperatury nie rozciąga się nieograniczenie w dół na temperatury ujemne, lecz się urywa.
* Przemiana izobaryczna - przemiana termodynamiczna zachodząca przy stałym ciśnieniu (p = const).
Prawo przemiany izobarycznej gazu doskonałego:
W izobarycznej przemianie stałej masy gazu objętość zajmowana przez gaz jest wprost proporcjonalne do jego temperatury bezwzględnej:
![]()
Wykres tej zależności nazywa się izobarą (jest nią w układzie (V,T) linia prosta przechodząca przez początek układu)
Podstawowy wzór kinetycznej teorii gazów - wzór na ciśnienie gazu p wyprowadzony dla modelu gazu doskonałego:
![]()
V - objętość naczynia, w którym znajduje się N cząsteczek gazu,
EKśr - średnia energia kinetyczna cząstek (ruchu postępowego). Średnia energia kinetyczna gazu doskonałego EKśr jest proporcjonalna do temperatury gazu i zależy od liczby stopni swobody cząsteczki:
![]()
Wzór na ciśnienie możemy zapisać w postaci:
![]()
ρ - gęstość gazu,
vśr2 - średnia prędkość kwadratowa ruchu postępowego cząstek gazu, wyrażająca się wzorem:
![]()
m - masa cząsteczki gazu.
Ciepło (cieplny przepływ energii) Q - ta część energii wewnętrznej ∆U, którą ciało o temperaturze wyższej przekazuje ciału o temperaturze niższej bez wykonywania pracy W
Ciepło właściwe substancji c - stosunek ilości ciepła Q pobranego przez ciało do iloczynu masy m substancji i przyrostu jego temperatury ∆T wywołanego pobraniem tego ciepła:
![]()
Jednostką ciepła właściwego jest dżul na kilogram i kelwin:
![]()
.
Jest to ciepło właściwe ciała o masie 1 kg, którego temperatura wzrasta o 1 K po pobraniu przez nie ciepła w ilości 1 J.
Ciepło molowe cm - stosunek ilości ciepła Q pobranego przez ciało do iloczynu liczności materii (wyrażonej przez liczbę moli) n ciała i przyrostu temperatury ∆T wywołanego jej pobraniem:
![]()
Jednostką ciepła molowego jest dżul na mol i kelwin:
![]()
Jest to ciepło molowe 1 mola substancji, którego temperatura wzrasta o 1 K po pobraniu przez niego 1 J ciepła.
Pojemność cieplna C - stosunek ilości ciepła Q dostarczonego ciału (układowi), do zmiany jego temperatury ∆T:
![]()
Pojemność cieplna C ciała o masie m zawierającego n moli substancji jest równa:
![]()
c - ciepło właściwe,
cm - ciepło molowe substancji tego ciała.
Metoda pomiaru:
Pomiaru Ciepła właściwego powietrza dokonujemy za pomocą metody rozładowania kondensatora.
Gaz o ciśnieniu p, temperaturze T, i objętości V, jest podgrzewany do temperatury ![]()
, (V=const, p -wzrasta od p do ![]()
). Dla n moli gazu można zapisać: pV=nRT w chwili początkowej, (p+![]()
p)V=nR(T+![]()
p) w chwili końcowej.
Z czego otrzymujemy: ![]()
W doświadczeniu gaz w pojemniku o znanej objętości jest podgrzany w przemianie izochorycznej stąd:
![]()
gdzie Cv jest ciepłem molowym przy stałej objętości. Ogrzanie gazu następuje w wyniku ogrzanie kondensatora. Energia pola elektrycznego, zmagazynowana w kondensatorze wynosi:
![]()
gdzie C jest pojemnością kondensatora, a U napięciem, podczas rozładowania kondensatora przez opór R energia pola elektrycznego zmienia się w ciepło powodując ogrzanie gazu ![]()
stąd:
![]()
Podstawiając za ![]()
otrzymujemy:
![]()
wyznaczamy ![]()
jest linią prostą y=ax. Wyznaczając zależność przyrostu ciśnienia ![]()
do kwadratu napięcia na okładkach kondensatora można wyznaczyć współczynnik a,
![]()
![]()
znając współczynnik a można znaleźć wartość ciepła molowego Cv.
CZĘŚĆ DOŚWIADCZALNA
Wyniki pomiarów:
Lp. |
U [V] |
|
|
|
|
1. |
12 |
144 |
16 |
156,9064 |
156,9064 |
2. |
12 |
144 |
16 |
156,9064 |
|
3. |
12 |
144 |
16 |
156,9064 |
|
4. |
14 |
196 |
20 |
196,133 |
199,2631 |
5. |
14 |
196 |
21 |
205,9396 |
|
6. |
14 |
196 |
20 |
196,133 |
|
7. |
16 |
236 |
30 |
294,1995 |
313,3333 |
8. |
16 |
236 |
32 |
313,8128 |
|
9. |
16 |
236 |
34 |
333,4261 |
|
10. |
18 |
324 |
46 |
451,1059 |
421,3652 |
11. |
18 |
324 |
40 |
382,2660 |
|
12. |
18 |
324 |
44 |
431,4926 |
|
13. |
20 |
400 |
60 |
588,399 |
574,2841 |
14. |
20 |
400 |
56 |
549,1724 |
|
15. |
20 |
400 |
58 |
568,7857 |
|
16. |
22 |
484 |
70 |
684,4655 |
697,6254 |
17. |
22 |
484 |
74 |
725,6921 |
|
18. |
22 |
484 |
70 |
684,4655 |
|
19. |
24 |
576 |
86 |
843,3719 |
842,3254 |
20. |
24 |
576 |
84 |
823,7586 |
|
21. |
24 |
576 |
88 |
862,9852 |
|
22. |
26 |
676 |
104 |
1019,8916 |
993,1547 |
23. |
26 |
676 |
100 |
980,665 |
|
24. |
26 |
676 |
100 |
980,665 |
|
25. |
28 |
784 |
124 |
1216,0246 |
1222,2587 |
26. |
28 |
784 |
120 |
1176,798 |
|
27. |
28 |
784 |
130 |
1274,8645 |
|
Wyniki pomiarów ![]()
przedstawiam na wykresie:
![]()
Temperatura otoczenia 23OC =296K,
Ciśnienie atmosferyczne 735mmHg=97967,76916![]()
760mmHg=1,013![]()
Stosuje metodę regresji liniowej do obliczania nachylenia a:
Lp. |
|
|
|
|
|
1. |
144 |
156,9064 |
20736 |
24617,6121 |
22594,5216 |
2. |
196 |
199,2631 |
38416 |
39601,2564 |
39055,5676 |
3. |
256 |
313,3333 |
65536 |
97969,2547 |
73946,6588 |
4. |
324 |
421,3652 |
104976 |
177548,6318 |
136522,3248 |
5. |
400 |
574,2441 |
160000 |
329802,2275 |
229713,6487 |
6. |
484 |
697,25 |
234256 |
486681,1987 |
337348,2145 |
7. |
576 |
842,3254 |
331776 |
709512,0795 |
484992,7823 |
8. |
676 |
993,1547 |
456976 |
986049,4856 |
671268,4937 |
9. |
784 |
1222,2597 |
614656 |
1493916,33 |
958048,7845 |
Suma: |
9840 |
6132,42133 |
2027328 |
5343995,9090 |
3287705842 |
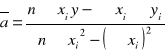
=1,615780741
![]()
![]()
Obliczam odchylenie standardowe:
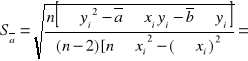
1,315804057
Obliczam ciepło molowe powietrza:
![]()
lub ![]()
![]()
![]()
![]()
![]()
![]()
![]()
lub ![]()
Obliczam ![]()
metodą różniczki zupełnej:
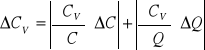
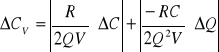
![]()
![]()
![]()
Wnioski:
Ciepło molowe gazu dwuatomowego przy stałej objętości wynosi:
![]()
Wynik ten należy potraktować jako przybliżony, dla gazów dwuatomowych wartość może dość znacznie się różnić. Stąd wynik doświadczenia
![]()
lub ![]()
W zależności od zastosowanego wzoru.
Wyszukiwarka
Podobne podstrony:
O1, Gumed I rok Farmacja, Biofizyka, Sprawozdania, sprawka
6 na 10 pytan, Gumed I rok Farmacja, Chemia
PARAZYTOLOGIA. zakres tematow, Gumed I rok Farmacja, Biologia, Paracytologia
SPRAWOZDANIE Z farmako, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizy
sprawko z ćwiczenia 11, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizy
Napiecie powierzchniowe, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fiz
sprawko biooptyka, BIOLOGIA UJ LATA I-III, ROK III, semestr I, biofizyka, sprawozdania
janka, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizycznej 1, Sprawozd
Wspolczynnik podzialu, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyc
sprawko z przewodnictwa poprawione, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawoz
SPRAWOZDANIE Z ĆWICZENIA NR 2, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania
Efekt fotodynamiczny - sprawko(2), BIOLOGIA UJ LATA I-III, ROK III, semestr I, biofizyka, sprawozdan
Sprawozdanie biofizyka II, Farmacja ŚUM, I ROK, Biofizyka, Sprawozdania
Sprawozdanie biofizyka III, Farmacja ŚUM, I ROK, Biofizyka, Sprawozdania
Sprawozdanie biofizyka IV, Farmacja ŚUM, I ROK, Biofizyka, Sprawozdania
więcej podobnych podstron