Biochemia
Chemia ogólna
Grupy funkcyjne w biochemii:
Jednowartościowe - grupa hydroksylowa (-OH), grupa aminowa (-NH2).
Dwuwartościowe - grupa karbonylowa (=C=O), grupa iminowa (=NH).
Trójwartościowe - grupa karboksylowa (-COOH), grupa cyjanowa (-C=N).
Związki zawierające grupę hydroksylową:
Alkohole - związki organiczne, pochodne węglowodorów, w których atom wodoru zastąpiony został grupą -OH.
Fenole - związki organiczne powstałe przez wprowadzenie do pierścienia aromatycznego w miejsce wodoru grupy -OH.
Enole - związki organiczne zawierające grupę -OH przy atomie węgla związanym podwójnym wiązaniem z drugim atomem węgla.
-C=C-OH
Alkohole:
Klasyfikacja alkoholi
monohydroksylowe (jednowodorotlenowe)
alkanole, np.: metanol, etanol
alkenole, np. alkohol allilowy
alkinole, np. alkohol propargilowy
alkohole cykliczne, np. cykloheksanol
alkohole aromatyczne, zawierają one grupę -OH przy łańcuchu bocznym - nie przy pierścieniu aromatycznym, np. alkohol benzylowy
polihydroksylowe (wielowodorotlenowe)
diole
cukrol
wzór ogólny CnH2n+1OH: CH3OH - metanol, C2H5OH - etanol, C3H7OH - propanol…
Alkohole zawierające powyżej 10 atomów węgla to ciała stałe.
Rzędowość alkoholu - równa rzędowości atomu węgla, z którym połączona jest grupa hydroksylowa.
Rzędowość - liczba określająca ile atomów węgla o hybrydyzacji sp³ jest przyłączonych do określonego atomu związku organicznego:
I rzędowe - 1 atom węgla, II rzędowe - 2 atomy, III rzędowe - 3.
Nienasycone i nasycone:
alkohol metylowy, etylowy i propylowy są alifatycznie nasycone.
Własności alkoholi:
alkohol + aktywny metal sole + H2
alkohol + kwas ↔ ester + woda
dehydratacja alkoholi eter [alkohol + alkohol eter]
W organizmie ludzkim charakter eterów mają hormony (tyroksyna, trójjodotyronina).
Utlenianie alkoholi I rzędowych aldehydy, II rzędowych ketony.
Alkohole wielowodorotlenowe:
glikol etylenowy (1,2-etanodiol) - łączy się z jonami wapnia, co doprowadza do hipokalcemii. Podlega etapowemu utlenianiu, daje kwas szczawiowy, aldehyd glikolowy zaburzający procesy syntezy DNA i RNA.
Glicerol (gliceryna, 1,2,3-propanotriol)
Pochodne - aldehyd glicerynowy, kwas 3-fosfoglicerynowy, fosfodihydroksyaceton.
Fenole:
Ar-OH, gdzie Ar - grupa arylowa.
Właściwości chemiczne:
Reakcja z bezwodnikowym kwasem estryfikacja
C6H5OH + (CH3OH)2O C6H5OCOOH3 + HOOCCH3
reakcja z alkaliami sole zwane fenolanami
C6H5ONa + CO2 + H2O ↔ C6H5OH + NaHCO3
ogrzewanie z amoniakiem anilina
C6H5OH + NH3 C6H5OH + H2O
w reakcji z wodą bromową powstaje trójbromofenol.
Struktury fenolowe wchodzą w skład aminokwasów, np. tyrozyna i jej pochodne - dwujodotyronina, trójjodotyronina i tyroksyna.
Występują w aminokwasach biogennych takich jak serotonina, w hormonach - adrenalina i noradrenalina.
Aldehydy:
grupa związków organicznych posiadających grupę aldehydową, czyli grupę karbonylową (C=O) połączoną z jednym (-CHO) lub dwoma (CH2O) atomami wodoru.
CnH2n+1CHO - wzór ogólny
Własności chemiczne:
Redukcja do alkoholi I rzędowych:
R-C=O R-CH2-OH
Przyłączanie wody wodziany:
R-(C-H)-O + H-OH C-((C-OH)-H)-OH
Reakcja tworzenia oksymów:
R-(C-H)=O +H2N-OH R-(C-H)=N-OH
Reakcje z alkoholem półacetale lub acetale:
R-(C-H)=O +R1-OH R-((C-OH)-H)-R1
Utlenianie do kwasów karboksylowych:
R-(C-H)-O R-(C-OH)-O
reakcje tego typu jest podstawą wykrywania i oznaczania aldehydów, m.in. za pomocą próby: Tollensa, Fehlinga, Benedicta czy Trommera, np.:
próba Tollensa (tzw. próba lustra srebrowego):
2[Ag(NH3)2]+ + HCHO + 3OH- → 2Ag↓ + HCOO- + 2H2O + 4NH3
próba Trommera:
CH3CH2CHO + 2Cu(OH)2 → CH3CH2COOH + Cu2O↓ + 2H2O
Kondensacja aldolowa - w środowisku zasadowym aldehydy ulegają reakcji kondensacji z utworzeniem β-hydroksyaldehydów lub ketonów.
Według tego mechanizmu przy udziale enzymów powstają kwa tłuszczowe, kwas cytrynowy czy cukry.
Aldole - Aldole, β-hydroksyaldehydy, aldehydoalkohole - związki organiczne zawierające grupę aldehydową i alkoholową, otrzymywane w drodze kondensacji aldolowej.
Kondensacja aldolowa to reakcja chemiczna powstawania aldolu, czyli aldehydu z grupą hydroksylową (aldehydoalkoholu) z dwóch aldehydów, z których jeden musi posiadać przynajmniej jeden atom wodoru przy atomie węgla α, czyli tym bezpośrednio związanym z grupą -CHO. Powstające aldole to tzw. β-aldole (albo 3-aldole), bo grupa hydroksylowa znajduje się przy trzecim atomie węgla, licząc od grupy aldehydowej -CHO. Produkt reakcji najczęściej łatwo ulega dehydratacji z wytworzeniem wiązania podwójnego. Ma to miejsce zwłaszcza wtedy, gdy jeden z reagentów zajmuje dużą objętość w pobliżu grupy hydroksylowej. Często dehydratacja jest na tyle uprzywilejowana, że trudno jest zatrzymać reakcję na etapie aldolu.
Reakcję przeprowadza się najczęściej w środowisku zasadowym.
Jeden lub oba substraty mogą być również ketonami. Ketony wykazują jednak najczęściej niższą reaktywność od aldehydów. Gdy powstający związek jest ketonoaldehydem (ketalem) reakcję czasem nazywa się formalnie kondensacją ketalową.
W szczególnym wypadku dwa substraty mogą stanowić ten sam związek - reakcję nazywa się wtedy dimeryzacją aldolową.
Ketony:
grupa związków organicznych zawierających grupę karbonylową (C=O) połączoną z dwoma atomami węgla. Proste ketony, będące monokarbonylowymi pochodnymi alkanów, noszą nazwę alkanonów i mają wzór ogólny CNH2N+2CO. Pokrewne związki, w których przy grupie karbonylowej znajduje się jeden lub dwa atomy wodoru, to aldehydy.
Są to ciecze bardziej lotne od odpowiadających im alkoholi, rozpuszczalne w wodzie i rozpuszczalnikach organicznych, zdolne do krystalizacji.
CH3-(C=O)-CH3 keton di metylowy (aceton)
Ketony nie utleniają się, nie ulegają reakcji polimeryzacji, są mniej aktywne chemicznie od aldehydów. Ulegają reakcji kondensacji i addycji nukleofilowej do grupy karbonylowej, w wyniku której może nastąpić przyłączenie cząsteczki alkoholu, cyjanowodoru, hydrazyny, hydroksyloaminy, a także może następować przyłączenie drugiej cząsteczki ketonu. Ketony są mniej reaktywne od aldehydów i reakcje addycji do ich grupy karbonylowej wymagają ostrzejszych warunków.
Kwasy karboksylowe:
wzór ogólny: CnH2n+1COOH
np. HCOOH - kwas mrówkowy, CH3COOH - kwas octowy, …
Powyżej 13 atomów węgla kwasy te są nierozpuszczalne w wodzie.
Właściwości chemiczne:
Podstawienie atomu wodoru metalem lub zasadą sole
2R-COOH + 2K R-COOK + H2
R-COOH + NaOH R-COONa + H2O
Zastąpienie grupy hydroksylowej:
3CH3-CO-OH + PCl3 3CH3-CO-Cl + H3PO3
redukcja do alkoholi: (katalizator - temperatura i ciśnienie)
R-COOH + H2 RCH2-OH
Eliminacja grupy karboksylowej (stapianie soli sodowej i alkaliów - węglowodanów nasyconych):
CH3-COONa +NaOH CH4 +Na2CO3
Podstawienie atomu wodoru chlorowcem w grupie alkilowej:
CH3-COOH + Cl2 Cl-CH2-COOH + HCl
Estry:
H-CO-O-CH3 mrówczan metylu, HOOC-COOH kwas szczawiowy, HOOC-CH2-COOH kwas malonowy
Kwas szczawiowy - rozpuszczalnik szczawianu, substancje hamujące krzepliwość krwi.
Kwas malonowy - antagonista kompetencyjny kwasu bursztynowego.
Kwas bursztynowy i fumarowy - metabolity w cyklu Krebsa.
Kwas glutarowy - produkt dezaminacji kwasu glutaminowego i metabolit przemiany lizyny.
Kwasy dwufunkcyjne:
Hydroksykwasy: glikolowy, mlekowy, jabłkowy, winowy, cytrynowy
Ketokwasy: pirogronowy, szczawiooctowy, αketoglukarowy, szczawiobursztynowy.
Kwas pirogronowy - przemiany kwasu mlekowego, pochodne acetylo-S-koenzymu-A, syntezy biochemiczne, u osób z zaburzeniami metabolizmu cukrów i cyklu Krebsa powstaje kwas acetylooctowy.
Sole kwasu cytrynowego zapobieganie krzepnięciu krwi.
Wyższe kwasy tłuszczowe:
kwasy stearynowe - substancja stała, nierozpuszczalna w wodzie, reaguje z wodnym roztworem NaOH. Wzór CH3-(CH2)16-COOH
Niezbędne nienasycone kwasy tłuszczowe spotykane w olejach roślinnych - oleinowy, linolowy, linolenowy.
Aminy:
organiczne związki chemiczne zawierające w swojej budowie grupę aminową, będącą organiczną pochodną amoniaku. Przykłady:
CH3-NH2 metyloamina, C2H2-NH2 etyloamina, C6H5-NH2 fenyloamina (anilina)
Właściwości chemiczne:
przyłączają proton wodoru, reakcja z HNO3 umożliwiająca rozróżnienie rzędowości amin.
Amidy:
pochodne kwasów karboksylowych, gdzie grupę hydroksylową zastąpiono grupą aminową NH2.
Amid kwasu karboksylowego - grupy R' i R'' zastąpiona atomem wodoru:
Przykład: CO(NH2)2 mocznik, amid kwasu węglowego
Właściwości chemiczne:
hydroliza zasadowa: sól kwasu + wolny amoniak
hydroliza kwasowa: kwas organiczny + sól amonowa
MOCZNIK - reakcja termicznego rozkładu - biuret.
2H2N-CO-NH2 H2N-CO-NH-CO-NH2 + NH3
w reakcji z HNO3 wydziela się azot:
H2N-CO-NH2 + 2HNO3 2N2 ↑ + CO2 ↑ + 3H2O
hydroliza kwasowa i zasadowa:
H2N-CO-NH2 + H2O +HCl 2NH4Cl + CO2
Białka osocza:
Organizm ludzki składa się z 50% węgla, 8,5% azotu, 4% wapnia.
60 kg masy ciała 11 kg - białka, 9 kg - tłuszcze, 4 kg - sole mineralne, 1 kg - węglowodany.
Białko - (proteina) jest to wielocząsteczkowy polimer (masa cząsteczkowa > 10000 Daltonów), zbudowany z reszt aminokwasowych połączonych ze sobą wiązaniami peptydowymi -CONH-.
Funkcje:
kataliza enzymatyczna - białka odpowiadają za kierunek przemian w organizmie.
transport i magazynowanie - np. żelazo przenoszone w osoczu krwi przez transferrynę, przechowywane w wątrobie w kompleksie z ferrytyną.
ruch uporządkowany - przemieszczanie się chromosomów podczas mitozy, poruszanie się plemników za pomocą witek, to efekt działania białkowych układów kurczliwych.
funkcje mechaniczno-strukturalne - kolagen (białko fibrylarne) zapewnia elastyczność mięśni oraz kości.
ochrona immunologiczna - przeciwciała.
wytwarzanie i przekaz impulsów nerwowych - białka receptorowe.
kontrola wzrostu i zróżnicowania - białkowe czynniki wzrostu.
Peptyd - związek powstały na skutek połączenia się cząsteczek aminokwasu wiązaniem peptydowym. Masa cząsteczkowa < 5-10 tys. Daltonów.
Oligopeptydy - kilka-kilkanaście reszt, Polipeptydy - kilkadziesiąt reszt.
Osocze - krew pozbawiona elementów morfotycznych (do pobranej krwi dodaje się antykoagulanty hamujące krzepnięcie. Podczas wirowania elementy morfotyczne opadają na dno).
Surowica krwi - różni się od osocza brakiem fibrynogenu.
Aminokwas - podstawowa jednostka strukturalna białek. Zbudowany z grup karboksylowej, aminowej, atomu wodoru, grupy R, które wiążą się wiązaniem kowalencyjnym z atomem węgla, tzw. α grupa R nazywa się łańcuchem bocznym aminokwasu.
NH2 NH3+
H-C-COOH oraz jon: H-C-COO-
R R
Standardowe aminokwasy: hydrofobowe - alifatyczne, bądź aromatyczne:
Stereo izomery - Pary takich izomerów nazywa się enancjomerami, a ich istnienie jest związane z cechą związków chemicznych zwaną chiralnością. Enancjomery danego związku stanowią swoje wzajemnie nienakładalne odbicia lustrzane.
izomer L izomer D
Podział aminokwasów:
ze względu na rodzaj rodnika - alifatyczne, cykliczne
ze względu naładunek podczas dysocjacji - słabo kwaśne, kwaśne, zasadowe
ze względu na charakter rodnika - polarne, polarne
z biologii - endogenne (synteza w organizmie)
Asp, Asn, Glu, Gln (kwaśne)
Gly, Ala, Ser (słabo kwaśne)
Pro (cykliczne)
-egzogenne (dostarczane do organizmu)
Tre, Val, Leu, Ile, Met (słabo kwaśne)
Lys, Arg, His (zasadowe)
Phe, Trp (aromatyczne)
- względnie egzogenne - syntezowane jeśli dostarczymy prekursorów:
Cys z Met, Tyr z Phe.
Tworzenie się wiązań peptydowych:
Białka osocza - to białka występujące w każdej żywej komórce.
Funkcje: dystrybucja płynów, homeostaza i koagulacja, transportowe (nośniki hormonów, metali, leków), enzymy regulatory, białka układu odpornościowego, układ buforowy (18%), hormony i receptory, materiał odżywczy.
Synteza - 75% wątroba, 20% immunoglobuliny w limfocytach, reszta w tkankach lub narządach.
Katabolizm - rozkład, w wątrobie lub śródbłonku naczyń:
albuminy -rozkład w skórze, część białek przesącza się do przewodu pokarmowego i tam ulega strawieniu, z moczem wydala się 20-80 mg / dobę, w tym maksymalnie 30 mg albuminy.
Zjawisko elektroforezy - migracja cząstek o charakterze koloidalnym, obdarzonych ładunkiem w porowatym podłożu, pod wpływem pola elektrycznego.
Czynniki wpływające na migrację cząstek białka w nośniku:
ładunek cząstek, pH buforu, napięcie i natężenie prądu, temperatura, rodzaj nośnika, produkcja ciepła:
↑ napięcia ↔ ↓ elektroforezy
przepływ prądu → produkcja ciepła.
Proteinogram:
albuminy 60%
α1 globuliny 4%
α2 globuliny 8%
β globuliny 12%
γ globuliny 16%
Prealbuminy - stanowią 0,5% białek osocza, wiążą T3 i T4, ich wzrost następuje przy zespole nerczycowym, nowotworach, natomiast spadek - uszkodzenia wątroby, niedożywienie, martwica tkanek.
Nazwa |
podgr |
Stężenie |
funkcje |
↓ stężenia |
↑ stężenia |
Albuminy |
----- |
35-45 g/l |
Białko hydrofilowe, wytwarza się po całkowitym nasyceniu siarczanu amonu i pełni rolę koloidu ochronnego, transport leków, bilirubiny, jonów metali, kwasów tłuszczowych, utrzymanie prawidłowego ciśnienia osmotycznego |
Uszkodzenie wątroby, niedożywienie, prowadzi do obrzęku płuc i mózgu , występuje w chorobie nerek, przy poparzeniach. |
Skutkiem jest odwodnienie |
Globuliny |
|
|
Mechanizmy odpornościowe, wiążą tłuszcze i glukozę |
|
|
|
α1 |
Protrombina, insulina, czynnik krzepnięcia VII, VII, IX, α1 inhibitor proteaz, HDL, trans kortyna, |
α1 inhibitor proteaz odpowiada za 80% aktywności proteolitycznej, jest inhibitorem elastazy granulocytu obojętnochłonnego. |
WZW, marskość wątroby, cukrzyca, zespół nerczycowy |
Ciąża, nowotwory, RZS |
|
α2 |
enzymy: fosfatazy. AspAT, LDH, α2 makroglobulina, haptoglobulina, ceruloplazmina, |
Haptoglobina (Hp) -białko ostrej fazy, odpowiada za wychwyt wolnej hemoglobiny we krwi. Maleje w ostrej hemolizie. |
WZW, dna moczanowa |
Nowotwory, ciężkie stany zapalne, II połowa ciąży, ostre i przewlekłe zapalenia |
|
β |
Transferryna, hemopeksyna, fibronektyna, β lipoproteiny, AlAT. |
Odpowiedzialne za transport kwasów tłuszczowych i hormonów sterydowych. Transferryna reguluje stężenie jonów Fe w osoczu, transport jonów Fe do tkanek. Ma dużą masę cząsteczkową, nie ulega filtracji kłębuszkowej, co zabezpiecza org. Przed utratą żelaza. |
nadczynność tarczycy, spadek transferryny (stany zapalne, choroby nerek, wątroby, niedożywienie) |
|
|
γ |
IgG-odpowiedź wtórna, walka z infekcją, |
Przeciwciała -duże zróżnicow. pod wzgl. masy cząsteczk.j, roli biol., składn. niebiałko.
IgG-80% przeciwciał surowicy, przenikają od matki do płodu przez łożysko, zawarte w mleku matki, przeciw bakteriom, toks., wirusom. |
|
Zakażenia, martwica tkanek, niewydolność nerek, ziarnica złośliwa. |
Stan zapalny - zespół reakcji organizmu na czynniki zewnętrzne będące zagrożeniami dla homeostazy organizmu. Czynniki wywołujące to infekcje bakteryjne, wirusowe, oparzenia, urazy mechaniczne.
Do objawów zalicza się ból, gorączkę, zaczerwienienie, obrzęk, upośledzenie funkcji narządu objętego procesem zapalnym.
Najczęstsze zmiany w proteinogramie:
-Hipoproteinemia nieselektywna (obejmuje wszystkie białka) - niedożywienie, utrata krwi. Powoduje równomierne obniżenie stężeń wszystkich frakcji białek.
-Hipoproteinemia z selektywną utratą białka - utrata albumin, uszkodzenie kłębuszków nerkowych (utrata IgG, IgA z moczem).
-Stan ostrej fazy - wzrost frakcji α1 oraz α2, spadek albumin i frakcji β.
-Przewlekłe zapalenia, choroby autoimmunologiczne - wzrost frakcji γ-globulin.
-Marskość wątroby - nadprodukcja IgA i IgM.
-Niedokrwistość hemolityczna - wzrost α2globulin (zużycie haptoglobiny), podwójna frakcja α2.
-Niedokrwistość z powodu braku żelaza.
-Gammapatie monoklonalne - wzrost frakcji γ-globulin (szpiczak typu IgG), wzrost frakcji β oraz α2 (szpiczak typu IgA i IgM), wzrost stężenia białka całkowitego.
-Hipergammaglobulinemia - wzrost frakcji γ-globulin o charakterze poliklonalnym (obecność przeciwciał w chorobach autoimmunologicznych).
Niebiałkowe azotowe składniki osocza:
NH4 powoduje alkalizację środowiska w organizmie człowieka.
*Azot pozabiałkowy, mocznik, kreatynina, kwas moczowy stanowią produkty metabolizmu azotowego i służą do oceny czynności nerek.
Badania oznaczanie w surowicy składników azotowych wydalanych przez nerki, badania czynnościowe nerek, morfologiczne badania nerek.
Związki monitorujące nerki mocznik, kwas moczowy, kreatynina, amoniak, aminokwasy.
*Równowaga azotowa - zależność pomiędzy ilością azoty dostarczonego do organizmu, a wydalonego. Azot dostarczony = azot wydalony.
Dodatni bilans azotowy występuje w przypadku: wzrostu organizmu, ciąży i laktacji, zaburzeń hormonalnych. Natomiast ujemny - niedożywienie, wzrost metabolizmu białek (nowotwory), utrata białka (zespół nerczycowy, oparzenia skóry).
Minimum spożycia białka to jego ilość w diecie potrzebna do utrzymania prawidłowej funkcji organizmu.
*Budowa i funkcja nefronu:
Nefron składa się z ciałka nerkowego (kłębuszek i torebka), kanalika nerkowego (kanalik I rzędu~proksymalny, pętla Henlego, kanalik II rzędu~dystalny).
Funkcje - wydzielnicza, metaboliczna.
*Azot pozabiałkowy - główny produkt metaboliczny rozpadu białek, wydalany z nerek oraz z potem. Głównym substratem biosyntezy mocznika jest amoniak. Toksyczny amoniak usuwany jest poprzez przekształcenie w nietoksyczny mocznik. Jego wzrost w surowicy wiąże się z uszkodzeniem nerek, natomiast spadek stężenia - cieżkie schorzenia wątroby takie jak WZW.
Amoniak jest toksyczny, ponieważ zmienia pH krwi.
*Kreatynina - produkt rozpadu kreatyny i fosfokreatyny.
kreatyna + ATP fosfokreatyna + ADP
Fosfokreatyna ulega stopniowo nieenzymatycznej i nieodwracalnej dehydratacji. 1-2% kreatyny mięśniowej jest degradowane do kreatyniny.
Klirens endogennej kreatyniny - wielkość przesączania kłębuszkowego.
gdzie: Cu - stężenie w moczu,
Cs - stężenie w surowicy,
Vu - dobowa zbiórka moczu.
*Kwas moczowy - produkt powstały z rozpadu puryn. Jest eliminowany z organizmu przez przewód pokarmowy (30%) lub nerki (70%). Wzrost stężenia - hiperurykemia (dna moczanowa) - ból i destrukcja stawów, wytrącają się kryształy moczanu sodowego w tkankach słabo ukwionych. Spadek stężenia - hipourykemia (choroby wątroby, wzmożenie wydalania kwasu przez nerki).
Biosynteza kwasu moczowego cykl mocznikowy:
Cykl ornitynowy, zwany też cyklem mocznikowym lub mocznikowym cyklem Krebsa - cykl metaboliczny (Szlak metaboliczny) trzech aminokwasów: ornityny, cytruliny i argininy prowadzący do powstania mocznika.
Przemiany poprzedzające cykl - Reakcje zużywania aminokwasów rozpoczynają się od odłączenia grupy aminowej w procesie deaminacji. Produktami tych reakcji są łańcuchy węglowe (tzw. ketokwasy) oraz jon amonowy. W komórkach człowieka łańcuchy węglowe po przemianach mogą być włączone w glikolizę lub do cyklu Krebsa. Jon amonowy jest silnie toksyczny. W organizmie człowieka jest więc szybko przekształcany w substancję mniej toksyczną i dobrze rozpuszczalną w wodzie - mocznik. W ciągu doby człowiek wydala średnio kilkanaście gramów mocznika w postaci stężonego moczu. W rzeczywistości w komórkach zużycie większości aminokwasów rozpoczyna się od przeniesienia reszty aminowej (-NH2) (reakcja transaminacji) z rozkładanego aminokwasu na jedną z czterech cząsteczek: α-ketoglutaran (α-KG), glutaminian, szczawiooctan, lub pirogronian. Ta pierwsza przekształca się wówczas w glutaminian, druga w glutaminę, trzecia w asparaginian, czwarta zaś w alaninę. Aminokwasy te są wydzielane do krwi i wędrują do wątroby. W komórkach wątroby alanina i asparaginian ulegają transaminacji i ich grupy aminowe są przenoszone na α-ketoglutaran z wytworzeniem glutaminianu lub na glutaminian z wytworzeniem glutaminy. Glutaminian ulega deaminacji a glutamina deamidacji (enzym glutaminaza), a powstający jon amonowy natychmiast przetwarzany jest w tak zwany karbamoilofosforan. Ten włączany jest do cyklu mocznikowego (ornitynowego).
Przebieg cyklu - Cykl przebiega w mitochondriach (gdzie sprzężony jest z cyklem Krebsa przez łańcuch oddechowy i ATP oraz fumaran i asparaginian) i cytoplazmie komórek wątroby (hepatocytów) i wymaga dostarczenia energii w postaci 4 moli ATP (przekształcanego do ADP), a jego głównym produktem końcowym jest mocznik. Ogólnie sumarycznie cykl można zapisać jako:
NH3 + CO2 + asparaginian + 2 H2O + 3 ATP → mocznik + fumaran + 2 ADP +2 Pi + AMP + PPi
Do cyklu wprowadzany jest karbamoilofosforan powstały z amoniaku i dwutlenku węgla. Karbamoilotransferaza ornitynowa (EC 2.1.3.3) katalizuje reakcje przeniesienia grupy karbamoilowej z karbamoilofosforanu na ornityne w wyniku czego powstaje cytrulina. Syntetaza argininobursztynianowa katalizuje reakcje powstania arginino-bursztynianu. Liaza argininobursztynianowa katalizuje reakcje powstania argininy i fumaranu. Arginaza katalizuje reakcje powstania ornityny i mocznika.
Mocznik z krwią wędruje do nerek, gdzie jest filtrowany i wydalany. Tak więc nadmiar azotu z aminokwasów jest usuwany przez cykl ornitynowy. Inaczej przedstawia się rozkład nadwyżki zasad azotowych. W komórkach człowieka puryny przekształcane są w kwas moczowy, pirymidyny natomiast są rozkładane do mniejszych cząsteczek, które następnie są włączane do szlaków podstawowych.
*Reakcje uwalniające amoniak - w świetle jelita aminokwasy, kwas mocznikowy, mocznik podlegają przetworzeniu przez bakterie przewodu pokarmowego.
Źródło amoniaku w mięśniach cykl purynowy: (skurcz ATP AMP IMP)
*Zaburzenia genetyczne cyklu mocznikowego - wrodzone wady enzymów cyklu mocznikowego powodują hiperamoriemie, które doprowadzić mogą do uszkodzenia mózgu.
Witaminy:
Są to organiczne związki chemiczne, substancje egzogenne (tj. takie, które są niezbędne dla prawidłowego funkcjonowania organizmu żywego i które muszą być dostarczone z pożywieniem, gdyż sam organizm nie potrafi ich wytworzyć).
Nazwa pochodzi od łacińskich słów vita (życie) i amina - związek chemiczny zawierający grupę aminową. W rzeczywistości nie wszystkie witaminy taką grupę posiadają, np. witamina D jest przedstawicielem sterydów.
Funkcje:
-funkcja kofaktorów - działają tak jak witaminy z grupy B; same witaminy B nie są kofaktorami, dopiero ich modyfikacja chemiczna w organizmie prowadzi do powstania kofaktorów; bez dostarczenia witamin z grupy B organizm nie może jednak wyprodukować tych ko faktorów
-działanie antyoksydacyjne (beta-karoten, tokoferole, kwas askorbinowy)
-działanie receptorowe, pochodne witaminy A - głównie kwas retinowy, a także pochodne witaminy D; komórki organizmu posiadają swoiste receptory dla tych związków; powoduje to, że wielu badaczy klasyfikuje te związki do hormonów; nie są to jednak ani hormony, ani cytokiny, ale związki posiadające receptorowe oddziaływanie innego rodzaju.
Podział - rozpuszczalne w tłuszczach (A,D,E,K)
rozpuszczalne w wodzie (B-wszystkie, kwas foliowy, C, P).
Witaminy B
*Tiamina, B1: organiczny, heterocykliczny związek chemiczny złożony z pierścienia tiazolowego i pirymidynowego. Wrażliwa na wysoką temperaturę.
Forma aktywna - pirofosforan tiaminy TPP.
Funkcja - koenzym przemian - dekarboksylacja oksydacyjna α-ketokwasów tj.: kwas pirogronowy, kwas α-ketoglutarowy, α-ketokwasy powstałe w procesie transaminacji aminokwasów rozgałęzionych. Udział w reakcji transketolacji odbywającej się w cyklu pentozowym.
Wzrost zapotrzebowania - ciąża, laktacja, antybiotykoterapia.
Skutki niedoboru - zaburzenia czynności centralnego układu nerwowego: uczucie osłabienia, zmęczenie, oczopląs, zaburzenia pamięci, koncentracji, depresja,
niewydolność krążenia: przyspieszona akcja serca, powiększenie wymiarów serca, obrzęki kończyn górnych i dolnych,
zaburzenia ze strony przewodu pokarmowego: utrata łaknienia, nudności, wymioty, biegunki, bóle brzucha, brak apetytu, spadek wagi.
Skutki nadmiaru - (możliwe tylko w wypadku zastrzyków) - osłabienie, obrzęki, poty, nudności, zmęczenie, duszność, obrzęk krtani, zawroty głowy, drżenie mięśni, zaburzenia rytmu serca, reakcje alergiczne
Źródła - tkanki aktywne metabolicznie (wątroba, serce), a także w: produkty zbożowe grubego przemiału, mięso, wędliny (szczególnie wieprzowina), rośliny strączkowe - groch, fasola oraz drożdże, orzechy, słonecznik, ryby, owoce i warzywa.
*Ryboflawina, B2: zbudowana z reszty rybitolu, którego grupa hydroksylowa w pozycji pierwszej zastąpiona została flawiną. Jest degradowana przez UV.
Forma aktywna - W formie koenzymów: FMN - mononukleotyd flawinowy, powstały wskutek fosforylacji ryboflawiny; FAD - dinukleotyd flawinoadeninowy, powstały wskutek reakcji FMN z ATP.
Funkcja - bierze udział w procesach utleniania i redukcji, współdziała w prawidłowym funkcjonowaniu układu nerwowego, współuczestniczy z witaminą A w prawidłowym funkcjonowaniu błon śluzowych, dróg oddechowych, śluzówki przewodu pokarmowego, nabłonka naczyń krwionośnych i skóry, uczestniczy w przemianach aminokwasów i lipidów, odgrywa ważną rolę w funkcjonowaniu narządu wzroku.
Skutki niedoboru - bardzo rzadki, niedobór możliwy u noworodków poddanych fototerapii. Opóźnienie wzrostu, uszkodzenie gałek ocznych i rogówki, pogorszenie ostrości wzroku, światłowstręt, łzawienie, łatwe męczenie się oczu i okołorogówkowe wrastanie naczyń, wypadanie włosów, kłopoty z koncentracją, zawroty głowy, bezsenność, zaburzenia oddychania, pleśniawki, zajady jamy ustnej, łojotok, pelagra, choroby układu nerwowego, dystrofie mięśni.
Skutki nadmiaru - Bardzo trudno przedawkować witaminę B2 biorąc ją doustnie, ponieważ słaba rozpuszczalność w jelicie chroni przed wchłonięciem niebezpiecznych jej ilości. Ponieważ jest rozpuszczalna w wodzie, jej nadmiar może zostać wydalony z moczem, choć toksyczną dawkę można podać poprzez zastrzyk. Zapalenia języka, fotofobia.
Źródła - Występuje w wątrobie, chudych serach, migdałach, grzybach, dziczyźnie, jajach, zielonych częściach warzyw, łososiu, pstrągu, makreli, pełnoziarnistym pieczywie, małżach, fasoli, grochu, soi, mleku, jogurcie, kefirze, maślance, drożdżach i orzechach włoskich, a także w różnych rodzajach mięs.
*Niacyna, B3: nikotynamid lub kwas nikotynowy. Może być produkowana w organizmie z podstawowego aminokwasu - tryptofanu.
kwas nikotynowy
amid kwasu nikotynowego
Funkcje - Współdziała w syntezie i rozkładzie węglowodanów, kwasów tłuszczowych i aminokwasów, w przemianach metabolicznych mających na celu uwalnianie energii, uczestniczy w tworzeniu czerwonych ciałek krwi, hamuje toksyczne działanie związków chemicznych i leków, reguluje poziom cholesterolu we krwi, rozszerza naczynia krwionośne, oddziałuje korzystnie na system nerwowy i stan psychiczny, poprawia ukrwienie skóry i kondycję włosów.
Skutki niedoboru - przyczyną niedoboru jest choroba Hartnupa (zaburzenie wchłaniania jelitowego) bądź stosowanie leków przeciwpadaczkowych - izoniazydów.
Ogólne osłabienie, bezsenność, bóle głowy, trudności z pamięcią, zaburzenia w działaniu układu nerwowego: agresywne zachowanie, wybuchy złości, niepokój, depresje, nadmierna aktywność, pogorszenie stanu skóry, choroby skórne, owrzodzenie warg, przebarwienia (plamy) na skórze, zespół krowiego języka, pelagra (objawiająca się zapaleniem skóry oraz zaburzeniami ze strony przewodu pokarmowego), zwiększona wrażliwość skóry na światło słoneczne. Charakterystyczne objawy to tzw. "zespół 3d" (dermatitis - zapalenie skóry, diarrhoea - biegunka, dementia - otępienie).
Skutki nadmiaru - Jest mało toksyczna, ale nadmiar witaminy PP może powodować: bóle głowy, mrowienie, zaczerwienienie skóry, swędzenie głowy, szum w uszach, niestrawność, niewydolność wątroby, arytmię serca i psychozy, utratę łaknienia, nadmierne stężenie kwasu moczowego, zwiększenie zawartości glukozy w osoczu.
Źródła - Występuje powszechnie w produktach roślinnych i zwierzęcych, np. w mięsie, orzechach i ziarnach zbóż. Do produktów o niskiej zawartości witaminy B3 należy kukurydza i większość owoców.
*Kwas pantotenowy, B5: amid kwasu pantoinowego i β-alaniny. W rzeczywistości witamina B5 to mieszanina następujących związków chemicznych: kwasu pantotenowego, panteiny (pochodnej kwasu pantotenowego), pantenolu (należącego do grupy alkoholi, nie występującego w przyrodzie, ale aktywnego biologicznie w stosunku do ludzi i zwierząt), koenzymu A (aktywnej biologicznie formy kwasu pantotenowego).
Funkcje - niezbędna do prawidłowego metabolizmu białek, cukrów i tłuszczów oraz do syntezy niektórych hormonów, przyspiesza gojenie ran, warunkuje prawidłowy przebieg procesu uwalniania energii, zapobiega przemęczeniu i usprawnia układ sercowo-naczyniowy, nerwowy i pokarmowy, bierze udział w wytwarzaniu tłuszczów, cholesterolu, hormonów i przekaźników nerwowych, uczestniczy w regeneracji tkanek, poprawia pigmentację i stan włosów.
Skutki niedoboru - zaburzenia układu nerwowego, trudności z nauką, nadmierna drażliwość, omdlenia, depresje, utrata koordynacji, bóle i sztywność w stawach, uczucie odrętwienia, mrowienia i skurcze w ramionach i nogach, niepewny chód, wypadanie włosów, przedwczesna siwizna, łysienie, zmiany skórne, uczucie pieczenia, kłopoty ze wzrokiem, pęknięcia skóry w kącikach ust i oczu, zaburzenia układu trawiennego, utrata apetytu, obstrukcja, niestrawność, przemęczenie, podatność na zakażenia, złe gojenie się ran, częste infekcje górnych dróg oddechowych, zaburzenia układu sercowo-naczyniowego, przyspieszenie czynności serca.
Skutki nadmiaru - nie jest toksyczna, ale nadmiar może powodować biegunki.
Źródła - wątróbka, otręby pszenne, ryby (np. śledzie, makrele, pstrągi), grzyby, mleko pełne, mięso kurczaka, mleczko pszczele, pestki słonecznika, sery, orzechy, jajka, owoce awokado, pomarańcze, ziemniaki, brokuły, ciemny ryż, melony, pełnoziarnisty chleb, soja, masło orzechowe, banany.
*B6, składa się z trzech organicznych związków - pirydoksalu, pirydoksyny, pirydoksyaminy.
pirydoksyna
Aktywna forma - fosforan pirydoksalu (kinaza pirydoksalowa i ATP).
Funkcje - koenzym przemian aminokwasów (dekarboksylacja aminokwasów), transami nacja i dezaminacja, przemiany tryptofanu, udział w transporcie enzymów do komórki, synteza porfiryn, suplementacja tą witaminą może przynieść ulgę w zespole cieśni nadgarstka.
Skutki niedoboru - Niedobór witaminy B6 może wywoływać objawy ze strony układu nerwowego, takie jak: drgawki, depresja, apatia, bezsenność, ogólne pogorszenie samopoczucia, obniżenie sprawności procesów myślowych, zapalenie nerwów. Do innych objawów niedoboru witaminy B6 należą: zmniejszenie odporność na infekcje, stany zapalne skóry (łojotokowe zmiany na twarzy, podrażnienie języka i błon śluzowych jamy ustnej), niedokrwistość, kamica nerkowa, zmęczenie, nudności, zaburzenia w funkcjonowaniu mięśnia sercowego, zwiększenie ryzyka powstawania nowotworów, natomiast u dzieci - opóźnienie umysłowe, nieprawidłowości w budowie kości, objawy padaczkowe, drażliwość. Niedobór witaminy B 6 jest ważnym czynnikiem ryzyka rozwoju miażdżycy, stąd niedobór tej witaminy zwiększa ryzyko udaru i choroby niedokrwiennej serca
Skutki nadmiaru - Witamina B6 w dużych dawkach jest neurotoksyczna. U niektórych osób uszkodzenia układu nerwowego mogą wystąpić już przy 50 mg chlorowodorku pirydoksyny na dobę, stosowanego przez odpowiednio długi czas. Długotrwałe przyjmowanie dawek witaminy B6 powyżej 200 mg (zazwyczaj 1000 mg lub większych) może powodować neuropatię obwodową. Zmiany te ustępują wraz z zaprzestaniem nadmiernej suplementacji witaminą B6. W wypadku zażywania dawek poniżej 200 mg na dobę, objawy uboczne występują bardzo rzadko
Neurotoksyczne działanie wysokich dawek witaminy B6 obserwuje się w przypadku spożywania jej w formie chlorowodorku pirydoksyny, nie występuje zaś dla fosforanu pirydoksalu (biologicznie aktywnej formy witaminy B6, w którą pirydoksyna ulega przekształceniu w organizmie)
Źródła - Główne źródła witaminy B6 w pożywieniu to mięso, ryby, drób, jajka, mleko, drożdże, warzywa (kapusta, groszek zielony, kalafior, marchew, szpinak, ziemniaki, fasola), zboża (kiełki pszenicy), soja, orzeszki ziemne, orzechy włoskie, pestki dyni, pestki słonecznika, banany, napoje energetyczne.
*Biotyna, B7: inaczej witamina H, organiczny związek chemiczny o budowie heterocyklicznej występujący w organizmach zwierzęcych i roślinnych. Stanowi ona koenzym kilku różnych enzymów. Jest niezbędnym składnikiem enzymów - karboksylaz biotynozależnych. Uczestniczy w przenoszeniu grupy karboksylanowej (-COO-) z anionu wodorowęglanu na różne związki organiczne, zależnie od rodzaju danej karboksylazy. Zaliczana jest do witamin rozpuszczalnych w wodzie. Składa się z pierścieni: tiofenowego i imidazolidynowego.
Funkcje - Karboksylazy są enzymami niezbędnymi w wielu ważnych reakcjach biochemicznych, np. w procesie tworzenia glukozy (glukoneogeneza), syntezy kwasów tłuszczowych, czy cyklu kwasu cytrynowego. Biotyna wspomaga również funkcję tarczycy, przemianę dwutlenku węgla, wpływa na właściwe funkcjonowanie skóry oraz włosów, uczestniczy z witaminą K w syntezie protrombiny (odpowiedzialna za krzepliwość krwi).
Skutki niedoboru - Objawami niedoboru biotyny są zmiany skórne - wysypki, stany zapalne, a także wypadanie włosów i podwyższony poziom cholesterolu oraz zmiany zapalne jelit. Ze względu na to, że biotyna może być syntetyzowana przez florę bakteryjną do jej niedoboru dochodzi bardzo rzadko, zwykle pod wpływem innych czynników niż niedobór pokarmowy (np. szerokospektralna antybiotykoterapia).
Skutki nadmiaru - brak.
Źródła - Biotyna występuje w wątrobie, orzechach włoskich i ziemnych, mące sojowej, żółtku jaj, krabach, migdałach, sardynkach, grzybach, brązowym (naturalnym) ryżu, mące pełnoziarnistej, szpinaku, marchwi, pomidorach.
*Cyjanokobalamina, kobalamina, B12 - złożony organiczny związek chemiczny zawierający kobalt jako atom centralny. W organizmach żywych pełni rolę regulatora produkcji erytrocytów (czerwonych ciałek krwi). Jego niedobór powoduje niedokrwistość. Zaliczany jest do witamin z grupy B, tj. rozpuszczalnych w wodzie prekursorów koenzymów.
Funkcje - bardzo ważny koenzyme w reakcjach metylacji w organizmie:
-metylacji homocysteiny do metioniny katalizowanej przez syntazę metioninową odtwarzając tym samym H4-folian (ważny donor grup jednowęglowych w syntezie puryn) z metylo-H4-folianu,
-konwersji metylomalonylo-CoA (pochodzącego z propionianu) do bursztynylo-CoA (metabolit cyklu Krebsa) katalizowanej przez mutazę metylomalonylo-CoA, co umożliwia wprowadzenie propionianu do cyklu przemian pirogronianu.
Powyższe reakcje istotne są w przemianach węglowodanów, białek, tłuszczów i w innych procesach. Uczestniczy także w wytwarzaniu czerwonych ciałek krwi, przeciwdziała niedokrwistości, umożliwia syntezę kwasów nukleinowych w komórkach, przede wszystkim szpiku kostnego; wpływa na funkcjonowanie układu nerwowego, uczestniczy w tworzeniu otoczki mielinowej ochraniającej komórki nerwowe i neuroprzekaźników nerwowych, zapewnia dobry nastrój, równowagę psychiczną, pomaga w uczeniu się, skupieniu uwagi; dzięki niej zmniejsza się poziom lipidów we krwi; wpływa na układ kostny, pobudza apetyt.
Skutki niedoboru - manifestuje się jako złożony zespół chorobowy, którego głównymi objawami są objawy neurologiczne, hematologiczne i psychiatryczne. U podstaw biochemicznych zespołu leży zaburzenie metabolizmu metioniny, wywołane brakiem kofaktora (jakim jest kobalamina) enzymu syntetazy metioniny. Nieleczona jest stanem zagrażającym życiu.
1) Niedobór witaminy B12 w diecie spotykany u: osób stosujących dietę wegańską (o ile nie suplementuje się witaminy B12), anorektyków, alkoholików, osób starszych nie odżywiających się prawidłowo.
2) Zaburzenia wchłaniania kobalaminy: związane z niedoborem lub unieczynnieniem czynnika wewnętrznego -Castle'a (choroba Addisona-Biermera, choroby żołądka [rak żołądka, stan po gastrektomii, przewlekłe - autoimmunologiczne lub nieautoimmunologiczne, np. wywołane przez H. pylori - zanikowe zapalenie błony śluzowej żołądka.], wrodzony niedobór czynnika wewnętrznego, długotrwałe przyjmowanie inhibitorów pompy protonowej), związane z upośledzeniem wchłaniania kompleksu kobalamina-czynnik wewnętrzny w jelicie krętym (choroby jelita cienkiego - resekcja jelita, nowotwory, uchyłkowatość, choroba Leśniowskiego-Crohna, wrodzone, wybiórcze zaburzenie wchłaniania (rzadko) - najczęściej zespół Imerslund-Gräsbecka, celiakia).
3) Zwiększone zużycie przez organizmy obce (współzawodnictwo pokarmowe): zespół rozrostu bakteryjnego, infestacja bruzdogłowcem szerokim (difylobotrioza).
4) Inne: niedobór transkobalaminy II i niektóre inne mutacje prowadzące do homocystynurii, AIDS.
Objawy niedokrwistości - osłabienie, męczliwość, upośledzenie koncentracji, bóle i zawroty głowy, tachykardia, bladość skóry i błon śluzowych;
Objawy ze strony przewodu pokarmowego: utrata czucia smaku, pieczenie języka, utrata łaknienia, chudnięcie;
Objawy neurologiczne: Objawy neurologiczne często wyprzedzają pozostałe manifestacje choroby. W kolejności pojawiają się: parestezje palców dłoni i stóp, osłabienie, niepewność chodu, objawy uszkodzenia tylno sznurowego (zaburzenia czucia wibracji, zaburzenia czucia dotyku, zaburzenia czucia głębokiego, upośledzenie czucia temperatury i bólu), objawy uszkodzenia sznurów bocznych rdzenia (osłabienie siły mięśniowej kończyn, wzrost napięcia mięśniowego o typie spastycznym), objawy zespołu piramidowego, zanik nerwu wzrokowego (początkowo mroczek paracentralny w polu widzenia, potem osłabienie ostrości wzroku, nieleczona choroba prowadzi nieodwracalnie do ślepoty).
Objawy psychiatryczne: Zaburzenia poznawcze - od łagodnych (MCI) do otępienia. W patofizjologii odgrywa tutaj rolę sam niedobór witaminy B12, jak również hiperhomocysteinemia (będąca skutkiem jej niedoboru i ewentualnego współistniejącego niedoboru witaminy B6 / kwasu foliowego) zwiększająca ryzyko wystąpienia incydentów naczyniowych, szczególnie o typie lakunarnym. Zaburzenia zachowania, apatia, drażliwość, opisywano zespoły urojeniowe przypominające schizofrenię ("szaleństwo megaloblastyczne"), zaburzenia świadomości (splątanie), stany depresyjne (włącznie z tendencjami samobójczymi).
Pozostałe objawy: W stadiach terminalnych choroby opisywano śpiączkę (coma Biermericum), prawdopodobnie wynikającą z nasilonej niedokrwistości i mocznicy.
Objawem niedoboru witaminy B12 może być przedwczesne siwienie i zażółcenie skóry o charakterystycznym, cytrynowym odcieniu.
Skutki nadmiaru - Witamina B12 nie jest toksyczna, jednakże przy stosowaniu przez dłuższy czas bardzo dużych dawek tej witaminy zaobserwowano u niektórych ludzi objawy uczuleniowe. W bardzo wysokich dawkach może również wystąpić krwotok z jam nosowych.
Źródła - Witamina B12 produkowana jest przez bakterie żyjące w układzie pokarmowym zwierząt. U człowieka powstaje w symbiozie z bakteriami układu pokarmowego. Następuje to dopiero w dystalnych częściach układu trawiennego, to jest w jelicie grubym. Ma to znaczące konsekwencje, gdyż w tej części jelit witaminy nie podlegają wchłanianiu i wszystko co wyprodukują bakterie, zostaje wydalone wraz z kałem. Witamina B12 występuje wyłącznie w produktach pochodzenia zwierzęcego, takich jak wątroba, nerki i serce, a także w chudym mięsie, rybach, skorupiakach, serach i jajach.
*Kwas foliowy, folacyna, witamina M, B9/B11: Występuje w żywności w postaci folianów, dlatego często termin witamina B9 utożsamia się z całą grupą związków (ustalono, że może istnieć teoretycznie ok. 150 rozmaitych form kwasu foliowego; w przyrodzie jest ich nieco mniej, bo około 20 rodzajów).
Funkcja - Kwas foliowy reguluje wzrost i funkcjonowanie komórek; wpływa dodatnio na system nerwowy i mózg, decyduje o dobrym samopoczuciu psychicznym; zapobiega uszkodzeniom tzw. cewy nerwowej u rozwijającego się w łonie matki dziecka, ma pozytywny wpływ na wagę i rozwój noworodków; bierze udział w zachowaniu materiału genetycznego, w przekazywaniu cech dziedzicznych komórek, reguluje ich podział; usprawnia funkcjonowanie układu pokarmowego, uczestniczy w tworzeniu soku żołądkowego, zapewnia sprawne działanie wątroby, żołądka i jelit; jest czynnikiem antyanemicznym, pobudza procesy krwiotwórcze, czyli powstawanie czerwonych krwinek; chroni organizm przed nowotworami (szczególnie rakiem macicy).
Skutki niedoboru - zahamowanie wzrostu i odbudowy komórek w organizmie, mała ilość czerwonych ciałek we krwi, tzw. anemia megaloblastyczna (makrocytowa), uczucie przemęczenia i kłopoty z koncentracją, stany niepokoju, lęku, depresja, nadmierna drażliwość, bezsenność, roztargnienie, problemy z pamięcią, zaburzenia w trawieniu i we wchłanianiu składników odżywczych, niedożywienie, biegunka, zmniejszony apetyt, obniżona masa ciała, stany zapalne języka oraz błony śluzowej warg, bóle głowy, kołatanie serca, przedwczesna siwizna, u dzieci i młodzieży zahamowanie wzrostu.
Prawidłowa podaż kwasu foliowego jest niezwykle istotna u kobiet w ciąży, jego niedobór powoduje wady cewy nerwowej u płodu.
Skutki nadmiaru - Kwas ten nie jest toksyczny dla ludzi, ale jego zwiększone dawki mogą powodować bezsenność, rozdrażnienie.
Źródła - Znajduje się w liściastych warzywach, szczególnie zielonolistnych (sałata, szpinak, kapusta, brokuły, szparagi, kalafiory, brukselka) a także w pomidorach, grochu, fasoli, soczewicy, soi, burakach, orzechach, słoneczniku, drożdżach piwnych, wątrobie, żółtku jajka, pszenicy, pomarańczach, bananach, awokado. W wielu krajach (nie w Polsce) kwasem foliowym wzbogaca się chleb
Niedobór witaminy B12, B6 i kwasu foliowego prowadzą do niedokrwistości i zwiększenia stężenia homocysteiny w organizmie.
Witamina A, Retinol, Retinal, kwas retinowy: zbiorcza nazwa grupy organicznych związków chemicznych (retinoidów, z których najważniejszy jest retinol), pełniących w organizmie funkcję niezbędnego składnika pokarmowego, rozpuszczalnej w tłuszczach witaminy.
Podstawową formą witaminy A jest ester - palmitynian retinolu, który w jelicie cienkim ulega estryfikacji do alkoholu - retinolu.
Przekształcenie prowitaminy w witaminę A: dioksygenaza, reduktaza, oksydaza.
Funkcje -
Retinolu (tylko on wykazuje pełną aktywność biologiczną) i retinalu: istotna rola w odbieraniu bodźców wzrokowych w siatkówce oka, odpowiada za integralność błon komórkowych, prawidłowe funkcjonowanie komórek tkanki nabłonkowej, zarówno pokrywających jak wydzielniczych i czuciowych, regulacja wzrostu tkanki nabłonkowej i innych komórek organizmu, utrzymuje prawidłowy stan skóry, włosów i paznokci, zapewnienie normalnego wzrostu kości i zębów przez regulację aktywności komórek tkanki kostnej, chroni nabłonek układu oddechowego przed drobnoustrojami.
Kwasu retinowego: odpowiada za prawidłowe wytwarzanie kolagenu typu IV i fosfatazy zasadowej, różnicowanie komórek: osteoblastów, keratynocytów, fibroblastów, spermatocytów i komórek pnia, działanie przeciwnowotworowe: w ostrych białaczkach szpikowych hamuje proliferację komórek, wzmaga wydzielanie TNF alfa i aktywuje limfocyty.
Gdy komórki organizmu potrzebują retinolu, to zostaje on uwolniony z wątroby do krążenia ogólnego. Retinol we krwi jest transportowany przez białko RBP (retinol binding protein), kompleks ten dodatkowo łączy się z transtyretyną (białkiem, które uniemożliwia wydalenie tego kompleksu przez nerki). Kwas retinowy we krwi jest transportowany z albuminami. W komórce retinol łączy się z białkiem cRBP (cellular retinol binding protein) a kwas retinowy z cRABP. Związane cząsteczki retinoidowe mają swoiste receptory jądrowe RAR i RXR, zawierające miejsca wiążące DNA, zwane również miejscami odpowiedzi kwasu retinowego RARE.
Skutki niedoboru - Niedobór witaminy A wywołuje keratynizację nabłonków (oka, dróg oddechowych, dróg pokarmowych, rogówki)
kseroftalmia - wysychanie spojówek i rogówek, kruche, wolno rosnące paznokcie, suchość skóry, czasem objawiająca się zaczerwionymi obszarami, brak apetytu, ślepota zmierzchowa (tzw. "kurza ślepota"), pogorszenie wzroku, zahamowanie wzrostu, zanikanie nabłonków, łuszczyca, rogowiec dłoni i stóp, trądzik pospolity, łysienie plackowate, skłonności do biegunek, złe samopoczucie.
Zatrucie ostre - Wątroby niektórych zwierząt, szczególnie polarnych, często zawierają witaminę A w ilościach toksycznych dla ludzi. Pierwsza udokumentowana śmierć (Xavier Mertz, naukowiec szwajcarski) spowodowana hiperwitaminozą A nastąpiła w styczniu 1913, podczas wyprawy na Antarktydę. Mertz, po stracie zapasów żywności, został zmuszony zjeść psy pociągowe. Wątroba niedźwiedzia polarnego zawiera śmiertelną dla człowieka ilość witaminy A (w 500 g produktu 9 000 000 IU wit. A). Objawy ostrego zatrucia powstają prawdopodobnie wskutek wzrostu ciśnienia śródczaszkowego (wymioty, nudności, bóle głowy, zaburzenia koordynacji mięśniowej).
Zatrucie przewlekłe - wady wrodzone u dzieci matek z hiperwitaminozą w czasie ciąży, zaburzenia wątroby, zmniejszone uwapnienie kości mogące doprowadzić do osteoporozy, bóle stawów.
Źródła - Głównym źródłem aktywnych form witaminy A w organizmie, jest spożywana z pokarmem pochodzenia roślinnego prowitamina A (głównie β-karoten). Innym bogatym źródłem witaminy A jest wątroba zwierząt. Najwięcej prowitaminy A zawierają: marchew, liście brokułu, słodkie ziemniaki (wilec ziemniaczany), jarmuż, szpinak, dynia, kapusta warzywna pastewna. W organizmie ludzkim, enzymem odpowiedzialnym za przekształcenie β-karotenu w retinal jest dioksygenaza β-karotenowa.Witamina D: grupa rozpuszczalnych w tłuszczach steroidowych organicznych związków chemicznych, odgrywających rolę w wielu różnorodnych i ważnych funkcjach fizjologicznych, przede wszystkim gospodarce wapniowo-fosforanowej oraz strukturze i funkcji kośćca. Istnieją dwie podstawowe formy witaminy D, różniące się przede wszystkim budową łańcucha bocznego:
ergokalcyferol (witamina D2), naturalnie występujący w organizmach roślinnych/drożdżach;
cholekalcyferol (witamina D3), naturalnie występujący w organizmach zwierzęcych.
Witaminy D w organizmie człowieka można zaliczyć do witamin lub prohormonów.
Hydroksylacja witaminy D do postaci aktywnej odbywa się w wątrobie (24,25) i w nerce (1).
Forma aktywna - 1,25-dichydroksycholekalcyferol, w skrócie 1,25-D3.
Receptory aktywnej witaminy D znajdują się w: jelitach, nerkach, przytarczycach, przysadce mózgowej, trzustce, w monocytach, limfocytach, gruczole mlekowym.
Funkcje -
Układ kostny - pobudza osteolizę osteoklastyczną (OAF czynnik aktywujący osteoklasty, przekształcenie monocytów w osteoklasty.
Nerki - spadek wydalania wapnia i fosforanu.
Jelito - wzrost wchłaniania wapnia, CaBP.
Skutki niedoboru - Awitaminoza grozi krzywicą u dzieci i młodzieży, rozmiękaniem kości (osteomalacja) i osteoporozą u dorosłych, złamaniami, skrzywieniami i zwyrodnieniami układu kostnego, zniekształceniami sylwetki, złym funkcjonowaniem układu nerwowego i mięśniowego, zapaleniem spojówek, stanami zapalnymi skóry, osłabieniem organizmu i zmniejszeniem odporności, pogorszeniem słuchu, osłabieniem i wypadaniem zębów oraz zwiększeniem się ryzyka chorób autoimmunologicznych, zwłaszcza cukrzycy typu I, choroby Leśniowskiego-Crohna, raka pęcherza moczowego, piersi, jelita grubego, okrężnicy i jajnika. Osoby z chorobą Parkinsona i stwardnieniem rozsianym mają niższe stężenie witaminy D w surowicy.
Skutki nadmiaru - Nie jest możliwe wywołanie hiperwitaminozy przy zwykłej diecie lub intensywnej ekspozycji na promieniowanie ultrafioletowe. Nadmierna ilość promieni UV rozkłada witaminę D do suprasterolu zapobiegając nadprodukcji. Do przedawkowania witaminy D podawanej doustnie dochodzi rzadko, ponieważ wymaga podawania przewlekle dużych dawek tej witaminy - ok. 50 tys. j.m. na dobę lub więcej. W niektórych chorobach np. sarkoidozie, gruźlicy czy idiopatycznej hyperkalcemii o wiele mniejsze dawki niewiele przekraczające dawki terapeutyczne (np. powyżej 1000 j.m. na dobę) mogą już spowodować objawy zatrucia.
Występujące objawy są związane z hiperkalcemią (spadek stężenia wapnia we krwi organizm stymuluje przytarczyce do syntezy parathormonu, który stymuluje uwalnianie wapnia i fosforanu z kości. W przewodzie pokarmowym następuje wzrost wchłaniania i spadek wydalania wapnia z moczem.) - nudności i wymioty, brak apetytu, zaparcia, osłabienie i łatwe męczenie się, nadmierne pragnienie, wzmożone oddawanie moczu, świąd skóry, bóle głowy. Przy towarzyszącej hiperkalciurii może dochodzić do tworzenia złogów nerkowych (kamica nerkowa), a także zwapnień (nefrokacynoza), następnie do niewydolności nerek. Złogi wapniowe mogą pojawiać się w tkankach: np. tętnicach, sercu, płucach. U dzieci można zaobserwować opóźnienia w rozwoju psychomotorycznym.
Źródła - Pod wpływem światła słonecznego w drożdżach i roślinach powstaje ergokalcyferol. Cholekacyferol znajduje się w rybach oleistych i ich produktach: tran i oleje rybne, ryby (łosoś, dorsz, tuńczyk, śledź, makrela, sardynki), wątroba, jaja, grzyby.
Z tego względu, że zwykle dieta nie zawiera wystarczającej ilości witaminy D niektóre produkty spożywcze są w nią wzbogacane. W USA: mleko i jogurt, płatki śniadaniowe, sok pomarańczowy oraz margarynę. W krajach europejskich są to: margaryna i płatki śniadaniowe.Witamina K, fitochinon, menadion: grupa związków chemicznych, będących pochodnymi 2-metylo-1,4-naftochinonu. Organizm człowieka potrzebuje około 2 mg witaminy K na dobę. W organizmie podlega ona procesowi regeneracji w wątrobie w cyklu witaminy K. Może być również produkowana przez bakterie znajdujące się w jelicie grubym.
Do witamin K zalicza się dwie naturalne (rozpuszczalne w tłuszczach)(witamina K1 (fitomenadion, fitonation, filochinon i inne), która w pozycji trzeciej posiada resztę fitynową oraz witamina K2 (menachinon-6, farnochinon), która w pozycji trzeciej posiada resztę difarnezylową lub inne grupy izoprenowi) oraz jedną syntetyczną (Otrzymuje się również szereg pochodnych syntetycznych (rozpuszczalne łatwiej w tłuszczach lub rozpuszczalne w wodzie) np: witamina K3 (menadion))
Funkcje - Witamina K uczestniczy w tej reakcji jako kofaktor γ-karboksylazy (warunkuje to: utrzymanie prawidłowego stężenia czynników krzepnięcia: II, VII, IX, X, a także: osteokalcyny, osteopontyny, osteonektyna, syntezę i utrzymanie prawidłowego stężenia naturalnych czynników krzepnięcia, a także białek wiążących wapń w nerkach, łożysku i płucach.)
Funkcje witamin K w organizmie: regulują wytwarzanie protrombiny, zapewniają krzepliwość krwi i powodują zatrzymanie krwawienia, zmniejszają nadmierne krwawienia miesiączkowe, odgrywają rolę w gospodarce wapniowej i mineralizacji tkanek, hamują rozwój raka piersi, jajnika, okrężnicy, żołądka, pęcherzyka żółciowego, wątroby i nerki.
Skutki niedoboru - słabą krzepliwość krwi, łatwość powstawania krwotoków wewnętrznych i zewnętrznych, problemy z gojeniem się ran, trudności w mineralizacji kości, zwiększone ryzyko rozwoju nowotworów, zapalenie jelita, biegunki.
Skutki nadmiaru - rozpad krwinek czerwonych, niedokrwistość, nadmierne wydzielanie potu, uczucie gorąca, u niemowląt - żółtaczkę i uszkodzenia tkanki mózgowej.
Źródła - Witaminy K mogą być wytwarzane przez florę jelitową saprofitującą w jelicie cienkim i jednocześnie występują w wielu produktach spożywczych, takich jak brokuły, rzepa, szpinak, ogórek, sałata, kapusta właściwa, lucerna, morszczyn, a także w owocach awokado, również w ziemniakach, jajkach, jogurcie, serze, wątrobie, oleju sojowym i szafranowym.Witamina E, tokoferol: główny przeciwutleniacz występujący w komórkach.
Funkcja - wzmacnia ścianę naczyń krwionośnych, chroni erytrocyty przed przedwczesnym rozpadem, ochrona lipoprotein.
Skutki niedoboru - Witamina E występuje powszechnie, praktycznie nie spotykamy się z jej niedoborem. Jednakże awitaminoza może powodować: rozdrażnienie, osłabienie zdolności koncentracji, zaburzenia funkcjonowania i osłabienie mięśni szkieletowych, rogowacenie i wczesne starzenie się skóry, gorsze gojenie się ran, pogorszenie wzroku, niedokrwistość, bezpłodność, zwiększone ryzyko chorób sercowo-naczyniowych.
Skutki nadmiaru - Hiperwitaminoza witaminy E jest niemalże niemożliwa. W przypadku spożywania codziennie przez dłuższy okres dawki większej niż 1000 mg mogą wystąpić następujące objawy: zmęczenie, bóle głowy, osłabienie mięśni, zaburzenia widzenia.
Źródła - Występuje w olejach roślinnych (sojowym, kukurydzianych, słonecznikowym, z orzecha włoskiego), migdałach, margarynie, jajach, marchewkach, orzechach włoskich i ziemnych, kiełkach pszenicy, mące pełnoziarnistej, mleku, brukselce i innych zielonolistnych warzywach.Witamina C, kwas askorbinowy: organiczny związek chemiczny, pochodna glukozy o wzorze sumarycznym C6H8O6. W warunkach standardowych jest białym, krystalicznym ciałem stałym. Dobrze rozpuszcza się w wodzie, roztwór ma odczyn kwasowy.
Funkcje - skracanie czasu trwania infekcji górnych dróg oddechowych, aktywizacja systemu immunologicznego, niszczenie wirusów, ułatwianie gojenia się ran i złamań, hamowanie tworzenia się sińców i powstawania krwotoków, hamowanie krwawienia dziąseł, podnoszenie odporności na zakażenia, regulacja poziomu cholesterolu, obniżanie ciśnienia krwi, ochrona przed zmianami nowotworowymi (rakiem żołądka, jamy ustnej, przełyku, płuc, wątroby, szyjki macicy i odbytu), łagodzenie niepożądanych skutków radioterapii, ochrona skóry przed działaniem słońca i starzeniem, hamowanie rozwoju zaćmy, wpływ na wytwarzanie i zachowywanie kolagenu, uczestnictwo w produkcji hormonów zwalczających stres, poprawa wydolności fizycznej. Witamina C bierze także udział w przemianach tyrozyny, syntezie steroidów nadnerczowych. Ma również wpływ na zachowanie prawidłowego potencjału oksydacyjnego w komórce.
Skutki niedoboru - Szkorbut, samoistne krwawienia, uszkodzenia naczyń krwionośnych, krwawe wybroczyny, złe gojenie i odnawianie się ran, rozpulchnienie dziąseł, zmiany w zębach (np. zgorzel), bolesność stawów i mięśni, obrzęki kończyn, osłabienie, utrata apetytu, obniżenie wydolności fizycznej, depresja, osteoporoza, niedokrwistość mikrocytarna niedobarwliwa, nadczynność gruczołu tarczowego, zaburzenia neurologiczne, wtórne infekcje, schorzenia żołądka, zapalenie błony śluzowej, przedłużenie okresu zaziębienia organizmu i trudności w leczeniu zakażeń. Ostatecznie może prowadzić do śmierci.
Skutki nadmiaru - Kwas askorbinowy nie jest toksyczny, ale przyjmowany w nadmiarze może wywoływać dolegliwości żołądka, nudności, biegunkę, wymioty, wysypkę skórną, obniżać odporność po radykalnym zmniejszeniu dawki. Jednak mimo tego wszystkiego zazwyczaj jego nadmiary wydalane są z organizmu wraz z moczem. Stosowanie wyższych niż zalecane dawek witaminy C w czasie ciąży może być szkodliwe dla płodu.
Źródła - Świeże owoce i warzywa (szczególnie zielono liściaste): acerola, gwajawa, winogrona, papryka, koper ogrodowy, owoce dzikiej róży, owoce cytrusowe(cytryny, pomarańcze, grejpfruty), kiwi, melon kantalupa, ananasy, czarne i czerwone porzeczki, truskawka, jagody czarnego bzu, maliny, jeżyny, brukselka, kapusta, kalafior, rzepa, cebula zwyczajna, szpinak, brokuły, groszek zielony, kalarepa, szparagi, jabłka, soja, ziemniaki, pomidory, karczochy.
Pierwiastki śladowe:
Pierwiastki śladowe - makro i mikroelementy. W organizmie człowieka pierwiastek śladowy stanowi mniej niż 0,01 % masy ciała (u dorosłego =< 7g). Zarówno niedobór jak i nadmiar jest szkodliwy. Pierwiastki śladowe są kofaktorami enzymów (metaloenzymy, metale aktywyjące enzymy) - np. LDH Zn, LAP Mn, Mg, Fe, Co, Zn,....
Podstawowe składniki żywej materii (H, C, N, O, S), makropierwiastki (Na, Mg, P, Cl, K, Ca), pierwiastki śladowe (Fe, Cu, Zn, Se, I, Co, Mn, Mo, Si, F, Ni, V, Cr).
Źródła pierwiastków śladowych - powietrze drogi oddechowe, z pożywieniem (produkty zwierzęce i roślinne, które są trudniej przyswajalne bo zawierają związki obniżające wchłanianie pierwiastków, np. fityniany i błonnik), wchłanianie do krwi, gdzie wiązane są z białkami nośnikowymi (w warunkach fizjologicznych wysycone są w niewielkim stopniu). W tkankach magazynowane są przez swoiste białka. Wydalanie odbywa się przez przewód pokarmowy i mocz.
Składniki diety - fukcje energetyczne, budulcowe, regulatorowe (witamina, woda, pierwiastki śladowe).
Występują w płynach ustrojowych w stężeniu poniżej 1 ၭg/g mokrej masy. Natomiast utlraśladowe mniej niż 1ng/g mokrej masy (Ni, V, Si, As).
Funkcje -
gr. I - nośniki ładunków elektrycznych w układach biologicznych (Na, K),
gr. II - tworzenie stabilnych kompleksów z enzymami, kwasami nukleinowymi i innymi ligandami. Przekaźnictwo nerwowo-mięśniowe. Mechanizm spustowy transdukcji sygnału (Ca, Mg).
gr. III - Tworzenie silnych kompleksów z enzymami. Udział w budowie hormonów (Fe, Zn, Cu, Co, Mn, Mo, Se, Ni, J, Cr, Si, F).
Niedobór powodowany jest złą dietą, zespołem złego trawienia i wchłaniania, nadmierną utratą (biegunki, wymioty), zwiększonym zapotrzebowaniem (ciąża, laktacja, okres wzrostu), interakcje metaboliczne z innymi pierwiastkami śladowymi.
Nadmiar i mechanizm toksyczności - hamowanie aktywności enzymów, zaburzenie struktury i funkcji kwasów nukleinowych, zaburzenie biosyntezy białka, wpływ na przepuszczalność błon.
Konsekwencje nadmiaru zależą od - postaci chemicznej, dawki, drogi podania, dystrybucji tkankowej, osiągnięcie stężenia w tkankach, szybkość wydalania.
METALOTIONEINY:
niskocząsteczkowe białka o dużej zawartości Cysteiny w jelitach, wątrobie (cytozol, jądro, lizosomy). Ich syntezę indukuja jony metali ciężkich.
Chronią ustrój przed toksycznym działaniem metali ciężkich. Zawarty w nich cynk może być zastąpiony przez kadm bądź rtęć, co chroni przed zatruciem tymi pierwiastkami.ŻELAZO, Fe:
Hemoglobina, mioglobina - Fe2+
Ferrytyna i transferrytyna - Fe3+
Związki porfirynowe zawierające żelazo to hemoglobina, mioglobina, centra aktywne enzymów takich jak: cytochromy, peroksydaza, katalaza (związki antyoksydacyjne).
Związki nieporfirynowe zawierające żelazo to transferryna, hemosyderyna, ferrytyna.
Żelazo wchłania się w dwunastnicy i jelicie cienkim w postaci Fe2+. Po wchłonięciu wiązane jest przez apoferrytynę w błonie śluzowej przewodu pokarmowego. Powstaje ferrytyna, a żelazo znajduje się wtedy na +3 stopniu utlenienia. We krwi transportowane jest przez transferynę. Magazynowane jest w wątrobie również w postaci ferrytyny. Ogólna zawartość żelaza w organiźmie człowieka wynosi 3-5 g, z tego ¾ uczestniczy w oddychaniu tkankowym
Niedobór spotyka się w stanach zwiększonego zapotrzebowania, zaburzeń wchłaniania lub zwiększonej utraty żelaza. W takim przypadku może wystąpić niedokrwistość. Należy wprowadzić suplementację preparatami żelaza. Powinno się stosować ją m.in: u osób po zabiegach operacyjnych z dużą utratą krwi, u osób z krwawieniami z przewodu pokarmowego, z dróg rodnych, kobiet ciężarnych, karmiących, przy obfitych menstruacjach, u wcześniaków, u dzieci po konflikcie serologicznym, u osób z zaburzeniami wchłaniania żelaza.
Źródła - wątroba, nerki, serce, orzechy, daktyle, szpinak, ryby, jaja.
Metabolizm żelaza:
*w pokarmie 10-20mg/dobę z czego 10% wchłania się w początkowym odcinku jelita cienkiego, w dwunastnicy;
*żołądek Fe3+ Fe2+
*w dwunastnicy i jelicie cienkim następuje wchłanianie Fe2+,
*osocze transferryna przejmuje Fe3+ z ferrytyny. Transferryna wiąże się z receptorem błonowym, co powoduje redukcję Fe3+ do Fe2+ i odłączenie białka.
Czynniki modulujące wchłanianie żelaza:
Ⴍ: dieta bogata w Fe, związki żelazowe, żelazo hemu, kwas askorbinowy, białka, niektóre cukry, aminokwasy, kwas solny, enzymy trawienne, wzrost erytropoezy, marskość wątroby, okres wzrostu, ciąża, niedobór Fe, atranferynemia, hemochromatoza samoistna.
Ⴏ: dieta uboga w Fe, kawa, herbata, związki żelazowe (Fe3+), fosforany, węglany, achlorchydia, resekcja żołądka, EDTA, desferoksamina, Co, Mn, Ni, Nadmiar Fe w ustroju, niedokrwistość aplastyczna, dieta bezbialkowa, toksyny wewnętrznie pochodne.
Wydalanie - z moczem, kałem, potem i złuszczającym się nabłonkiem, podczas miesiączki.
Przyczyny niedoboru - hiposyderemia - ostre i przewlekłe krwawienia, uposledzone wchłanianie, zmniejszona podaż (alkoholicy, wegetarianie, dieta mleczna), wzrost zapotrzebowania, zaburzone wykorzystywanie wchłoniętego żelaza (zaburzenia syntezy hemu), gromadzenie UŚŚ (nowotwory, zakażenia), niedobór transferryny (nerczyca, oparzenia, atransferynemia).
Przyczyny nadmiaru - hipersyderemia - wzrost Fe zapasowego, upośledzona erytropoeza, wzrost rozpadu RBC (niedokrwistość hemolityczna), wzrost uwalniania żelaza z uszkodzonych komórek wątroby (WZW), wzrost odkładania żelaza w komórkach nie wywołujące zmian w ich strukturze i funkcji.
Hematochromatoza - wzrost magazynowania żelaza w komórkach ze zmianami morfologicznymi i czynnościowymi w narządach (wątroba, trzustka, mięśnie, serce, śledziona, skóra). Triada objawów marskość wątroby, cukrzyca, przebarwienie skóry. Przyczyną jest defekt genetyczny, lub zwiększona podaż preparatami zawierającymi żelazo.
Zmiany stężenia żelaza w surowicy w żółtaczkach:
Ⴍ w żółtaczce miąższowej - uwalnianie Fe z magazynów wątrobowych na skutek uszkodzenia wątroby,
Ⴍ w żółtaczce hemolitycznej - uwalnianie żelaza z RBC,
Ⴏ w żółtaczce zastoinowej - upośledzone wchłanianie żelaza, ze względu na brak żółci.
Ocena laboratoryjna gospodarki żelazowej:
morfologia krwi (Hb, Ht, RBC, rozmaz krwi / szpiku), Hb (spadek w przewodnieniu i niedokrwistości, wzrost w odwodnieniu i nadkrwistości).
TIBC - całkowita zdolność wiązania żelaza. Jest jednym z parametrów umożliwiających dokładną ocenę wewnątrzustrojowej gospodarki żelazem. Jest miarą stężenia transferryny (transferryna mg/dl = 0,7 Ⴔ TIBC ၭg/dl).
TIBC wzrasta przy: niedoborze żelaza w organizmie, w przebiegu niedokrwistości z niedoboru żelaza, w czasie ciąży, w wyniku ostrej lub przewlekłej utraty krwi, podczas leczenia estrogenami.
W pierwszych czterech sytuacjach wiąże się to ze zużyciem zapasów żelaza i obniżeniem jego poziomu w surowicy.
TIBC maleje w zespole nerczycowym, w nowotworach i przewlekłych zakażeniach oraz w hemochromatozie i hemosyderozie. Jednoczesny spadek poziomu żelaza w pierwszych trzech przypadkach spowodowany jest obniżeniem poziomu białka-transferyny, która jest "magazynem" żelaza we krwi.
Innymi przyczynami obniżenia TIBC są: przeładowanie organizmu żelazem, mocznica, niedokrwistość chorób przewlekłych.
Ferrytyna - stężenie ferrytyny jest najbardziej czułym wskaźnikiem obniżenia zapasów ustrojowych żelaza. Pozwala na wykrycie spadku puli magazynowej żelaza (niedobór utajony), zanim pojawi się niedokrwistość. Spadek stężenia ferrytyny w surowicy odpowiada rzeczywistemu niedoborowi żelaza.
Krzywa żelazowa - ocena wchłaniania żelaza: na osobę 200-500 mg Fe3+. Oznacza się stężenie Fe na czczo, po 1, 2, 3, 4 i 6 h od podania żelaza. Maksymalne stężenie żelaza po 3 godzinach nie powinno przekraczać 100% wartości wyjściowej.
Zdolność komórek do pozyskiwania żelaza zależy od: stężenia transferryny i jej wysycenia żelazem, liczby TFR na powierzchni komórki.
MAGNEZ, Mg:
Magnez wchodzi w skład chlorofilu, jony magnezu odgrywają też dużą rolę w utrzymywaniu ciśnienia osmotycznego krwi i innych tkanek, oraz utrzymywaniu właściwej struktury rybosomów. Jest składnikiem kości, obniża stopień uwodnienia koloidów komórkowych, uczestniczy w przekazywaniu sygnałów w układzie nerwowym.
Zapotrzebowanie na magnez u osób dorosłych wynosi 300-400 mg na dobę i chociaż w naturalnym środowisku bogato występuje w spożywanych przez człowieka pokarmach, jest go coraz mniej w wyniku nawożenia chemicznego gleby związkami zawierającymi potas oraz stosowania nadmiernej ilości konserwantów żywności. Inne przyczyny niedoboru magnezu to: nadużywanie alkoholu, picie kawy, stosowanie hormonalnych środków antykoncepcyjnych, stres, spożywanie nadmiernych ilości tłuszczów, niewydolność nerek.
Magazynowanie - Ponad połowa magnezu znajduje się w kościach, jedna czwarta w mięśniach szkieletowych, jedna czwarta rozmieszczona jest w całym organizmie, przeważnie w układzie nerwowym i w narządach o dużej aktywności metabolicznej, jak: mięsień sercowy, wątroba, przewód pokarmowy, nerki, gruczoły wydzielania wewnętrznego i zewnętrznego, układ hemolimfatyczny.
Czynniki zwiększające wchłanianie magnezu - kwaśne pH, dieta bogata w białko, tłuszcze nienasycone.
Funkcje biochemiczne - aktywuje enzymy, uczestniczy w reakcjach enzymatycznych, agregacja rybosomów w polisomy, synteza białka, stabilizacja błon komórkowych.
Funkcje - utrzymanie sprzężenia łańcucha oddechowego, spadek pobudliwość nerwowo mięśniowej, uspokaja układ nerwowy i serce, działanie rozkurczowe na naczynia krwionośne, przeciwciała uczuleniom.
Przyczyny niedoboru - obniżona podaż w pokarmach, nadmierna utrata przez przewód pokarmowy, nadmierna utrata przez nerki.
Spadek stężenia magnezu - spadek syntezy hormonów tarczycy, wzrost adrenaliny i insuliny, wzrost lipozy, kwasów tłuszczowych, wzrost cholesterolu.
Objawy hipomagnezemii - zwiększenie pobudliwości nerwowo-mięśniowej oraz osłabienia i nieprawidłowości pracy serca, czego efektem są: drgania jednej z powiek, czy też częściowo górnych warg, bolesne skurcze łydek, uczucia odrętwienia i mrowienia w kończynach, objaw Raynauda (napadowy skurcz tętnic w obrębie rąk, rzadziej stóp. Powstający pod wpływem zimna, emocji lub bez uchwytnej przyczyny), wzmożone wypadanie włosów, łamanie się paznokci, próchnica zębów, rozdrażnienia, lęki, stan zagubienia, zespół niespokojnych nóg, zaburzenie depresyjne, trudności w koncentracji, zaburzenia snu, nocne poty, bóle głowy, mdłości, nagłe zawroty głowy, kołatanie serca, arytmii, nadciśnienie, miażdżyca, biegunka, nietolerancja glukozy, cukrzyca typu II, kamica nerkowa, bolesne miesiączkowanie, rzucawka okołoporodowa, zatrucie ciążowe, astma, migrena, zespół metaboliczny.
Spadek stężenia magnezu odbija się na układach: nerwowo-mięśniowym, sercowo-naczyniowym, pokarmowym, hormonalnym, immunologicznym.
Dieta bogato tłuszczowa hamuje wchłanianie magnezu, a nadmiar glukozy powoduje przejściową magnezurię.
Nadmiar magnezu z organizmu jest usuwany przez nerki. Istnieje pewna możliwość przedawkowania preparatów magnezu. Ryzyko to dotyczy więc szczególnie pacjentów starszych, ze znacznie upośledzoną funkcją nerek. Możliwe objawy obejmują: niedociśnienie, nadmierne spowolnienie akcji serca - bradykardia, niewydolność oddechowa, osłabienie odruchów - hyporeflexia
Źródła magnezu w pożywieniu: nigari, kakao gorzkie, kasza gryczana, fasola biała, czekolada gorzka, orzechy laskowe, płatki owsiane, ciecierzyca, groch, szpinak, ryby.
Diagnostyka - stężenie magnezu w surowicy (zjonizowanego magnezu), stężenie w erytrocytach.
CYNK, Zn:
zawartość w organizmie 2 mg, z czego 99% wewnątrzkomórkowo (ok. 66% mięśnie szkieletowe, 3% wątroba).
Dobowe zapotrzebowanie 2 mg, wchłanianie jelito cienkie.
Wchłanianie - kwas piko linowy (czynnik wiążący i transportujący). Wzrost wchłaniania aminokwasy i peptydy, spadek wchłaniania błonnik, miedź i wapń.
Transportowany w surowicy, około 70% związany z albuminami.
Funkcje - składnik enzymów, aktywator enzymów, inhibitor enzymów, stabilizuje błony lizosomalne, prawidłowy rozwój gonad męskich, konieczny do syntezy insuliny, ACTH, testosteronu, GH, DNA, niezbędny do osi przysadka-nadnercza, pobudza odporność komórek, składnik dehydrogenazy-reduktazy retinalu, wpływ na uruchomienie witaminy A z wątroby.
Enzymy cynko zależne - dehydrogenazy: alkoholowa, jabłczanowa, mleczanowa.
Niedobory - nerczyca, zespoły złego wchłaniania, infekcje, niedokrwistość, wady wrodzone, złe gojenie się ran, zapalenia skóry i utratę owłosienia, złą tolerancję glukozy, biegunki.
Objawy niedoboru - zahamowanie wzrostu, zmiany skórne, obniżenie odporności, brak łaknienia.
Cynk działa leczniczo na wrzody żołądka, uporczywe żylaki, reumatyzm, owrzodzenia, trądzik, choroby skórne.
Nadmiar cynku - powoduje różne zaburzenia, przede wszystkim w układzie krążenia. W porównaniu z innymi pierwiastkami śladowymi cynk jest znacznie mniej toksyczny dla zwierząt i człowieka. Ostre zatrucie cynkiem objawia się głównie niedokrwistością i wymiotami oraz ogólnym osłabieniem. Szkodliwość cynku jest związana głównie z wtórnym deficytem miedzi i nie wywołuje objawów specyficznych. Zatrucia ludzi cynkiem następują głównie w wyniku spożycia owoców lub warzyw opryskanych preparatami cynkowymi oraz produktów przechowywanych w naczyniach cynkowych.
Źródła - Najlepszym źródłem cynku są: ostrygi, jadalne wodorosty, mięso, mleko kobiece, mleko krowie i kozie, żółtko jaja, drożdże, pełne ziarno, rośliny strączkowe, pokarm bogaty w proteiny, otręby, orzechy, pestki dyni oraz nierafmowane pokarmy. Rośliny zawierające cynk to: lucerna, korzeń łopianu, rumianek, mniszek lekarski, świetlik, nasiona kopru, chmiel, pokrzywa, owoce dzikiej róży i szałwia.MIEDŹ, Cu:
zawartość w organizmie ok. 150 mg.
Wchłanianie górny odcinek jelita cienkiego.
Stężenie 11,2 - 20,4 μmol/l.
Miedź jest mikroelementem występującym w centrach aktywnych wielu enzymów. Znajduje się tam, ze względu na łatwość pobierania i oddawania elektronu w czasie zmiany stopnia utlenienia.
Funkcje - potrzebna jest do tworzenia się krwinek czerwonych, wchodzi w skład hemocyjaniny, wpływa pozytywnie na błonę otaczającą komórki nerwowe, bierze udział w przesyłaniu impulsów nerwowych. Wchodzi w skład dysmutazy ponadtlenkowej, enzymu o działaniu przeciwutleniającym, chroniącego błony komórkowe przed wolnymi rodnikami. Ponadto bierze udział w tworzeniu tkanki łącznej (wiązania krzyżowe w cząsteczkach kolagenu i elastyny katalizowane przez oksydazę lizylową) i syntezie prostaglandyn, związków zwanych hormonami miejscowymi, wpływających między innymi na czynność serca i ciśnienie tętnicze krwi. Ponadto bierze udział w biosyntezie mieliny, metabolizmie glukozy, sterydów, wchłanianiu i transporcie żelaza, przemianach zasad purynowych.
Genetycznie uwarunkowany defekt metabolizmu miedzi prowadzi do wystąpienia schorzenia zwyrodnienia wątrobowo-soczewkowego choroby Wilsona.
Niedobór miedzi może stać się przyczyną niedokrwistości, ponieważ zbyt mała ilość tego pierwiastka powoduje gorsze wchłanianie żelaza i zmniejszenie liczby czerwonych krwinek. Ponadto przypuszcza się, że powoduje uszkodzenie serca i tętnic, zaburzenia pracy systemu nerwowego, np. mrowienia, brak koncentracji. Niewystarczająca ilość miedzi obniża również ilość białych krwinek, a zatem zmniejsza odporność organizmu na infekcje. Niedobór miedzi zaburza również gospodarkę lipidową organizmu - powoduje wzrost poziomu trójglicerydów we krwi, niealkoholowe stłuszczenie wątroby (NASH) oraz zaburzenia syntezy dopaminy i melaniny, które objawiają się złym samopoczuciem.
Spożywanie nadmiaru miedzi prowadzić może do zaburzeń pokarmowych i uszkodzenia wątroby. Może to mieć miejsce w przypadku spożywania wody pitnej o niskiej twardości lub niskim pH dostarczanej miedzianą instalacją wodociągową (woda taka wypłukuje miedź z instalacji). Dawka śmiertelna miedzi zawarta jest w około 30 g siarczanu miedzi. Dopuszczalne górne spożycie wynosi 10 mg/dzień dla dorosłych. Objawy zatrucia są podobne do zatrucia arszenikiem.
Źródła - występuje w wołowinie, sałacie, grzybach, owocach morza (ostrygi, homary), gotowanych podrobach, ale można ją znaleźć również w chlebie gruboziarnistym, warzywach strączkowych, owocach awokado i kiwi.FLUOR, F:
Fluor w odpowiednich ilościach jest pierwiastkiem niezbędnym dla prawidłowego rozwoju kości i zębów (odkłada się w nich w postaci fluoroapatytu).
Toksyczność - Pierwiastkowy fluor jak i jony fluorkowe są silnie toksyczne. Zaburza procesy enzymatyczne w komórkach hamując oddychanie tkankowe, przemianę węglowodanów, lipidów oraz syntezę hormonów. Ma niekorzystny wpływ na układ kostno stawowy, naczynia krwionośne, układ krzepnięcia, narządy miąższowe. Sam fluor i niektóre jego związki działają żrąco powodując głębokie martwice.
Po podaniu doustnym w dużych stężeniach związki fluoru powodują zatrucia ostre, na skutek żrącego działania wydzielającego się fluorowodoru. Dalsze objawy to płytki oddech, kurcz dłoni, drgawki, ślinotok i nudności. Bezpośrednią przyczyną zgonu w wyniku zatrucia fluorem jest porażenie ośrodka oddechowego.
Zatrucia przewlekłe małymi dawkami fluoru (fluoroza) objawiają się zaburzeniami w uwapnieniu kości, brunatnym cętkowaniem zębów, zmniejszeniem ruchliwości.
Dozwolone maksymalne stężenie przy założeniu 8-godzinnej ekspozycji na działanie fluoru to 0,05mg/m3.MANGAN, Mn:
Mangan obecny jest w centrach reaktywności wielu enzymów i jest niezbędnym do życia mikroelementem. Jego minimalne, dzienne spożycie powinno wynosić ok. 1 mg. W dużych ilościach sole manganu są toksyczne.
Wydalany jest z żółcią.
Funkcje - skład metaloenzymów, kofaktor enzymów, kofaktor fosforylacji oksydacyjnej, metabolizm kości.
Nadmiar może sprzyjać rozwojowi demencji, schizofrenii oraz pogłębiać chorobę Parkinsona. Niedobór powoduje opóźnienie w rozwoju fizycznym.
Źródła - czarna herbata, orzechy, syrop klonowy, buraki, żurawina, drożdże.
Toksyczność - ogólne wyczerpanie, uszkodzenie wątroby, objawy psychiczne.KRZEM, Si:
Organizm ludzki potrzebuje 20-30 mg krzemu dziennie. Większej dawki wymagają kobiety w ciąży, osoby po operacjach kostnych oraz ludzie starsi, gdyż ilość tego pierwiastka w narządach maleje z wiekiem.
Występowanie - przede wszystkim w tkance łącznej, z której zbudowane są ścięgna, błony śluzowe, ściany naczyń krwionośnych, zastawki serca, skóra i układ kostno-stawowy.
Funkcje - usuwa z komórek substancje toksyczne, korzystnie wpływa na naczynia włosowate, uszczelniając je, zwiększa wytrzymałość tkanki kostnej, wzmacnia zdolność obronną organizmu przeciw zakażeniom, zapobiega przedwczesnemu starzeniu się. Usuwa podrażnienia i stany zapalne skóry, poprawiając jej ogólny wygląd i zapobiegając wiotczeniu, ogranicza wypadanie włosów, przyspiesza ich wzrost, wzmacnia paznokcie. Jest on również używany do budowy ścian komórkowych niektórych organizmów oraz stanowi centrum reaktywności kilkunastu enzymów.
Patogenne działanie - kamica układowa.MOLIBDEN, Mo:
Jest składnikiem enzymów.KOBALT, Co:
Kobalt jest jednym z mikroelementów i jest obecny w centrach reaktywności kilku enzymów. Zapotrzebowanie dobowe na ten pierwiastek jest jednak bardzo małe - 0,05 ppm. Wchodzi również w skład kobalaminy (witaminy B12).
Niedobór - Zaburzenia procesu krzepnięcia krwi.WANAD, V:
Ocenia się, że dobowe spożycie wanadu wynosi 10-60 mikrogramów, a zalecane dzienne spożycie 10 mikrogramów. Nie stwierdza się niedoborów wanadu u prawidłowo odżywiających się osób.
Przemysłowe i środowiskowe zatrucia wanadem - uszkodzenie nerek, podrażnienie błon śluzowych układu oddechowego i pokarmowego.
Suplementacja stosowana przez kulturystów (do 60 miligramów wanadu) nie ma uzasadnienia i może być szkodliwa.
Wanad jest pierwiastkiem znajdującym się w centrach aktywnych enzymów przemiany glukozy i innych węglowodanów.SELEN, Se:
Źródła selenu w pożywieniu: zboża, mięso, jaja, nabiał, ryby i skorupiaki.
Nie wszystkie pokarmy są dobrym źródłem selenu, bowiem pierwiastek ten nie w każdej postaci jest dobrze wchłaniany w przewodzie pokarmowym. Podstawową rolę w biodostępności odgrywa forma chemiczna selenu.
Najwyższą bioprzyswajalnością charakteryzuje się selen pozyskiwany z drożdży.
Wchłanianie selenu wzmagają białka małomolekularne oraz witaminy (głównie A, E, C). Synergiczne działanie selenu z witaminą E przyczynia się do opóźniania procesów starzenia oraz przyspieszenia regeneracji komórek.
Funkcje - Jest on konieczny do prawidłowego funkcjonowania układów enzymatycznych. Najważniejszą jego funkcją jest tworzenie silnego antyutleniacza, enzymu zwanego peroksydazą glutationową. Chroni on czerwone krwinki i błony komórkowe przed szkodliwym wpływem wolnych rodników. Ważny jest także dla funkcjonowania układu odpornościowego oraz tarczycy. Wraz z innymi przeciwutleniaczami chroni serce przed działaniem wolnych rodników, pomaga w walce z depresją, przemęczeniem i nadmierną nerwowością. Redukuje ilość szkodliwych związków przyczyniających się do powstawania reumatoidalnego zapalenia stawów. Selen zapobiega powstawaniu zmian nowotworowych w różnych narządach i tkankach. Liczne badania potwierdzają, że selen zmniejsza ryzyko występowania wszystkich nowotworów a w szczególności raka wątroby, prostaty, jelita grubego oraz raka płuc. Zalecane dobowe spożycie selenu wynosi dla osób dorosłych 55 mikrogramów.
Konieczność suplementacji selenu występuje u palaczy, u mieszkańców terenów ubogich w selen, u osób pozostających na całkowitym żywieniu pozajelitowym (pareneteralnym), osoby z ciężkim uszkodzeniem funkcji wchłaniania składników pokarmowych (np. choroba Leśniowskiego-Crohna, stan po usunięciu znacznej części jelita cienkiego). Suplementacja diety selenem jest zalecana w leczeniu chorób sercowo-naczyniowych, niepłodności, zapalenia trzustki i astmy.
Nadmiar selenu jest szkodliwy i uważa się że przekroczenie dawki 400 mikrogramów na dobę może prowadzić do objawów zatrucia.
Niedobór selenu przyczynia się do ograniczenia sprawności układu odpornosciowego oraz w niektórych przypadkach do intensyfikacji postępów choroby. Niedobór selenu stwierdza się również w przypadku reumatoidalnego zapalenia stawów.
Niedobór objawia się powiększeniem i niewydolnością serca, a także objawami wola, i niedoczynności tarczycy. Czyni również organizm bardziej podatnym na działanie związków rakotwórczych. Niedobór u kobiet w ciąży może powodować nieodwracalne zmiany płodu, zwiększa ryzyko zachorowania na choroby serca i wątroby.
Enzymy i Inhibitory:
Enzymy obniżają energię aktywacji:
Enzymy są podstawą istnienia życia, jako że są niezbędne do zajścia niemal każdej reakcji chemicznej z szybkością i wydajnością znacząco wysoką dla procesów biologicznych. Bez enzymów większość reakcji zachodziła by zbyt wolno lub zbyt mało wydajnie, by miało to zauważalne w czasie znaczenie
Mechanizmy katalizy: S-substrat, P-produkt: E+S ↔ ES ↔ EP ↔ E+P
Budowa miejsca (centrum) aktywnego - miejsce katalityczne:
*obszar wiążący substraty i grupy prostetyczne, *zajmuje małą część cząsteczki, *jest układem przestrzennym, *od niego zależy specyficzność wiązania, *w zagłębieniu powierzchni enzymu.
Miejsce aktywne, centrum aktywne, centrum katalityczne to ta część cząsteczki, która jest bezpośrednio zaangażowana w reakcji chemicznej. W przypadku prostych cząsteczek, takich jak np. kwasy nieorganiczne w reakcję zaangażowana jest cała cząsteczka. W przypadku dużych i złożonych cząsteczek, takich jak np. enzymy, polimery syntetyczne i niektóre rozbudowane związki metaloorganiczne tylko niewielka część cząsteczki jest rzeczywiście zaangażowana w reakcję a jej reszta pozostaje praktycznie bierna.
W obszarze centrum aktywnego wyróżnia się miejsce wiązania substratu (określające swoistość) oraz miejsce katalityczne (reakcja).
Aminokwasy - kontaktowe (wiążą substrat, biorą udział bezpośrednio w katalizie), pomocnicze (nie stykają się z substratem ale pełnią określoną rolę w katalizie, stabilizując strukturę przestrzenną).
Miejsce wiążące efektor to centrum allosteryczne.
Swoistość enzymów:
-zależy od różnic w budowie centrum aktywnego i zdolności konformacyjnego przystosowania się do substratu.
-budowa miejsca wiążącego substrat decyduje o swoistości względnej substratu.
Stereospecyficzność enzym działa tylko na jeden z izomerów optycznych.
Model "klucza i zamka" (ang. "Lock and key" model) - 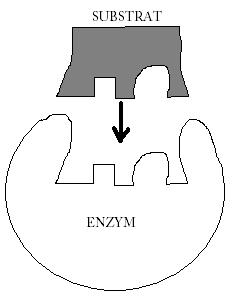
W większości przypadków enzymy są niezwykle specyficzne wobec swoich substratów. Jak sugerował w roku 1894 Hermann Emil Fischer, zarówno enzym jak i jego substraty są do siebie geometrycznie dopasowane w taki sposób, że idealnie pasują jeden do drugiego (jak "klucz i zamek"). Model ten wyjaśnia specyficzność enzymów, ale nie wyjaśnia w jaki sposób stabilizowany jest stan przejściowy podczas reakcji enzymatycznej.
Model wymuszonego dopasowania (ang. Induced fit model) - 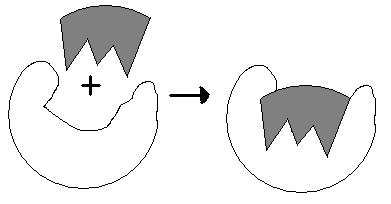
W 1958 roku Daniel Koshland zaproponował modyfikację modelu "klucza i zamka". Ponieważ enzymy są zwykle dość elastyczne strukturalnie, ich centrum aktywne podlega ciągłym rearanżacjom przestrzennym podczas oddziaływania z substratami. W rezultacie, substrat nie tyle wiąże się do niezmiennego strukturalnie miejsca aktywnego, ale grupy boczne aminokwasów je tworzące podlegają rearanżacjom przestrzennym, ściśle dopasowując swe pozycje do wiązanego substratu, co dopiero umożliwia przeprowadzenie katalizy. W niektórych wypadkach, jak np. glikozydazy, także cząsteczki substratu podlegają lekkim zmianom strukturalnym po wejściu do centrum aktywnego, wzmacniając w ten sposób dopasowanie. Centrum aktywne kontynuuje rearanżację, aż osiągnięte zostanie końcowe stadium dopasowania z substratem.
Enzymy mogą na kilka różnych sposobów zmniejszać swobodną energię aktywacji Gibbsa (ΔG‡):
*Obniżanie energii aktywacji przez tworzenie środowiska, w którym następuje stabilizacja stanu przejściowego (np. zniekształcenie cząsteczki substratu - dzieje się to przez utrwalenie konformacji stanu przejściowego pomiędzy substratem, a produktem oraz zniekształcenie przez enzym wiązań w cząsteczce substratu, dzięki czemu zmniejsza się suma energii wymaganej do zakończenia przejścia).
*Obniżanie energii stanu przejściowego przez likwidację niekorzystnych energetycznie oddziaływań ze środowiskiem, i ich zamianę na korzystne energetycznie oddziaływania z centrum aktywnym (np. oddziaływania elektrostatyczne ładunków o przeciwnych znakach).
*Wykorzystanie alternatywnego szlaku przejścia, np. tymczasowa reakcja substratu do pośredniego kompleksu enzym-substrat (ES), która nie byłaby możliwa w nieobecności enzymu.
*Zmniejszanie entropii reakcji poprzez usytuowanie dostarczanych razem substratów w poprawnej orientacji, niezbędnej do zajścia reakcji. Rozpatrując energetykę reakcji enzymatycznej pod kątem jedynie zmiany entalpii (ΔH‡), efekt ten jest zwykle pomijany. Wiąże się to z faktem, że ma on miejsce tylko dla stanu podstawowego reakcji (substraty), a jego wpływ na właściwą katalizę jest znikomo mały.
Aktywność wielu enzymów może być hamowana przez różne typy inhibitorów. Inhibicja taka może być odwracalna lub nieodwracalna. Ostatnia ma miejsce wtedy, gdy cząsteczki inhibitora wiążą się z enzymem trwale (np. kowalencyjnie), co doprowadza do sytuacji zablokowania aktywności danej cząsteczki enzymu na stałe.
Inhibicja może być odwracalna (kompetencyjna, akompetencyjna, niekompetencyjna) bądź nieodwracalna.
Inhibicja odwracalna:
kompetencyjna - inhibitor i substrat współzawodniczą o miejsce aktywne cząsteczki enzymu. Związanie przez enzym cząsteczki inhibitora uniemożliwia zatem związanie substratów (i vice versa) i kompleks enzym-inhibitor (EI) jest enzymatycznie nieaktywny. Zazwyczaj inhibitor kompetycyjny jest strukturalnie bardzo podobny (lub ma podobny motyw bezpośrednio wiążący się do centrum aktywnego) do prawdziwego substratu dla określonego enzymu.
Innymi słowy w reakcji z enzymem łączy się substrat LUB inhibitor.
akompetencyjna - W inhibicji akompetycyjnej inhibitor nie może się wiązać do wolnego enzymu, a jedynie do kompleksu enzym-substrat (ES), tworząc kompleks enzym-inhibitor-substrat (EIS). Ponieważ w takiej sytuacji zmniejszone jest stężenie kompleksu ES, zwiększa to pozorne powinowactwo enzymu do substratu. Utworzony kompleks EIS jest enzymatycznie nieaktywny i reakcja nie może być kontynuowana, dopóki miejsce aktywne enzymu nie zostanie zwolnione, co obniża Vmax w porównaniu do reakcji nieinhibowanej. Ten typ inhibicji jest dość rzadki i może dotyczyć niektórych enzymów multimerycznych (wielopodjednostkowych).
niekompetencyjna - Inhibitory niekompetycyjne mogą się wiązać do wolnego enzymu, jednak nigdy do jego miejsca aktywnego, wobec tego nie konkurują z substratami, które także mogą się przyłączyć do powstałego kompleksu. Oba możliwe kompleksy, enzym-inhibitor (EI) i enzym-inhibitor-substrat (EIS) są enzymatycznie nieaktywne. Ponieważ wiązanie inhibitora jest całkowicie niezależne od substratu, co oznacza, że większe stężenie substratu nie wpływa na obniżenie oddziaływań z inhibitorem (w przeciwieństwie do inhibicji kompetycyjnej), zatem zmienia się tylko wartość Vmax, Km pozostaje stałe.
Inhibicja mieszana - Ten typ inhibicji przypomina inhibicję niekompetycyjną, z wyjątkiem występowania dodatkowo kompleksu enzym-inhibitor-substrat (EIS), mającego znikomą aktywność enzymatyczną. W inhibicji mieszanej obie wartości opisujące reakcję enzymatyczną: Km i Vmax, zmieniają się
Inhibicja nieodwracalna - Inhibitory nieodwracalne reagują z enzymem, wiążąc się kowalencyjnie, a zatem nieodwracalnie, do jego łańcuchów białkowych. Taka inhibicja trwale unieczynnia daną cząsteczkę enzymu. Penicylina i aspiryna mają podobny mechanizm działania. Inhibitory te wstępnie, jeszcze nie kowalencyjnie, wiążą się z miejscami aktywnymi enzymów, po czym dopiero aktywność enzymu przekształca je w reaktywne formy, które wiążą się nieodwracalnie z jedną lub więcej resztami aminokwasowymi miejsca aktywnego enzymu, blokując je.
Sposoby wyrażania aktywności enzymów:
Miarą aktywności enzymów jest szybkość katalizowanej reakcji.
UI lub IU - jednostka międzynarodowa aktywności enzymatycznej/
Jest to ilość enzymu, który katalizuje przemianę jednego mikromola substratu w ciągu 1 minuty w optymalnych warunkach reakcji (pH), w temperaturze 30oC, przy pełnym wysyceniu enzymu substratem.
Stężenie aktywności w roztworze wyraża się jednostką na cm3.
Aktywność właściwa - określa stopień czystości preparatów enzymatycznych. Liczba jednostek standardowych przypadająca na 1 mg białka.
Aktywność molekularna - reaktywność enzymu [Ul/μmol].
Katal - aktywność, która przekształca 1 mol w czasie 1 sekundy w optymalnym pH, temperaturze i przy całkowitym wysyceniu enzymu substratem. [mol/sek]
Allosteryczny - „występujący w dwóch stanach konformacyjnych” lub „mający efekt w innym miejscu niż wystąpiło oddziaływanie”.
Hamowanie przez sprzężenie zwrotne lub przez produkt końcowy lub retroinhibicję. Enzymy allosteryczne mają pozytywne i negatywne modulatory aktywności.
Wpływ metali na enzymy:
W metaloenzymie określono ilość metali mocno związanych z białkiem enzymatycznym.
Mg2+ enzymy przekształcające ATP.
IZOENZYMY:
Izoenzymy to homologiczne enzymy w obrębie danego organizmu, które katalizują tę samą reakcję, ale różnią się nieznacznie strukturą, wartościami Km i Vmax oraz właściwościami regulacyjnymi. Izoenzymy ulegają ekspresji w różnych tkankach lub organellach w różnych stadiach rozwojowych. Są kodowane przez geny zajmujące różne loci, które zwykle powstają w wyniku duplikacji genu i dywergencji. Izoenzymy można często odróżnić od siebie na podstawie właściwości biochemicznych, takich jak ruchliwość elektroforetyczna.
Przykładem izoenzymu może być dehydrogenaza mleczanowa (LDH), enzym uczestniczący w beztlenowym metabolizmie glukozy i syntezie glukozy. W organizmie człowieka istnieją dwa izozymowe łańcuchy polipeptydowe tego enzymu: izozym H, ulegający silnej ekspresji w sercu i izozym M, występujący w mięśniach.
LDH - dehydrogenaza mleczanowa:
LDH1 - izoenzym H, mięsień sercowy,
LDH2 - izoenzym M4, wątroba, mięśnie,
LDH3 - H2M2, nadnercza, śledziona, erytrocyty.
HBDH - szybkie izoenzymy (LDH1 i LDH2).
Fosfokinaza keratynowa - CPK, Kinaza keratynowa - CK:
Katalizuje odwracalną reakcję przenoszenia grupy fosforanowej bądź z fosfokreatyny na ADP regenerując ATP lub z ATP na kreatynę odbudowując zapasy fosfokreatyny. Dlatego CK jest enzymem kluczowym w bioenergetyce komórki, odgrywając ważną rolę w homeostazie komórkowego ATP.
fosforan kreatyny + ADP ↔ kreatyna + ATP
W tkankach i komórkach o wysokim zapotrzebowaniu energetycznym, takich jak mięśnie szkieletowe, gładkie, a także mózg, plemniki i komórki fotoreceptorowe, stężenie fosfokreatyny zdecydowanie przewyższa stężenie ATP. Podczas aktywacji komórki kinaza kreatynowa z zapasów fosfokreatyny regeneruje ATP, który jest głównym źródłem energii w reakcjach biochemicznych.
Enzymy CK dzielą się na podtypy: M- muscle oraz B- brain.
Cytoplazmatyczne dimeryczne formy kinazy kreatyninowej:
MB - m. sercowy,
BB - mózg, prostata, płuco jelito,
MB - m. szkieletowy..
Izoenzymy:
CK-MM, CK-BB, CK-MB.
Wzorce izoenzymów różnią się w zależności od tkanki. CK-BB rzadko osiąga znaczącą ilość w krwiobiegu. Mięśnie szkieletowe wytwarzają CK-MM (98%) i CK-MB. Mięsień sercowy natomiast wytwarza CK-MM w 70% i CK-MB w 30%.
W chorobach układu sercowego czy mózgu we krwi pojawia się MB i BB.
Diagnostyka:
Badania aktywności kinazy kreatynowej w surowicy wykorzystuje się w diagnostyce medycznej. Podwyższony poziom CK świadczy przede wszystkim o uszkodzeniu tkanek, szczególnie mięśni. Oznacza zatem kontuzje, nadmierny wysiłek fizyczny, choroby mięśnia sercowego, zawał serca, choroby ośrodkowego układu nerwowego, wylewy, napady epileptyczne lub intensywną radioterapię. Może również pojawiać się na przykład przy niedoczynności tarczycy lub w chorobach mięśni, a czasami (ok 1% przypadków) także przy zażywaniu leków z grupy statyn, obniżających stężenie cholesterolu we krwi.
Izoenzym sercowy kinazy kreatynowej (CK-MB) jest markerem martwicy mięśnia sercowego. Podwyższony poziom wskazuje na ataki serca (dziś jest to coraz rzadziej stosowane badanie).
Obniżony poziom CK może oznaczać alkoholową chorobę wątroby lub reumatoidalne zapalenie stawów (RZS).
Podział strukturalny enzymów:
*monomeryczne (zbudowane z pojedynczego łańcucha polipeptydowego),
*oligomeryczne (zbudowane z identycznych podjednostek, zbudowane z nieidentycznych podjednostek),
*kompleksy wieloenzymatyczne (MC- multienzyme complexes):
-asocjacja kilku enzymów
-układ funkcjonuje ekonomicznie
-reakcja może przebiegać przy niższych stężeniach substratów
-wzrost prawdopodobieństwa zetknięcia się substratów z centrum aktywnym i utrudnia przenikanie inhibitorów.
EKTOENZYMY:
Enzymy związane z błonami o charakterze ektobiałek. Występują na zewnątrz komórki. Uwalniane z błon w wyniku solubilizacji czynnikami litofilnymi (kwasy żółciowe).
Przykład - GGTP, Fosfataza alkaliczna, Lipaza lipoproteinowa (LPL) i wątrobowa (HTGL).
ENZYMY WAŻNE KLINICZNIE:
Fosfataza alkaliczna: 580 - 1400 nkat/l, czyli 35 - 84 Ul/l.
wzrost aktywności - uszkodzenia wątroby, cholestaza, ciąża, okres wzrostu, choroby kości.
Fosfataza kwaśna: 30 - 90 nkat/l, czyli 1,8 - 5,4 Ul/l.
wzrost aktywności - rak prostaty lub jej uszkodzenie, zabiegi na prostacie, stany zatorowo-zakrzepowe.
PODZIAŁY ENZYMÓW:
1. W celu uregulowania i ujednoznacznienia nazewnictwa enzymów, Komitet Nazewnictwa (ang. Nomenclature Committee) Międzynarodowej Unii Biochemii i Biologii Molekularnej (ang. International Union of Biochemistry and Molecular Biology) w latach 1956-1972 opracował dla nich nomenklaturę naukową - numer EC. Według niej, każdy enzym jest opisany przez ciąg czterech segmentów cyfr, oddzielonych od siebie kropką, poprzedzonych literami "EC" (Enzyme Commission lub Enzyme Catalogue): EC x.xx.xx.xx.
Pierwsza cyfra dzieli enzymy, według mechanizmu reakcji przez nie katalizowanych, na sześć głównych klas:
EC 1 oksydoreduktazy: katalizują reakcje utleniania i redukcji,
EC 2 transferazy: przenoszą grupy funkcyjne,
EC 3 hydrolazy: katalizują hydrolizę różnych wiązań,
EC 4 liazy: rozcinają różne wiązania na drodze innej niż hydroliza czy utlenianie,
EC 5 izomerazy: katalizują zmiany izomeracyjne cząsteczek,
EC 6 ligazy: łączą cząsteczki wiązaniami kowalencyjnymi.
Następne liczby numeru EC oddzielone kropkami klasyfikują dany enzym odpowiednio do podklasy i podpodklasy, natomiast ostatnia liczba określa miejsce enzymu w podpodklasie.
W nazewnictwie enzymów zaleca się stosowanie numeru EC, jednak dopuszcza się stosowanie nazw zwyczajowych z przyrostkiem -aza, gdzie pierwszy człon określa reakcję, a drugi jej substrat, a także innych ogólnie przyjętych nazw roboczych i zwyczajowych, co także jest regulowane stosownymi zaleceniami.
Syntazy - liazy (enzymy rozbijające niehydrolityczne wiązania C-C, C-O, C-N, C-S, C-Cl i usuwające z substratu lub dołączające pewne grupy).
Syntetazy - ligazy (enzymy katalizujące syntezę, związane z rozbiciem wiązania pirofosforanowego w ATP lub innych nukleotydach wysokoenergetycznych).
2. Podział diagnostyczny enzymów:
W latach 60 Richterich i Hess stworzyli kliniczny podział enzymów osocza na:
*sekrecyjne (wydzielnicze) - należą do nich min. czynniki krzepnięcia krwi oraz fibrynolizy, esterazy cholinowe, ceruloplazmina i lipaza lipoproteinowa. Po uszkodzeniach komórek wątroby zachodzi spadek ich aktywności, ponieważ ich ilość zależy od syntezy w rybosomach wątroby. Znaczenie diagnostyczne ma spadek ich aktywności.
*wskaźnikowe (indykatorowe) - pojawiają się w dużych ilościach po uszkodzeniu narządów(stąd ich potoczna nazwa - nekroenzymy). Zawartość enzymu wskaźnikowego jest zależna od jego ilości w uszkodzonej tkance, liczby uszkodzonych komórek i stopnia ich uszkodzenia, a także rozmieszczenia enzymów w różnych narządach. Do celów dydaktycznych można je podzielić na swoiste i nieswoiste narządowo. Należą do nich kinaza keratynowa (CPK, CK), aminotransferaza alaninowa (AlAT, GPT), aminotransferaza asparaginowa (AspAT, GOT), dehydrogenaza mleczanowa (LDH). Znaczenie diagnostyczne ma wzrost ich aktywności.
*ekskrecyjne (wydalnicze) - przeszkoda w normalnym odpływie różnych wydzielin ustrojowych, takich jak: żółć, sok trzustkowy, ciecz sterczowa czy ślina, powoduje zastój wydzieliny i przedostanie się enzymów do krwiobiegu. Do tej grupy należą enzymy soku trzustkowego(amylaza, lipaza, DNA-aza, RNA-aza, trypsyna, chymotrypsyna), żółci (fosfataza zasadowa, GGTP, leucyloaminopeptydaza - konstelacja żółci), fosfataza kwaśna płynu sterczowego, amylaza ślinianek i enzym gruczołów wydalniczych żołądka czyli pepsyna. Znaczenie diagnostyczne ma wzrost ich aktywności.
MAKERY ENZYMATYCZNE:
Zawał serca:
-CPK,
-AspAT,
-AlAT,
-LDH (HBDH)
Uszkodzenie wątroby:
-AlAT,
-AspAT,
-LDH (LDH 4,5)
Cholestaza:
-GGTP,
-FA,
-LAP
Uszkodzenie trzustki:
-α-amylaza
Uszkodzenie mięśni szkieletowych:
-CPK,
-AspAT,
-AlAT
Nowotwory prostaty:
- FK (AcP)
ENZYMY WAŻNE KLINICZNIE:
GGTP - Gamma-glutamylotranspeptydaza - enzym wskaźnikowy związany z przemianą aminokwasów.
Podwyższenie jego stężenia spotykane jest w:
-upośledzeniu wydzielania enzymu z żółcią (żółtaczka zastoinowa, cholestaza wewnątrzwątrobowa i zewnątrzwątrobowa)
-intensywnym nowotworzenie się tkanek, czyli intensywnych przemianach aminokwasów i białek (nowotwory o dużej dynamice wzrostu, nowotwory wątroby, faza tworzenia się blizny po zawale mięśnia serca)
-w przypadku indukcji enzymów mikrosomalnych wątroby substancjami takimi jak leki (zwłaszcza przeciwpadaczkowe), alkohol.
Normy: 17-85 nkat/l, lub 1-5 Ul/l.
AlAT (Aminotransferaza alaninowa, ALT, GPT, SGPT) - narządowo niespecyficzny enzym indykatorowy, biorący udział w przemianach białek. Należy do transferaz przenoszących grupy aminowe z aminokwasów na α-ketokwasy.
Podwyższenie jego stężenia spotykane jest w:
-uszkodzeniach wątroby,
-zawale mięśnia sercowego,
-uszkodzeniach mięśni,
-ostrym zapaleniu trzustki.
Normy: do 510 nkat/l, lub do 30 Ul/l.
Aminotransferaza alaninowa cytosolowa przekształca pirogronian w alaninę, zaś mitochondrialna przekształca alaninę w pirogronian:
glutaminian + pirogronian ——AlAT——> alfa-ketoglutaran + alanina
AspAT (Aminotransferaza asparaginianowa, AST, GOT) - narządowo niespecyficzny enzym indykatorowy, biorący udział w przemianach białek. Należy do transferaz przenoszących grupy aminowe z aminokwasów na α-ketokwasy.
Podwyższenie jego stężenia spotykane jest w:
-zawale mięśnia sercowego,
-uszkodzeniu mięśni,
-uszkodzenia wątroby,
-ostrym zapaleniu trzustki.
Normy: tak jak AlAT.
Z uwagi, że rutynowo określa się zarówno poziom AlAT jak i AspAT, do diagnostyki również weszło pojęcie wskaźnika de Ritisa, czyli stosunku AspAT do AlAT. W warunkach prawidłowych wskaźnik ten jest większy od jedności (a więc wartości AspAT są nieco wyższe od AlAT), natomiast spadek poniżej 0,9 silnie wskazuje na chorobę miąższu wątroby. Wskaźnika de Ritisa nie wylicza się w warunkach prawidłowych (gdy aktywność AspAT i AlAT mieści się w normie).
CK, CPK (Kinaza kreatynowa (CK), kinaza fosfokreatynowa (CPK)) - jest enzymem wytwarzanym przez różnorodne typy tkanek. Katalizuje odwracalną reakcję przenoszenia grupy fosforanowej bądź z fosfokreatyny na ADP regenerując ATP lub z ATP na kreatynę odbudowując zapasy fosfokreatyny. Dlatego CK jest enzymem kluczowym w bioenergetyce komórki, odgrywając ważną rolę w homeostazie komórkowego ATP.
Podwyższone stężenie - zawał mięśnia sercowego.
Obniżony poziom CK może oznaczać alkoholową chorobę wątroby lub reumatoidalne zapalenie stawów.
Normy: 170-1700 nkat/l, lub 10-100Ul/l.
LDH (Dyhydrogenaza mleczanowa) - enzym z klasy oksydoreduktaz, obecny w wątrobie. Katalizuje ostatni etap szlaku glikolitycznego - przejście pirogronianu w mleczan i odwrotnie. Cząsteczka LDH jest tetramerem, złożonym z dwóch różnych podjednostek - H ("sercowej") i M ("mięśniowej"), co daje możliwość występowania w postaci pięciu izoenzymów.
Podwyższone stężenie:
-zawał mięśnia sercowego,
-uszkodzenie mięśni,
-uszkodzenie wątroby,
-nowotwory,
-białaczka,
-hemoliza.
Normy: 1200-3500 nkat/l, lub 70-200 Ul/l.
α-amylaza - hydrolizuje wiązanie α-(1-4)glikozydowe amylozy dając cząsteczki maltozy (disacharydy α-glukozy).
Podwyższenie stężenia - Test na amylazę jest łatwy do wykonania i jest głównym testem przy wykrywaniu zapalenia trzustki (OZT). Zwiększony poziom amylazy w surowicy notuje się również w przypadku:
-urazów ślinianek,
-alkoholizmie
-niektórych nowotworów złośliwych (rak oskrzela,tarczycy,wątroby...)
-zapalenie otrzewnej
-świnki
-niewydolności nerek.
Normy: surowica 1,9-4,9 nkat/l, mocz 1,9-9,8 nkat/l.
Transdukcja sygnału:
Transdukcja sygnału:
Regulacja metabolizmu:
- w jednokomórkowych organizmach odbywa się w sferze lokalnej (metabolity, koenzymy, jony),
- w wielokomórkowych organizmach regulacja zdalnie sterowana (układ dokrewny, nerwowy, immunologiczny, tkanka łączna - układ białek <kolagenu i elastyny> w przestrzeniach międzykomórkowych.
Drogi przekazu informacji:
*droga endokrynowa, neuroendokrynowa:
przekaz informacji dokonuje się za pośrednictwem układu krążenia. Musi istnieć komórka wyspecjalizowana, zwana komórką dokrewną, która albo tworzy gruczoł wydzielania wewnętrznego (gruczoł endokrynowy), albo jest to komórka w tzw. rozsianym układzie endokrynnym (APUD). Jej wydzielina trafia do układu krążenia. Z krwią wydzielina ta przenoszona jest na pewną odległość, a następnie opuszcza układ krążenia. Trafia na komórkę docelową wyposażoną w receptor i poprzez ten receptor następuje zmiana sygnału humoralnego na odpowiedź wewnątrzkomórkową metaboliczną (molekularną) tej komórki. W takim ujęciu, substancja wydzielana nosi nazwę hormonu.
Komórka endokrynowa -[hormon] krwiobieg receptor
komórka docelowa
*droga parakrynna i neuroparakrynna:
substancja zostaje wydzielona przez odpowiednią komórkę, a następnie działa na komórki docelowe bez pośrednictwa układu krążenia, a jedynie za pośrednictwem płynu międzykomórkowego. Ta sama substancja może działać w różnych warunkach na drodze endokrynnej i parakrynnej. Przykładem jest interferon (w warunkach fizjologicznych działa na drodze parakrynnej, stosowany jako lek - podawany drogą pozajelitową - działa na drodze neurokrynnej).
*droga autokrynna:
komórka sama wydziela substancję i sama na nią odpowiada, ponieważ wyposażona jest w odpowiedni receptor (zjawisko to nosi nazwę sprzężenia zwrotnego dodatniego). W warunkach prawidłowych jest to komórka embrionalna. W warunkach patologicznych taki mechanizm „błędnego koła” występuje w komórkach nowotworowych.
Regulacja metabolizmu:
Hormony - wydzielane przez układ wydzielania wewnętrznego.
Hormony tkankowe:
-cytokiny (droga parakrynna, czynniki wzrostowe). Budowa peptydowa, reguluje proliferację i dojrzewanie komórek, GF.
-interferony - substancje wydzielane przez układ immunologiczny, odpowiedzialne za interferencję, leczenie WZW.
-limfokiny - tworzą sieć transmisji pomiędzy komórkami immunologicznymi.
-endogenne peptydy opioidowe - enkefaliny i endorfiny. Biorą udział w zaburzeniach psychicznych.
-kwas retinowy, pochodna witaminy A - udział w proliferacji i dojrzewaniu komórek.
-1,25-di-OH-D3 (dihydroksy kalcyferol), pochodna witaminy D - w wątrobie witamina D ulega hydroksylacji, potem w nerkach, następnie powstaje białko wiążące wapń.
-eikozanoidy - grupa organicznych związków chemicznych, będących produktami przemian niezbędnych nienasyconych kwasów tłuszczowych (NNKT): kwasu arachidonowego, kwasu linolowego i kwasu alfa-linolenowego. Dzielą się na:
*prostaglandyny (mediatory zapalenia) - wywołują obrzęk, zaczerwienienie, nadmierne ucieplenie miejsca, ból, upośledzenie funkcji.
*prostacyklina (wydzielana w śródbłonku naczyń krwionośnych) - rozszerza naczynia krwionośne, zmniejsza przywieranie płytek do ścian naczynia (athezja), przeciwdziała agregacji.
*tromboksany - powodują m.in. agregację płytek krwi i skurcz naczyń krwionośnych.
*leukotrieny - mediatory astmy oskrzelowej, kurczą oskrzela, zwiększają wydzielanie śluzu.
-tlenek azotu - związek nieorganiczny, pochodna nitrogliceryny stosowana w niedokrwieniu serca. Powoduje stan rozkurczu prawidłowego naczynia.
-neurotransmitery - odpowiadają za przekaz sygnały w obrębie synapsy nerwowej.
-adipokiny (adipocytokiny) - komórki tkanki tłuszczowej wydzielają kilkadziesiąt różnych biologicznie czynnych cząsteczek, które wykazują działanie plejotropowe.
Czynniki determinujące działanie hormonów i cytokin:
Biosynteza, uwalnianie z komórki, wiązanie z białkami transportującymi (TBG - transport hormonów tarczycy, CBG - transport hormonów kory nadnerczy-kortyzol, SHBG - transport hormonów płciowych-estradiol i testosteron, albumina), wiązanie z receptorami - substancja łączy się z receptorem - LIGAND - gdy aktywuje jest dodatni (agonista), natomiast gdy hamuje jest ujemny (antagonista), Polimorfizm receptorów (sprawia że jakiś rodzaj receptorów może być bardziej lub mniej aktywny), Metabolizm (w wątrobie, nerkach, np. insulina).
Działanie na komórkę:
Receptory mogą być:
-na powierzchni komórki - dla hormonów, które nie mogą wejść do wnętrza komórki, te o budowie peptydowej. Istnieje wtórny przekaźnik, który daje znać komórce że do błony przyłączył się hormon.
-w komórce - te o budowie sterydowej, ponieważ mogą rozpuszczać się w tłuszczach
Receptory jonotropowe (kanał jonowy bramkowany przekaźnikiem) - rodzaj receptora błonowego hormonalnego sprzężonego z kanałem jonowym działającym na zasadzie transportu biernego. W części zewnątrzkomórkowej receptora znajduje się miejsce wiążące cząsteczkę sygnałową (ligand), w efekcie związania dochodzi do zmiany konformacji białek tworzących kanał jonowy. Przez otwarty kanał przenikają jony zgodnie z gradientem stężeń.
Klasycznym przykładem takiego receptora jest receptor dla acetylocholiny, który funkcjonuje w płytce nerwowo-mięśniowej.
Kanały jonowe - kationy (sodowy, potasowy, wapniowy) i aniony (chlorkowy).
Kanały jonowe:
Zachodzi bez udziału energii. Sytuację odtwarza pompa sodowo-potasowa, enzym ATP zależny.
Kanały wapniowe:
VOC
jest to kanał sterowany potencjałem, charakterystyczny dla mięśni.
ROC
kanał sterowany receptorem. Substancja pobudzająca przyłącza się do domeny zewnątrzkomórkowej kanału, następuje jego otwarcie i napływ jonów wapnia do wewnątrz.
SMOC
kanał sterowany wtórnym przekaźnikiem (otwierany od środka komórki). Efektem otwarcia jest napływ jonów wapnia do wnętrza komórki. Ligandy - tri fosforan inozytolu IP3, kwas fosfatydowy PA. Posiada wtórne przekaźniki, nie otwiera go substancja działająca z zewnątrz na receptor lecz powstały wewnątrzkomórkowo second-messenger.
Receptory metabotropowe rodzaj receptora błonowego hormonalnego. W organizmie wykryto kilkaset receptorów metabotropowych, które różnią się strukturą i funkcją. Zbudowany jest z:
-części zewnątrzkomórkowej, która jest właściwym receptorem dla liganda zewnętrznego - hormonu
-części transmembranalnej, która zbudowana jest z siedmiu helis
-części wewnątrzkomórkowej, która jest aktywatorem białka G
Po przyłączeniu ligandu zewnątrzkomórkowego zmienia się konformacja części wewnątrzkomórkowej, do której może przyłączyć się podjednostka α białka G. W efekcie białko G zostaje zaktywowane i może dalej przekazywać sygnał danego szlaku fizjologicznego.
Duże białko G (jest trimerem β, α (połączona z GDP), γ) określa się dużą grupę polimorficznych białek, które charakteryzują się aktywnością GTP-azy. Wyróżnia się kilkanaście podtypów tych białek, które różnią się sposobem pobudzenia i efektorem, jaki pobudzają. Biorą udział w przekaźnictwie hormonalnym i mogą pobudzać lub hamować. . Białko to cechuje się dużą heterogennością.
Do zmienionej przez ligand zewnętrzny konformacji części wewnętrznej receptora metabotropowego przyłącza się podjednostka α, co powoduje aktywację białka G, czego efekty są następujące:
-GDP związany z podjednostką α zostaje wymieniony na GTP, po czym podjednostka α oddysocjowuje od heterotrimerycznego kompleksu i tworzy zaktywowaną podjednostkę α;
-'osamotniony' heterodimer - kompleks βγ również staje się aktywny;
Obydwie aktywowane części rozpadłego Białka G napotykają specyficzne dla siebie białka efektorowe uaktywniając je. Zaktywowana podjednostka α po przyłączeniu się do efektora, poprzez swoją aktywność GTP-azy hydrolizuje GTP i w efekcie:
-powstaje GDP;
-podjednostka α staje się nieaktywna i:
-przyłącza napotkany kompleks βγ, deaktywując go;
Odtworzone, nieaktywne białko G jest gotowe do związania się z częścią wewnętrzną receptora metabotropowego i rozpoczęcia kolejnego cyklu przekazywania sygnału.
Defekty białek G:
-wrodzone: rzekoma niedoczynność przytarczyc,
-nabyte: Vibrio cholerae - cholera, bordetella perfussis (krztusiec, koklusz) wydala substancje które uszkadzają mięsień sercowy.
Efektory białek G:
-bezpośrednie: kanały jonowe (otwierane do środka komórki), translokazy (transporter glukozy);
-pośrednie (enzymy generujące wtórne przekaźniki): cykloza adenylowa, cykloza guanylowa, fosfolipaza D, C i A2 generujące przekaźniki z błon komórkowych, fosfodiesteraza cGMP degradująca wtórny przekaźnik CGnp, CAnp.
Receptor katalityczny - receptor zawierający po stronie cytoplazmatycznej centrum katalityczne (zwykle kinazy białkowej), aktywowane przez cząsteczkę sygnałową, inicjujące reakcje prowadzące do zmiany ekspresji materiału genetycznego komórki lub jej funkcjonowania.
Receptor sprzężony z:
Efektor pośredni - fosfolipazy:
metabolizm fosfoinozytydów, inozytol PIP2, fosfolipaza C.
Wtórne przekaźniki, tzw. fosfotydyloinozytatol, diacyloglicerol (aktywuje kinazę białkową C).
Trifosforan inozytolu - łączy się z receptorami w retikulum endoplazmatycznym (gromadzi jony wapnia).
Fosfolipaza D - powstają z niego kwas fosfatydowy, 1,3,4,5-czterofosforan inozytolu.
Jony wapnia po wejściu do komórki łączą się z kalmoduliną i tworzą kompleks kalmodulina-wapń. Ulega aktywacji i wpływa na inne enzymy.
Wapń aktywuje kalmodulinę.
Hormony:
Układ humoralny, układ wydzielania wewnętrznego.
Hormon - związek chemiczny, który jest wydzielany przez gruczoły lub tkanki układu hormonalnego. Funkcją hormonu jest regulacja czynności i modyfikacja cech strukturalnych tkanek leżących w pobliżu miejsca jego wydzielania lub oddalonych, do których dociera poprzez krew (wyjątkiem są tzw. hormony lokalne). Istnieją także takie hormony, które wywierają wpływ na funkcjonowanie wszystkich tkanek organizmu.
Hormony są wydzielane przez rodzaj gruczołów do krwi lub limfy organizmów. Z tego względu bywają też określane mianem gruczołów dokrewnych, a układ hormonalny - układem dokrewnym.
Działanie:
Ogólnie działanie hormonów polega na aktywacji lub dezaktywacji pewnych mechanizmów komórkowych w tkankach docelowych (narządach docelowych). Na przykład insulina tak wpływa na komórki, że aktywuje mechanizmy pobierania glukozy, co powoduje spadek stężenia glukozy we krwi. Aktywacja lub dezaktywacja odbywa się przez łączenie ze specyficznymi błonowymi lub wewnątrzkomórkowymi receptorami.
Czynniki determinujące działanie hormonów: biosynteza, metabolizm, wiązania z białkami transportującymi, uwalnianie z komórki, polimorfizm receptorów.
Hormony tropowe:
Wśród hormonów można wyróżnić grupę, której zadaniem jest regulacja czynności innych hormonów.
Nad hormonami tropowymi kontrolę sprawuje wyższe piętro nadzoru. Znajduje się ono w części mózgu nazywanej podwzgórzem. Podwzgórze produkuje hormony uwalniające i hamujące, które wpływają na wzrost lub spadek wydzielania hormonów tropowych produkowanych przez przysadkę. I tak, istnieje tyreoliberyna powodująca uwalnianie (zwiększenie wydzielania) hormonu tropowego - TSH (hormon tyreotropowy), a także somatostatyna, która zmniejsza wydzielanie hormonu wzrostu przez komórki przysadki mózgowej.
Mechanizm uwalniania:
Ogólnym mechanizmem działającym w obrębie układu hormonalnego jest ujemne sprzężenie zwrotne. Produkt wydzielany przez dany gruczoł dokrewny np. tarczycę - czyli tyroksyna (T4) (a także bezpośrednio trójjodotyronina), wpływa hamująco na gruczoł dokrewny nadzorczy czyli przysadkę mózgową. Powoduje to spadek wydzielania TSH przez przysadkę i z kolei hormonów tarczycy. Spadek nie może przekroczyć pewnej określonej granicy, gdyż wówczas ujemny wpływ maleje, co pozwala na ponowne produkowanie większych ilości TSH. Jest to element homeostazy i system ten działając we wzajemnym sprzężeniu, utrzymuje równowagę hormonalną organizmu.
Hormony sterydowe:
powstają z cholesterolu. Umiejscowienie gruczołów - mózgowie (szyszynka, podwzgórze), tarczyce i przytarczyce, nerki i nadnercza, gonady…
SZYSZYNKA:
Melatonina:
Pochodna tryptofanu, hormon syntetyzowany w pinealocytach szyszynki, koordynujący pracę nadrzędnego zegara biologicznego u ssaków regulującego rytmy okołodobowe, m.in. snu i czuwania.
Wytwarzanie melatoniny pozostaje pod hamującym wpływem światła. Ekspozycja organizmu w porze snu na oświetlenie powoduje znaczne zmniejszenie syntezy i uwalniania melatoniny. Impulsy nerwowe przekazywane są drogą nerwową rozpoczynającą się w neuronach siatkówki i kończącą w przestrzeniach okołonaczyniowych w pobliżu ciała pinealocytów.
Działa antymelanotropowo przejaśnienia skóry oraz antygonadotropowo opóźnienie dojrzewania płciowego.
TARCZYCA:
Komórki pęcherzykowate mające zdolność wyłapywania jodu. Hormony tarczycy to jodowe pochodne aminokwasów tyroksyny:
T3 - trójjodotyronina, T4 - tyroksyna.
Ich stężenie zależy od ilości jodu, mechanizmów syntezy (hamowane przez rodniki, sulfamiany), syntezy białek wiążących hormony (TBG).
Trójjodotyronina jest u człowieka głównym hormonem tarczycy, który powstaje głównie przez odjodowanie tyroksyny (T4) na poziomie tkankowym. Działanie hormonów tarczycy jest niezbędne do prawidłowego funkcjonowania organizmu, ich działanie ujawnia się we wszystkich komórkach organizmu i jest szczególnie ważne w okresie rozwoju ośrodkowego układu nerwowego oraz dla wzrostu.
Działanie - wzmaganie podstawowej przemiany materii, aktywacja procesów utleniania i wytwarzania energii, aktywacja syntezy białek i kwasów nukleinowych, aktywują lipolizę, pobudzają transport transbłonowy, obniżają poziom cholesterolu, wpływają na wzrost i rozwój.
Patologie - zepsuta tarczyca, nie nadmiar jodu!
nadmiar hormonów - choroba Basedowa (wytrzeszcz oczu, nerwowość),
niedobór hormonów - u dzieci kretynizm, u dorosłych obrzęk śluzowaty.
Zarówno przy niedoczynności jak i przy nadczynności występuje wole. Przy niedoczynności spowodowane jest tym, że komórki robią się duże by wyciągnąć jod z organizmu, przy nadczynności są przeładowane.
PRZYTARCZYCE:
regulacja gospodarki wapniowo-fosforanowej.
Wapń - buduje kości, przewodnictwo nerwowo-mięśniowe, udział w krzepnięciu krwi.
Parathormon:
Degradacja i uwalnianie PTH uwarunkowane jest stężeniem jonów wapnia w surowicy krwi, którego obniżenie powoduje zwiększony wyrzut PTH. Czynnikiem warunkującym wrażliwość przytarczyc na wahania stężenia wolnego wapnia jest aktywna postać witaminy D - 1,25(OH)2D3.
Narządami docelowymi dla PTH są kości i nerki. W kościach pod wpływem PTH zwiększa się uwalnianie wapnia. W przypadku niedoboru aktywnej formy witaminy D, występuje oporność kości na jego działanie. W nerkach natomiast zwiększa wchłanianie zwrotne jonów wapnia, hamując zwrotną resorbcję fosforanów, zwiększa też wytwarzanie aktywnej postaci witaminy D - kalcytriolu. Mechanizm działania polega tutaj na aktywacji 1-α-hydroksylazy, która przeprowadza hydroksylację kalcytriolu. Witamina D z kolei powoduje zwiększone wchłanianie wapnia w jelitach.
W wyniku niedoczynności przytarczyc następuje zmniejszona synteza i wydzielanie PTH co wywołuje hipokalcemię. Hipokalcemia może także nastąpić na skutek zaburzeń w transdukcji sygnału do wnętrza komórki (Niedoczynność przytarczyc rzekoma). Mogą się wtedy pojawić objawy tężyczki.
Nadczynność przytarczyc może być typu pierwotnego i wtórnego (np. mocznica) skutkuje większym wydzielaniem PTH. Wzrasta poziom wapnia we krwi, kosztem tego, który jest zgromadzony w kościach. Może to wywołać groźne zaburzenia funkcji mózgu pod postacią np. wymiotów, zaburzeń rytmu serca oraz kości (osteoporoza).
Kalcytonina:
Wraz z innymi hormonami parathormonem i kalcytriolem, odgrywa istotną rolę w regulacji gospodarki wapniowo-fosforanowej ustroju.
Wrażliwe na stężenie jonów wapnia w osoczu krwi receptory rozmieszczone są na komórkach C tarczycy. Wzrost stężenia jonów wapnia Ca2+ powoduje zwiększenie wydzielania kalcytoniny. Z kolei spadek stężenia jonów wapnia powoduje zmniejszenie wydzielania tego hormonu. Kalcytonina obniża stężenie wapnia i fosforanów w osoczu hamując działanie osteoklastów w kościach oraz hamując reabsorpcję wapnia i fosforanów przez komórki cewek nerkowych powoduje zwiększone ich wydalanie. Oba typy komórek wyposażone są w receptory dla kalcytoniny, które należą do grupy receptorów związanych z białkami G.
Wydzielanie kalcytoniny jest pobudzane przez glukagon, kilka hormonów przewodu pokarmowego oraz wysokie stężenie jonów wapnia we krwi.
Ma szerokie zastosowanie w leczeniu osteoporozy. Jest antagonistą parathormonu.
TRZUSTKA:
F. zewnątrz-wydzielnicza - produkcja soku do jelita,
f. wewnątrz-wydzielnicza - produkcja hormonów.
Glukagon:
jest polipeptydowym hormonem wytwarzanym przez komórki A (α) wysp trzustkowych. Hormon ten ma znaczenie w gospodarce węglowodanowej; wykazuje działanie antagonistyczne w stosunku do insuliny, które przede wszystkim objawia się zwiększeniem stężenia glukozy we krwi.
Insulina:
anaboliczny hormon peptydowy o działaniu ogólnoustrojowym, odgrywający zasadniczą rolę przede wszystkim w metabolizmie węglowodanów, lecz także białek i tłuszczów.
Insulina produkowana jest przez komórki B (β) wysp trzustki (Langerhansa). Najważniejszym bodźcem do produkcji insuliny jest poposiłkowe zwiększenie stężenia glukozy we krwi. Dzięki zwiększeniu wytwarzania insuliny i jej wpływowi na komórki efektorowe (miocyty, adipocyty, hepatocyty) zwiększa się transport glukozy do wnętrza komórek, co obniża poziom glukozy we krwi.
Obniżanie stężenia glukozy: aktywacja GLUT 4, pobudzanie syntezy glukagonu (w wątrobie i mięśniach), pobudzanie syntezy białek, oszczędzanie tłuszczu.
Patologia:
-Cukrzyca typu I - uszkodzenie trzustki (10% chorych),
-Cukrzyca typu II - insulino odporność (90% chorych). U osób otyłych następuje wzrost komórek tłuszczowych, ale trzustka nie rośnie. Insulina próbuje obsłużyć wszystkie komórki tłuszczowe organizmu, lecz nie daje rady i wraca do trzustki, która blokuje komórki beta i przestaje w ogóle wytwarzać insulinę.
NADNERCZA - RDZEŃ:
Adrenalina (epinefryna):
Działanie adrenaliny polega na bezpośrednim pobudzeniu zarówno receptorów α-, jak i β-adrenergicznych, przez co wykazuje działanie sympatykomimetyczne. Wyraźny wpływ na receptory α widoczny jest wobec naczyń krwionośnych, ponieważ w wyniku ich skurczu następuje wzrost ciśnienia tętniczego. Adrenalina przyspiesza czynność serca jednocześnie zwiększając jego pojemność minutową, w nieznaczny sposób wpływając na rozszerzenie naczyń wieńcowych; rozszerza też źrenice i oskrzela ułatwiając i przyspieszając oddychanie. Ponadto hamuje perystaltykę jelit, wydzielanie soków trawiennych i śliny oraz obniża napięcie mięśni gładkich. Adrenalina jako hormon działa antagonistycznie w stosunku do insuliny - przyspiesza glikogenolizę, zwiększając stężenie glukozy w krwi. Wyrzut adrenaliny do krwi jest jednym z mechanizmów uruchamianych przy hipoglikemii. Zwiększa ciśnienie rozkurczowe w aorcie oraz zwiększa przepływ mózgowy i wieńcowy. Poprawia przewodnictwo i automatykę w układzie bodźcowo-przewodzącym. Zwiększa amplitudę migotania komór, przez co wspomaga defibrylację.
Noradrenalina (norepinefryna):
Wyrzut noradrenaliny do krwi powoduje, że szybko dociera ona do mózgu, który na jej obecność reaguje przyspieszeniem rytmu serca, przemianą glikogenu w glukozę, napięciem mięśni oraz poszerzeniem źrenic (co jest skutkiem ubocznym). Noradrenalina wpływa dwojako na układ krążenia: zwęża naczynia obwodowe, natomiast rozszerza naczynia wieńcowe w sercu. Działa trochę słabiej niż adrenalina.
Noradrenalina jest wykorzystywana także jako neuroprzekaźnik przez niektóre neurony pnia mózgu i układu współczulnego. Wewnątrz pnia mózgu noradrenalina produkowana jest w miejscu sinawym, miejsce to reguluje stopień pobudzenia mózgu jak i funkcje automatyczne takie jak termoregulacja. Silny stres zaburza działanie miejsca sinawego.
Dopamina:
Dopamina jest także stosowana jako lek, w postaci kroplówek, w zapobieganiu ostrej niewydolności nerek (zwiększa perfuzję nerkową), a w większych dawkach podwyższa ciśnienia tętnicze i działa dodatnio na siłę skurczu mięśnia sercowego i z tego względu jest stosowana we wstrząsie septycznym, kardiogennym, pourazowym, po operacjach kardiochirurgicznych oraz w zaostrzeniu przewlekłej niewydolności krążenia.
Dopamina nazywana jest również "hormonem szczęścia", gdyż pojawienie się jej w przestrzeniach między neuronami w jądrze półleżącym, zewnętrznie objawia się poczuciem euforii.
Hormony te działają krótki czas - by pobudzić!
Hormony sterydowe - pochodne cholesterolu, mają receptory we wnętrzu komórki, działają jako aktywator genów:
-mineralokortykoidy, glikokortykoidy (kora nadnerczy),
-androgeny (męski hormony płciowe, kora nadnerczy),
-estrogeny, progesteron.
NADNERCZA - KORA:
Glikokortykoidy:
to hormony produkowane w warstwach pasmowatej i siatkowatej kory nadnerczy pod wpływem ACTH, które regulują przemiany białek, węglowodanów i tłuszczów. Zalicza się do nich: kortyzol, kortykosteron, kortyzon.
Działanie - synteza glukozy ze związków niecukrowych (białka i tłuszcze), nasilenie syntezy erytrocytów, trombocytów i granulocytów obojętnochłonnych, działanie przeciwzapalne, wchłanianie sodu.
Zastosowanie - leki przeciwalergiczne, przeciwastmatyczne, przeciwzapalne.
Patologie - nadmiar powoduje zespół Cushinga (glukoza odkłada się w różnych miejscach, u chorego występuje otyłość górnych części ciała). Niedobór choroba Addisona (schorzenie układu dokrewnego, zespół objawów spowodowanych przewlekłym niedoborem hormonów produkowanych przez korę nadnerczy).
Mineralokortykoidy:
hormony wytwarzane w organizmie człowieka przez warstwę kłębkowatą kory nadnerczy. Wpływają na nieorganiczną przemianę materii.
Głównym przedstawicielem mineralokortykosteroidów jest aldosteron. Jego najważniejsze działanie to zatrzymywanie jonów sodowych (Na+) w ustroju i dokomórkowy napływ jonów potasu (K+) oraz wtórne zatrzymanie wody w ustroju. Hormon ten wchodzi w skład układu hormonalnego RAA tzn. renina-angiotensyna-aldosteron).
Funkcje:
-przywrócenie objętości płynów zewnątrzkomórkowych (głównie śródnaczyniowych),
-wyrównanie stosunku Na+/K+,
-przywrócenie równowagi elektrolitowej.
Działanie:
-kanaliki nerkowe: wzrost wchłaniania zwrotnego Na+ i wydzielania K+,
-gruczoły potowe, ślinowe, nabłonek jelitowy: wzrost wchłaniania Na+,
-wzrost objętości płynu zewnątrzkomórkowego co skutkuje zwiększoną objętością wyrzutową serca i podwyższeniem ciśnienia krwi.
GONADY:
produkcja wyłącznie hormonów sterydowych.
GONADY MĘSKIE:
najądrza - zawierają komórki Leidiga produkujące testosteron.
Androgeny:
(DHEA, Testosteron, Androstendion)
Testosteron - organiczny związek chemiczny, podstawowy męski steroidowy hormon płciowy należący do androgenów. Jest produkowany przez komórki śródmiąższowe Leydiga w jądrach pod wpływem LH, a także w niewielkich ilościach przez korę nadnerczy, jajniki i łożysko.
We krwi tylko niewielka część testosteronu występuje w postaci wolnej oraz związanej z albuminami, reszta jest związana z białkiem transportowym SHBG (sex hormone binding globuline).
Działanie androgenów - różnicowanie płci, drugorzędowe cechy płciowe, spermatogeneza, kształtowanie męskiego profilu behawioralnego.
Działanie poza płciowe - stymulacja wzrostu kostnego, stymulacja syntezy białek, pobudzenie erytropoezy, wzrost LDL, spadek HDL, wzrost stężenia glukozy.
GONADY ŻEŃSKIE:
Estrogen:
grupa hormonów płciowych, do których zalicza się estron E1 (menopauza), estradiol E2 (jajniki) i estriol E3 (ciąża). Estrogeny są nazywane hormonami żeńskimi i najważniejszą rolę odgrywają w organizmie kobiet, ale są też niezbędne dla mężczyzn - ich niedobór w jądrach może powodować bezpłodność.
Estrogeny wpływają na wiele cech i funkcji organizmu, szczególnie kobiecego.
W zakresie budowy ciała są odpowiedzialne za:
-kształtowanie się żeńskich narządów płciowych i piersi w czasie rozwoju płodowego i po urodzeniu (II i III-rzędowe cechy płciowe),
-rozwój III -rzędowych cech płciowych kobiecych (m. in. budowa ciała, typ owłosienia),
-kształtowanie się psychiki i popędu płciowego (IV-rzędowe cechy płciowe).
W zakresie procesów biochemicznych są odpowiedzialne za:
-regulację cyklu miesiączkowego. Szczególną rolę odgrywają w pierwszej fazie cyklu, w której stymulują rozrost błony śluzowej macicy i przygotowują ją do implantacji zarodka
-gospodarkę lipidową - zwiększają poziom "dobrego" cholesterolu HDL, a obniżają poziom "złego" cholesterolu LDL; zwiększają też wydalanie cholesterolu z żółcią; zwiększają poziom α-lipoprotein i fosfolipidów
-gospodarkę wapniową - zwiększają odkładanie wapnia w kościach, zapobiegając osteoporozie; stymulują wzrost kości i chrząstek
-zwiększanie przyswajania białek;
-zwiększanie syntezy białek endogennych, np. białek wiążących hormony tarczycy i hormonów nadnerczy, a także pobudzają syntezę fibrynogenu, ceruloplazminy i angiotensynogenu.
-zwiększanie krzepliwości krwi;
-przyrost i zwiększenie pobudliwości mięśni gładkich (macicy i jajowodów).
-przyrost komórek endometrium i nabłonka piersi, co jest powodem rakotwórczego działania estrogenów
W trakcie krwawienia ich stężenie wzrasta, co prowadzi do wzrostu krzepliwości krwi i zakończenia krwawienia. Nie mają wpływu na syntezę składników mleka. Estradiol, na zasadzie sprzężenia zwrotnego hamuje wydzielanie FSH.
Progesteron:
steroidowy żeński hormon płciowy wytwarzany przez ciałko żółte i łożysko (w czasie ciąży). Najważniejszy hormon wydzielany przez gonady (jajniki i jądra).
Wydzielanie progesteronu wzrasta po owulacji, co
-przygotowuje błonę śluzową macicy na przyjęcie zapłodnionego jaja
-hamuje skurcze macicy
-wstrzymuje dojrzewanie pęcherzyków Graafa.
W warunkach fizjologicznych progesteron jest wytwarzany w zluteinizowanych komórkach ziarnistych ciałka żółtego jajnika, w zespólni kosmków łożyska od około 14-18 tygodnia ciąży, w warstwie pasmowatej i siatkowatej kory nadnerczy oraz w ośrodkowym układzie nerwowym.
W organizmie kobiety progesteron działa poprzez specyficzne receptory zlokalizowane m.in. w macicy, gruczołach sutkowych, OUN (ośrodkowy układ nerwowy) i przysadce mózgowej. Ludzki receptor dla progesteronu występuje jako dwie izoformy: PR-A i PR-B. PR-A może pełnić rolę zarówno inhibitora, jak i aktywatora transkrypcji, co tym samym umożliwia różne działania tkankowe.
Najważniejsze efekty oddziaływania progesteronu na narząd rodny to:
-ułatwianie owulacji, poprzez dokonywanie proteolizy ściany pęcherzyka Graafa;
-sekrecyjna przemiana endometrium, umożliwiająca implantację zapłodnionego jaja;
-hamowanie nadmiernego rozrostu endometrium pod wpływem działania estrogenów;
-cykliczne zmiany w nabłonku jajowodów, szyjki macicy i pochwy.
Działanie poza płciowe:
-działa przeciwzapalnie i hipertermicznie (wzrost temperatury ciała),
-wzrost VLDL,
-synteza białek.
PODWZGÓRZE:
Produkcja hormonów do przysadki. Neurohormony - wazopresyna i oksytocyna.
Wazopresyna - Hormon antydiuretyczny
Powoduje zagęszczanie moczu poprzez resorpcję wody i jonów sodu w kanalikach nerkowych poprzez pobudzanie receptorów V2. Na akwaporyny działa w dwojaki sposób: krótkoterminowa regulacja kieruje AQP2 do błony (odpowiedź w ciągu kilku minut), natomiast długoterminowa (efekty widoczne na przestrzeni kilku dni) powoduje ekspresję genów kodujących kanał AQP2 (w przeciwieństwie do AQP1 stale obecnego w błonie) dla wody, następnie translację tegoż mRNA oraz wbudowanie tego produktu w błonę bieguna apikalnego komórek sześciennych budujących kanaliki nerkowe. Powoduje skurcz naczyń krwionośnych poprzez receptory V1, obecne na ich powierzchni.
Wydzielanie wazopresyny jest pobudzane przez wzrost ciśnienia osmotycznego osocza krwi i płynu mózgowo-rdzeniowego, hipowolemię lub angiotensynę II. Jej zwiększone wydzielanie następuje także podczas snu. Spadek osmolalności osocza lub hiperwolemia hamują jej wydzielanie.
Niedobór hormonu antydiuretycznego lub brak jego działania powoduje moczówkę prostą.
Oksytocyna:
Jest to hormon peptydowy.
Wytwarzany jest w jądrze przykomorowym i nadwzrokowym podwzgórza i poprzez układ wrotny przysadki przekazywany i magazynowany w tylnym płacie przysadki. Oksytocyna powoduje skurcze mięśni macicy, co ma znaczenie podczas akcji porodowej. Uczestniczy także w akcie płciowym i zapłodnieniu (powoduje skurcze macicy podczas orgazmu, które ułatwiają transport nasienia do jajowodów).
Uwalniana jest po podrażnieniu mechanoreceptorów brodawek sutkowych np. podczas ssania piersi, co ułatwia wydzielanie mleka oraz po podrażnieniu receptorów szyjki macicy i pochwy. Estrogeny wzmagają wydzielanie oksytocyny, a progesteron je hamuje. Bezpośrednio po porodzie, oksytocyna powoduje obkurczanie macicy oraz położonych w ścianie macicy naczyń krwionośnych, tamując w ten sposób krwawienie po urodzeniu łożyska. W okresie połogu ma bezpośredni wpływ na zwijanie macicy, tak więc karmienie piersią przyspiesza ten proces.
PRZYSADKA MÓZGOWA:
-somatotropina (GH), (STH), hormon wzrostu.
-prolaktyna (PRL
-hormon adrenokortykotropowy (ACTH)
-hormon tyreotropowy (TSH)
-hormon folikulotropowy (FSH)
-hormon luteinizujący (LH)
-hormon lipotropowy (LPH)
Czynniki pobudzające - somatoliberyna (podwzgórze), wysiłek, spadek stężenia glukozy, noc w fazie SEM.
Patologie:
-karłowatość przysadkowata (tylko niski wzrost, bez opóźnienia umysłowego),
-gigantyzm (rosną tylko kości, prowadzi do śmierci),
-akromegalia (wydłużenie tylko niektórych kości).
Wyszukiwarka
Podobne podstrony:
biochemia-2, Fizyka medyczna, biochemia
biofizyka ściaga, Fizyka Medyczna UŚ Katowice, Biofizyka
kolos 3 anatomia, Fizyka Medyczna UŚ Katowice, Anatomia
BIOINFORMATYKA, Nauka - różności, Fizyka medyczna, Biofizyka
zagadnienia2014, Studia, Semestr 5, Fizyka Medyczna
UKLAD KRWIONOSNY , Fizyka Medyczna UŚ Katowice, Anatomia
Ultradźwieki, Fizyka Medyczna UŚ Katowice, Medycyna Fizykalna
noname, Fizyka Medyczna UŚ Katowice, Medycyna Fizykalna
Osrodkowy uklad nerwowy , Fizyka Medyczna UŚ Katowice, Anatomia
cw ulradz, Fizyka Medyczna UŚ Katowice, Medycyna Fizykalna
zaliczenie fiz med 2005-06, medycyna, fizyka medyczna
noname4, Fizyka Medyczna UŚ Katowice, Medycyna Fizykalna
gieldy, medycyna, fizyka medyczna
bialka, Nauka - różności, Fizyka medyczna, Biofizyka
noname1, Fizyka Medyczna UŚ Katowice, Medycyna Fizykalna
medycyna fizykalna pytania, Fizyka medyczna, medycyna fizykalna gr 1
serce, Fizyka Medyczna UŚ Katowice, Anatomia
więcej podobnych podstron