TERMODYNAMIKA
układ - ciało lub zespół ciał poddawanych obserwacji (np. reagenty biorące udział w danej
reakcji)
otoczenie - wszystko to co znajduje się poza granicą układu.
układ zamknięty -może wymieniać z otoczeniem energię ale nie materię
układ otwarty - może wymieniać z otoczeniem może wymieniać z otoczeniem zarówno materię jak i energię
układ izolowany - nie może wymieniać z otoczeniem ani energii ani materii.
Energia między układem i otoczeniem może być wymieniana:
-na sposób ciepła (w reakcjach egzo- i endotermicznych)
-na sposób pracy (praca objętościowa, elektryczna w ogniwach)
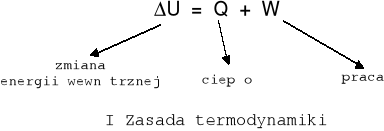
Energia wewnętrzna układu (funkcja stanu U)- całkowita energia wszystkich składników układu związana z wzajemnymi ruchami i oddziaływaniami cząsteczek i atomów. Jest sumą energii kinetycznej ruchu postępowego, i obrotowego cząsteczek i jonów, energii wzajemnego oddziaływania cząsteczek, oddziaływania elektronów i jąder, energii jąder atomowych, energii oddziaływań składników jąder. Nie można podać jej dokładnej wartości można podać tylko zmianę energii wewnętrznej U = U2 - U1
Zmiana energii wewnętrznej układu jest sumą ilości energii wymienionej z otoczeniem na sposób ciepła i na sposób pracy.
Entalpia - funkcja stanu H, opisującą układy znajdujące się pod stałym ciśnieniem, a mogących zmieniać swoją objętość. H = U + pV
Zmiana energii wewnętrznej układu w warunkach izobarycznych nie jest równa ciepłu, gdyż część energii musi być przez układ zużyta na wykonanie pracy związanej ze zwiększeniem objętości. Wyraz pV uwzględnia tę zmianę energii.
Prawo HESSA
Ilość ciepła wydzielanego lub pochłanianego podczas reakcji chemicznej zachodzącej w
stałej temp. i pod stałym ciśnieniem zależy jedynie od stanu początkowego i końcowego
układu a nie zależy od sposobu przeprowadzenia reakcji. Ciepło reakcji jest takie samo niezależnie od tego czy reakcja zachodzi w jednym etapie czy w kilku następnych etapach.
Prawo to umożliwia na przykład wyznaczenie efektów cieplnych reakcji chemicznej na
podstawie znajomości ciepła spalania jej substratów i produktów.
Stan standardowy - stan w którym znajduje się czysta substancja pod ciśnieniem 1013hPa (760mmHg) lub roztwór, którego stężenie wynosi 1 mol/kg w danej temperaturze.
Tego typu stany standardowe dotyczą układów fikcyjnych wyidealizowanych nie istniejących
w rzeczywistości. W rzeczywistości są to stany odniesienia dla układów rzeczywistych.
Układy rzeczywiste wykazują odchylenia od układów standardowych wyidealizowanych.
Standardowa entalpia reakcji HoT - zmiana entalpii towarzysząca przemianie substratów w
produkty w ich stanach standardowych zach. w określonej temperaturze. Wyraża się jako
różnica standardowych entalpii tworzenia produktów i substratów. Jest funkcją temperatury.
H > 0 - reakcja endotermiczna; H < 0 - reakcja egzotermiczna
Metody obliczania entalpii reakcji chemicznej.
Zgodnie z prawem Hessa efekt cieplny reakcji jest równy sumie entalpii tworzenia produktów
pomniejszonej o sumę entalpii tworzenia substratów z uwzględnieniem ilości substratów
i produktów.
![]()
Molowa entalpia tworzenia jest równa sumie molowych entalpii spalania substratów pomniejszonej o sumę molowych entalpii spalania produktów reakcji.
![]()
Mając wartości energii wiązań można określić entalpię reakcji przebiegającej w fazie gazowej sumując energie rozpadu wiązań z energiami tworzenia wiązań.
![]()
ENTROPIA - S
Entropię określa się jako miarę stopnia nieuporządkowania układu, miarę swobody cząstek
w układzie. Procesy chemiczne dążą do osiągnięcia stanu równowagi czyli stanu o minimalnej
energii i maksimum entropii. Jest funkcją stanu. Jeżeli układ wymienia z otoczeniem tylko ciepło i to na sposób odwracalny to zmiana entropii wynosi:

Zmiany entropii zależą od tego czy reakcja jest odwracalna czy nieodwracalna:
W procesie odwracalnym zmiana entropii układu oraz otoczenia połączonych w tzw. układ izolowany jest równy zeru.
|
W procesie samorzutnym czyli nieodwracalnym całkowita zmiana entropii układu oraz otoczenia jest większa od zera.
|
Druga zasada termodynamiki: w układach zamkniętych mogą zachodzić tylko takie procesy, w wyniku których entropia wzrasta (w przypadku procesów nieodwracalnych) lub nie zmienia się (w przypadku procesów odwracalnych) W układzie izolowanym przemianie samorzutnej nieodwracalnej towarzyszy wzrost entropii (entropia dąży do maksimum). Ze wzrostem temperatury rośnie entropia a wraz z nim stopień nieuporządkowania układu.
Wykresy:
|
Z udziałem katalizatora:
|
Wyszukiwarka
Podobne podstrony:
Ustawa z dnia 25 06 1999 r o świadcz pien z ubezp społ w razie choroby i macierz
brzuch 1999 2000
chojnicki 1999 20 problemy GP
Porty morskie i żegluga morska w Polsce w latach 1999 2001
ABS Octawia 1999
1999 05 05 0953
ED 1999 1 41
Badanie wahadła skrętnego, Studia, Pracownie, I pracownia, 7 Badanie drgań wahadła skrętnego {torsyj
Okręgi wojskowe od roku 1999, wiedza o siłach zbrojnych
MATHEMATICS HL May 1999 P1
1999 02 str 24 25 Chaotyczne rachunki
1999 12 22 2757
1999 06 Szkoła konstruktorów
0415191246 Routledge Humes Naturalism May 1999
PN EN 60099 5 1999 Ograniczniki przepięć Zasady doboru
897656 1300SRM0568 (10 1999) UK EN
dziennik ustaw 1999
MATHEMATICS HL May 1999 P2$
więcej podobnych podstron