Zasada oznaczenia:
Zasada oznaczenia stężenia SiO2 metodą spektrofotometryczną polega na utworzeniu zredukowanego kwasu krzemomolibdenowego, którego roztwór wodny przybiera barwę niebieską. Intensywność barwy zależy od stężenia zredukowanego kwasu krzemomolibdenowego, czyli od ilości Si4+.
Przygotowanie roztworu roboczego:
5 cm3 roztworu wzorcowego I umieszczono w kolbie miarowej na 100 cm3, dodano 10 cm3 wody destylowanej, 2 cm3 H2SO4 (0,25 mol/dm3) i dopełniono wodą destylowaną do kreski.
Otrzymany roztwór roboczy zawiera 0,01 mg SiO2 w 1 cm3.
Przygotowanie skali wzorców i krzywej wzorcowej:
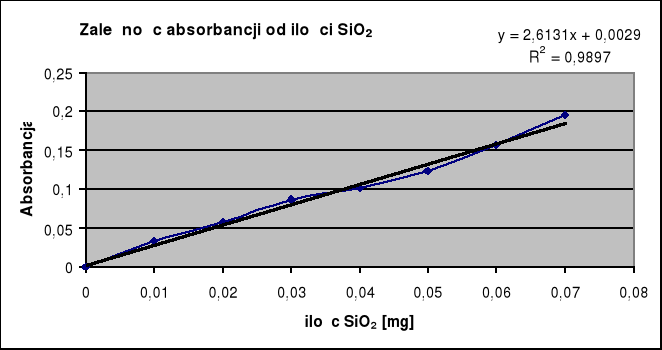
Do kolbek miarowych na 50 cm3 pobrano od 0 do 7 cm3 roztworu roboczego. Do każdej kolbki dodano 20 cm3 wody destylowanej, 1 cm3 H2SO4 (0,25 mol/dm3) i 0,5 cm3 molibdenianu amonu. Po upływie 5 minut dodano 5 cm3 kwasu winowego i 0,5 cm3 kwasu askorbinowego. Po 20 minutach zmierzono absorbancję przy długości fali λ = 650 nm. Wyniki pomiarów zebrano w poniżej tabeli, na podstawie której wykreślono następnie krzywą wzorcową:
Objętość roztworu roboczego [cm3] |
mg SiO2/50 cm3 |
Absorbancja |
0 |
0,00 |
0,000 |
1 |
0,01 |
0,033 |
2 |
0,02 |
0,058 |
3 |
0,03 |
0,087 |
4 |
0,04 |
0,102 |
5 |
0,05 |
0,123 |
6 |
0,06 |
0,157 |
7 |
0,07 |
0,195 |
Oznaczenie zawartości krzemionki całkowitej w pyle:
Odważono dwie próbki pyłu o masach 0,0140 i 0,0108 g i umieszczono w tyglach platynowych, po czym dodano 5 cm3 HCl (1:1) w celu uwolnienia SiO2 od zanieczyszczeń. Następnie ogrzano zawartość tygli na siatce azbestowej utrzymując ją w stanie wrzenia przez 2 minuty. Po ostudzeniu, zawartość tygli przeniesiono na twardy sączek i osady przemyto 10 cm3 10 % roztworem Na2CO3, a następnie gorąco wodą. Sączki z osadami przeniesiono do tygli platynowych, wysuszono pod przykrywką po czym spopielono i wyprażono. Do wyprażonych osadów dodano 0,5g mieszaniny NaCl + NaHCO3 i stopiono na palniku utrzymując w stanie ciekłym przez 3 minuty. Po ostudzeniu stop rozpuszczono w 5 cm3 wody destylowanej i ostrożnie podgrzewano na palniku pod przykryciem. W alkaliczny roztworze wodnym powstaje rozpuszczony krzemian sodowy:
![]()
Po chwili przesączono roztwory do kolby miarowych na 50 cm3 a osady przemyto gorącą wodą. Kolbki dopełniono do kreski wodą destylowaną. Pobrano 20 cm3 powyższych roztworów i umieszczono w kolbkach miarowych na100 cm3. Dodano 2 cm3 H2SO4 (0,25 mol/dm3) i dopełniono kolbki wodą destylowaną do kreski. Następuje przeprowadzenie jonu SiO32+ do formy H 4SiO4 według poniższej reakcji:
![]()
Z tak otrzymanych roztworów pobrano 2cm3 , umieszczono w kolbkach na 50 cm3 i kolejno dodano: 20 cm3 wody destylowanej, 0,5 cm3 H2SO4 (0,25 mol/dm3) i 0,5 cm3 molibdenianu amonu. W wyniku tego tworzy się kwas krzemomolibdenowy (roztwór żółty):
![]()
Po upływie 5 minut dodano 5 cm3 kwasu winowego i 0,5 cm3 kwasu askorbinowego. Kwas krzemomolibdenowy ulega redukcji:
![]()
Odczekano 20 minut i zmierzono absorbancję przy długości fali λ = 650 nm. Otrzymane wyniki zebrano w poniższej tabeli:
Masa pyłu [mg] |
Próbka 1 |
Próbka 2 |
14,0 |
0,036 |
0,036 |
10,8 |
0,041 |
0,042 |
Na podstawie kolejnych kroków przy sporządzani próbki należało obliczyć ile mg krystalicznej krzemionki znajdowało się w kolbce na 50 cm3:

Podstawiając:
![]()
Otrzymujemy:
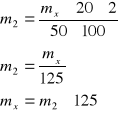
Na podstawie równania tej zależności y = 2,6131x + 0,0029 obliczono masy SiO2 w badanych próbkach pyłów:

Próbka I:
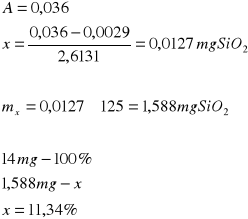
Próbka II:
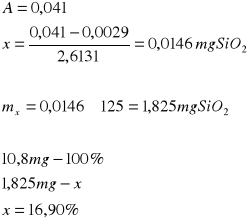
Próbka III:
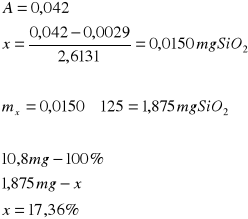
Otrzymane zadanie:
Numer próbki |
Masa filtra przed pomiarem[ |
Masa filtra po pomiarze[ |
Masa pyłu |
Stężenie pyły |
log |
|
1 |
0,1850 |
0,1842 |
0,0008 |
1,78 |
0,2504 |
0,0042 |
2 |
0,1760 |
0,1751 |
0,0009 |
2,00 |
0,3010 |
0,0002 |
3 |
0,1840 |
0,1830 |
0,0010 |
2,22 |
0,3464 |
0,0010 |
4 |
0,1780 |
0,1768 |
0,0012 |
2,67 |
0,4265 |
0,0125 |
5 |
0,1750 |
0,1742 |
0,0008 |
1,78 |
0,2504 |
0,0042 |
Masę pyłu obliczono z wzoru:
![]()
gdzie:
![]()
- masa sączka przed pobraniem próbki w [![]()
]
![]()
- masa sączka po pobraniu próbki w [![]()
]
Próbka1:
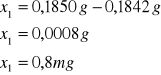
Próbka2:

Próbka3:
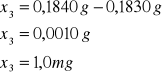
Próbka4:
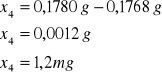
Próbka5:
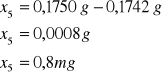
Szybkość przepływu powietrza wynosiła ![]()
a czas pobierania próbki pyłu ![]()
minut.
Stężenie pyłu obliczono z wzoru:
![]()
gdzie:
![]()
- masa pyłu w [![]()
]
![]()
- objętość zassanej próbki powietrza w ![]()
Próbka1:
![]()
Próbka2:
![]()
Próbka3:
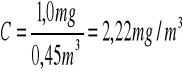
Próbka4:
![]()
Próbka5:
![]()
Następnie obliczono wartości ![]()
:
Próbka1:
![]()
Próbka2:
![]()
Próbka3:
![]()
Próbka4:
![]()
Próbka5:
![]()
Obliczono średnią ważoną otrzymanych wartości stężeń pyłu z wzoru:
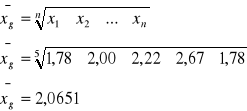
A wartość ![]()
i obliczono wartości wyrażenia 
:
Próbka1:
![]()
Próbka2:
![]()
Próbka3:
![]()
Próbka4:
![]()
Próbka5:
![]()
Logarytm odchylenia standardowego średniej geometrycznej obliczono ze wzoru:

Logarytm Dolnej Granicy przedziału ufności obliczono ze wzoru:
![]()
gdzie: ![]()
-wielkość z tablic statystycznych testu Studenta-Fischera dla poziomu ufności ![]()
wynosząca w naszym przypadku ![]()

Logarytm Górnej Granicy przedziału ufności obliczono ze wzoru:
![]()

Pył zawierający wolną(krystaliczną) krzemionkę od ![]()
do![]()
posiada najwyższe dopuszczalne stężenie-![]()
wynoszące ![]()
.

Wyszukiwarka
Podobne podstrony:
6120
6120, scenariusze zajęć z internetu
6120
6120
6120
6120
6120
New HWID version 6120 version 2
więcej podobnych podstron
