
22. Węglowce (pierwiastki p-elektronowe), zmiana struntury elektronowej i elektroujemności ze wzrostem liczby atomowej, niemetaliczność C i Si, półmetaliczność Ge, metaliczny charakter Sn i Pb oraz ich amfoteryczność.
W szeregu pierwiastków należących do węglowców zaznacza się wyraźnie przejście od pierwiastków o charakterze niemetalicznym (C i Si) do pierwiastków o charakterze metalicznym (Sn i Pb). german (Ge) znajdujący się pośrodku grupy ma wszelkie cechy pierwiastka o właściwościach pośrednich. Wspólną ich cechą jest występowanie czterech elektronów walencyjnych w konfiguracji s2p2. Elektroujemność tych pierwiastków rośnie w górę grupy (maleje ze wzrostem liczby atomowej). Zdolność do tworzenia prostych kationów jest tym większa im mniejsza jest elektroujemność, i tym większa im więcej powłok zawiera pierwiastek.
Sn, Pb → amfoteryczne
SnO2 + 4HCl → SnCl4 + 2H2O
SnO2 + 2KOH → K2SnO3 + H2O
SnO2 + H2O → X
23. Stopnie utlenienia i charakter wiązań w związkach oraz wzrost trwałości niższych stopni utlenienia węglowców ze wzrostem liczby atomowej.
Zbyt niska elektroujemność powoduje, że węglowce nie tworzą jonów ujemnych X-4. W postaci C2- węgiel występuje tylko w węglikach typu soli stanowiących połączenia węgla z metalami o małej elektroujemności. Uzyskanie trwałej konfiguracji elektronowej przez węglowce polega natomiast na tworzeniu 4 wiązań kowalencyjnych przy udziale orbitali ulegających hybrydyzacji tertagonalnej sp3. W przypadku węgla takie wiązania z wodorem, azotem, tlenem i ciężkimi halogenami wykazują dominujący charakter kowalencyjny (także z fluorem). Na stopniu utlenienia +4 wszystkie węglowce tworzą dwutlenki wykazujące własności kwasowe. Stopień utlenienia +4 staje się coraz mniej trwały w miarę jak zwiększa się liczba atomowa pierwiastka, węgiel i krzem (C i Si) na tym stopniu utlenienia +2 występują tylko wyjątkowo (Co, SiO). Nieco luźniejsze są połączenia germany (GeO, GeS, GeI2). Cyna (Sn) może występować w postaci jonów Sn2+ wykazujących jednak wyraźne własności redukujące. Związki ołowiu na tym stopniu (+2) są również jonowe.
Para elektronowa ns2 w miarę wzrostu liczby atomowej staje się coraz bardziej bierną parą, nie biorącą udziału w tworzeniu wiązań.
Węgiel wykazuje zdolność do tworzenia prostych, rozgałęzionych lub zamkniętych w pierścienie łańcuchów złożonych z atomów węgla, łańcuchy te są trwałe dzięki wysokiej energii wiązania C-C, dwukrotnie większej niż Si-Si lub Ge-Ge (są one nietrwałe). Natomiast wiązanie Si-O-Si-O są trwalsze od C-O-C
Katenacja - zdolność tworzenia łańcuchów wieloatomowych.
24. Występowanie węgla; Rodzaje i charakterystyka węgli kopalnych: ropa naftowa, gaz ziemny, najważniejsze minerały nieorganiczne.
Węgiel bezpostaciowy powstaje w wyniku termicznego rozkładu licznych substancji, występuje jako węgiel drzewny i kostny, sadza, koks itp. Właściwości węgli bezpostaciowych zależą od natury produktu wyjściowego oraz temperatury, w której przeprowadzono jego rozkład. Badania rentgenowskie wykazały że, składają się z bardzo małych krystalitów wykazujących silnie zdefektowaną sieć przestrzenną grafitu. W przypadku rozkładu w stosunkowo niskiej temperaturze ok. 400oC węgiel wydziela się w postaci porowatej i gąbczastej masy zawierającej krystality o rozmiarach rzędu 20 (sadza, węgiel kostny i drzewny). Jeżeli rozkład przebiega w temperaturze 800oC krystality są większe i zrastają się w koks. W temperaturze ok. 1500oC uzyskuje się produkt o krystalitach 60 A zbliżony do grafitu (retortowy) zdolny do przewodzenia prądu.
Sadza - jest produktem rozkładu termicznego licznych węglowodanów a także niezupełnego spalenia różnych substancji organicznych. Technicznie powstaje w wyniku działania silnie kopcącego płomienia na powierzchnię metalową chłodzoną od wewnątrz wodą. Stosuje się do wyrobu tuszu, farb drukarskich i malarskich i do wypełniania kauczuku.
Węgiel drzewny - otrzymuje się ogrzewając drzewo bez dostępu powietrza (sucha destylacja). Dawniej znaczył jako dobry materiał opałowy i jeden ze składników prochu dymnego. Odznacza się dobrymi właściwościami adsorpcyjnymi. Węgiel otrzymany przez zwęglenie kości zwany kostny w niskiej temperaturze z dodatkiem ZnCl2 bywa używany jako środek odbarwiający, odwaniający, materiał do wypełniania pochłaniaczy w maskach gazowych.
Koks - powstaje w procesie suchej destylacji węgla kamiennego w temperaturze 1000-1200oC. Ma zastosowanie jako opał. Szczególne zastosowanie ma przy wytopie żelaza surowego w wielkich piecach dzięki zwiększonej wytrzymałości mechanicznej.
Węgiel jest źródłem energii w przemyśle, środkiem redukującym stosowanym w otrzymywaniu niektórych metali. Izotop 14C jest wskaźnikiem promieniotwórczym. Liczne zastosowania mają organiczne związki węgla, np. polimery → zagadnienia 39. Złoża węgla powstały w odległych okresach geologicznych. Nieustanne powolne, obniżające ruchy skorupy ziemskiej, spowodowały, że w powstających zagłębieniach gromadziły się ogromne ilości szczątków roślin: olbrzymich skrzypów, widłaków, paproci. Rośliny zostały przykryte warstwami skał osadzonych później i odcięte od dostępu tlenu. Pod wpływem działania temperatury i ciśnienia, w wyniku skomplikowanych reakcji chemicznych zachodzących przez tysiące lat, martwe organizmy roślinne zostały przekształcone w pokłady węgla. Często na lśniących bryłach węgla można znaleźć odciśniętą wizytówkę roślin pochodzących z karbonu, tj. okresu w którym tworzyły się właśnie bogate złoża węgla. Węgiel tworzy złoża węgli kopalnych (mieszaniny węgla i związków węgla) antracyt 95%, węgiel kamienny do 90%, węgiel brunatny do 65% i torf do 65%. Ponadto węgiel wchodzi w skład milionów związków organicznych i odgrywa ważną rolę w przyrodzie. Przykładem może być wapień i krzem w postaci krzemionki. Złoża węgla w świecie są liczne. W Polsce jest głównym surowcem energetycznym. Oprócz węgla ważnymi surowcami energetycznymi są ropa naftowa i gaz ziemny.
Ropa naftowa - jest oleistą cieczą o charakterystycznym zapachu, palna. Na dziś mimo rosnącej roli nośników energii jest surowcem strategicznym jaki wynika z dużej kaloryczności 10000-11500 kcal/kg. Jest mieszaniną węglowodorów, kwasów karboksylowych, fenoli, żywic, związków metaloorganicznych. Skład ropy jest zmienny i zależy od miejsca wydobycia. Jest przerabiana metodami destylacji, rafinacji, ekstrakcji selektywnymi rozpuszczalnikami, krystalizacji. Z ropy otrzymujemy eter naftowy, benzynę, naftę, oleje mineralne, mazut oraz surowce dla przemysłu chemicznego np. benzen, ksyleny.
Największe złoża znajdują się w Arabii Saudyjskiej, Iranie, Iraku, Kuwejcie, USA, Emiratach Arabskich. Inne ważne obszary to Rosja, Alaska.
Gaz ziemny - jest mieszaniną lotnych węglowodorów, głównie metanu, etanu, propanu i butanu oraz niewielkich ilości powietrza, siarkowodoru i innych. Towarzyszy często złożom ropy naftowej. Jest paliwem znacznie droższym od węgla, ale o wiele czystszym ekologicznie. Oparcie polskiej energetyki na gazie wymagałoby kilkakrotnego zwiększenia jego importu. Największe złoża tego surowca występują w Rosji, Zatoce Perskiej, północnej Afryce, Zatoce Meksykańskiej o Morzu Karaibskim.
Innym źródłem węgla są minerały:
→CaCO3 - kalcyt, podstawowy składnik skał wapiennych, tj. wapieni, marmuru i kredy.
→MgCO3 -magnezyt
→CaCO3 ∙ MgCO3 - dolomit
→FeCO3 - syderyt
25. Odmiany alotropowe węgla, węgiel bezpostaciowy, fullereny.
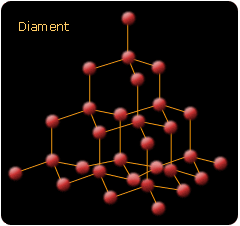
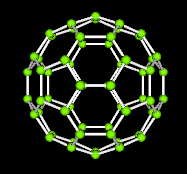
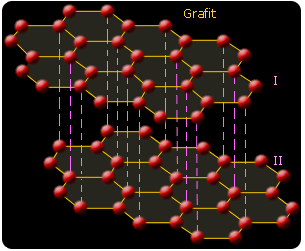
Odmiany alotropowe węgla to: diament, grafit i fullereny.
Diament - w stanie czystym tworzy bezbarwne przezroczyste kryształy, bardzo twarde, silnie łamiące światło, nie przewodzące prądu elektrycznego. Ich ciężar właściwy wynosi 3,5 g/cm. W zależności od rodzaju i ilości zanieczyszczeń kryształy diamentu bywają zabarwione żółto, czerwono, brunatno, niebiesko lub fioletowo. Znane są również czarne diamenty zwane karbonado. Oszlifowane diamenty, zwane brylantami, odznaczają się piękną grą świateł i uważane są za najpiękniejsze kamienie szlachetne. Okazy nadające się do celów jubilerskich spotyka się bardzo rzadko. Przeważającą ich część zużywa się do celów technicznych: szlifowania bardzo twardych ciał, cięcia szkła, wyrobu ostrzy do świdrów górniczych, a także łożysk do osi w precyzyjnych przyrządach. Diament ogrzewany bez dostępu powietrza przechodzi powyżej temperatury 500oC w grafit. Przechodzenie w odwrotnym kierunku jest trudne i udało się dopiero pokonać w ostatnich latach. Pod względem chemicznym stanowi substancję bardzo mało aktywną nawet w wysokich temperaturach.

Nie ulega działaniu kwasów ani zasad. Atakuje go natomiast stopiona saletra i stopiony węglan sodowy. W powietrzu spala się dopiero powyżej 800oC. W czystym tlenie spalanie przebiega bardziej gwałtownie. Nawiązując do budowy w sieci każdy atom węgla jest otoczony przez inne 4 atomy, których środki ciężkości wyznaczają czworościan foremny. Sieć można traktować jako dwie sieci nawzajem się przenikające w ten sposób, że jedna z nich jest przesunięta w stosunku do drugiej wzdłuż przekątnej komórki elementarnej o jedną jej długość.
Grafit - druga odmiana alotropowa węgla występująca również w postaci minerału, przedstawia się jako ciało czarno szare, o słabym połysku metalicznym, tłustawe w dotknięciu bardzo miękkie, dobrze przewodzące elektryczność i ciepło. Ciężar właściwy wynosi 2,1-2,3.
Grafit znajduje liczne zastosowanie np. ze względu na odporność na wysokie temperatury z drobnymi domieszkami gliny jako środek wiążący do wyrobu tygli do topienia metali. Dzięki dobremu przewodnictwu elektrycznemu stosuje się do wyrobu elektrod dla przemysłu elektrochemicznego i elektrometalurgicznego. Służy do wyrobu ołówków a w formie zawiesiny jako smar dla mechanizmów pracujących w podwyższonych temperaturach. Ważne jest jego zastosowanie jako moderatora w stosach atomowych. Pod względem chemicznym jest substancją mało aktywną łatwiej wstępuje w reakcje niż diament. W powietrzu spala się po ogrzaniu do 700oC. Tworzy szereg połączeń określanych jako związki grafitu, w których zostaje zachowana warstwowa struktura sieci przestrzennej, a obce atomy wiązane za pośrednictwem elektronów π grafitu rozmieszczone są między warstwami.
Grafit Diament Fulleren
Fullereny - odmiana otrzymana sztucznie; odnajdywane w przyrodzie są najprawdopodobniej pochodzenia pozaziemskiego, ponieważ gazy szlachetne uwięzione w ich wnętrzu mają nietypowy stosunek izotopów. Istnieje teza wystąpienia ich w kosmosie. Mimo braku potwierdzenia ich obecności fullery znaleziono w próbkach z dwóch wielkich kraterów, które powstały niegdyś 1,85 mld lat temu w wyniku zderzeń Ziemi z kometami lub planetoidami. Również w górach stanu Colorado występuje tzw. fulguryt zawierający fullereny. Prawdopodobnie utworzył się podczas uderzeń piorunów. Fullereny, cząsteczki węgla zawierające od kilkudziesięciu do kilkuset atomów wchodzących w skład kryształów molekularnych tworzących odmianę alotropową węgla. Cząsteczki te składają się z pierścieni pięcio- i sześcioatomowych, tworzących zamkniętą strukturę kopuł geodezyjnych skonstruowanych przez R. Buckminstera Fullera (stąd nazwa). Fullereny łatwo sublimują, są dobrze rozpuszczalne w rozpuszczalnikach organicznych. Najbardziej trwałe fillery to: C32, C44, C50, C58, C70, C240, C540, C960. Łatwo sublimują cząsteczki C60 (zwane futoblanami - ze względu na kształt przypominający piłkę nożną) najbardziej stabilne mają kształt piłki nożnej o średnicy 1 mm, można je otrzymać przez laserowe odparowanie grafitu w atmosferze helu lub wytworzenia łuku elektrycznego między elektrodami grafitowymi. Wewnątrz cząsteczki fullerenu można umieścić atomy metali (tzw. metalofullereny). Przewiduje się, iż fullereny i ich metaliczne związki znajdują zastosowanie jako przewodniki, półprzewodniki, nadprzewodniki, smary, włókna sztuczne, farmaceutyki.
26. Redukcyjne własności węgla, reakcje z: tlenem, z CO2 (równowaga CO2 + C ↔ 2CO), z fluorem, siarką, azotem, tlenkami metali i z parą wodną (gaz syntezowy).
1) Z tlenem (CO, CO2, C3O2, C5O2, C12O9)
HCOOH ![]()
CO + H2O
CO spala się w powietrzu niebieskim płomieniem, wydzielając duże ilości ciepła
CO + O2 → CO2 + 567 kJ/mol
*C +H2O → CO + H2 ← gaz syntezowy CO + 3H2 → CH4 + H2O
CO - gaz wodny otrzymywany przez wdmuchiwanie pary wodnej na warstwę rozżarzonego koksu.
*C + O2 → CO2 - gaz generatorowy otrzymywany przy przepuszczaniu powietrza poprzez warstwy rozżarzonego koksu. CO2 reaguje z koksem
*CO2 + C ↔ 2CO (równanie Boudouarda) ΔH>0
Aby przesunąć równowagę w lewo należy zmniejszyć ciśnienie i podwyższyć temperaturę.
2) Z tlenkami metali
Co jest reduktorem tlenków metali
Fe2O3 + 3CO ![]()
2Fe + 3CO2
CuO + CO ![]()
Cu + CO2
CO - gaz bezbarwny, bezwonny, silnie trujący, słabo rozpuszczalny w wodzie
CO2 - gaz bezbarwny, bezwonny, nie pali się, nie podtrzymuje palenia, rozpuszczalny w H2O, tworząc kwas węglowy
CO2 + H2O → H2CO3
3) Z siarką
*C + S2 → CS2
CS2 - dwusiarczek węgla, otrzymywany przez działanie par siarki na węgiel drzewny, bezbarwna, ruchliwa ciecz
CO + S → COS - tlenosiarczek
Działając CS2 na siarczki litowców otrzymuje się tiowęglany
K2S + CS2 → K2CS3
4) Z azotem
*2C + N2 → C2N2 = (CN)2
Dicyjan - bezbarwny, gaz o zapachu gorzkich migdałów, dobrze rozpuszczalny w wodzie i alkoholach. Pali się niebieskim płomieniem z czerwoną otoczką, wprowadzony do roztworu wodorotlenków daje mieszaninę cyjanków i cyjanianów:
(CN)2 +OH- ↔ CN (jon cyjankowy) + NCO- (jon cyjanianowy) + H2O
(CN)2 + 2KOH ↔ KCN + KCNO + H2O
CN - posiada wolną parę elektronową, tworzy wiązania koordynacyjne
HCN - cyjanowodór, otrzymywany:
NaCN + HCl → HCN + NaCl (kwas pruski, posiada wiązania wodorowe)
HCN występuje w dwóch postaciach izomerycznych
H-C≡N ↔ C≡N-H
cyjanowodór izocyjanowodór
HCN ulega w wodzie słabej dysocjacji
HCN + H2O ↔ H3O+ + CN-
Jony cyjankowe tworzą kompleksy z metalami grup przejściowych np. Fe3+ - heksacyjanożelaziany
5) Z fluorem
C + 2F2 → CF4

27. Połączenia węgla z fluorowcami (proste i mieszane), zastosowanie freonów.
Węgiel tworzy z fluorowcami połączenia typu CX4 - halogenki metali.
CF4 - czterofluorek węgla, produkt działania fluoru na węgiel w wysokiej temperaturze. Bezbarwny gaz, bardzo oporny na działanie podwyższonej temperatury.
Fluoranem ??? posiadającym podwójne wiązanie jest C2F4. Pod zwiększonym ciśnieniem ulega polimeryzacji z utworzeniem bezbarwnej stałej masy zawierającej długie łańcuchy.
nC2F4 ![]()
-CF2 CF2 CF2 CF2-
Tak otrzymany poli(tetrafluoroetylen) jest oporny na działanie czynników chemicznych i jest cennym tworzywem syntetycznym pod nazwą TEFLON.
CCl4 - otrzymywany przez wprowadzenie chloru do dwusiarczku węgla w obecności jodu lub chlorku magnezu II
2S2 + 3Cl2 → CCl4 + 6S
W obecności FeS dwusiarczek siarki reaguje dalej z nadmiarem CS2, powstają dalsze porcje CCl4:
2S2Cl2 + CS2 → CCl4 + 6S
CCl4 jest bezbarwną cieczą o charakterystycznym odurzającym zapachu, trudno rozpuszczalna w wodzie. W temperaturze pokojowej nie reaguje z kwasami i zasadami, nie ulega hydrolizie. Stosowany jako rozpuszczalnik tłuszczów i żywic
CJ4, CBr4 - ciała stałe
Halogenki mieszane:
CCl2F2; CF3Cl
Dichlorofluorometan (freon) - fluoroorganiczny związek stosowany w chłodnictwiei przemyśle kosmetycznym (jako gaz nośny w rozpylaczach aerozolowych).
28. Otrzymywanie i własności disiarczku oraz tetrachlorku węgla
Disiarczek węgla CS2:
C (drzewny) + S2 (g) ![]()
CS2
CH4 + 2S2 (g) ![]()
CS2 + 2H2S
Disiarczek węgla:
-bezbarwna, ruchliwa ciecz
-silnie łamiąca światło
-łatwo lotna
-słabo rozpuszczalna w H2O
-rozpuszcza się w rozpuszczalnikach organicznych: (alkohole, eter, benzen)
-bardzo łatwo palna; jej pary tworzą z powietrzem lub O2 mieszaniny wybuchowe
-reakcja z siarczkami litowców:
K2S + CS2 → K2CS3 tiowęglan
K2CS3 + H2SO4 → K2SO4 + H2CS3 kwas tiowęglowy
Tetrachlorek węgla CCl4:
CS2 + 3Cl2 ![]()
CCl4 + S2Cl2
CS2 + 2S2Cl2 ![]()
CCl4 + 6S
Tetrachlorek węgla
-bezbarwna, oleista ciecz
-nierozpuszczalna w H2O
-odporna na kwasy i zasady w temperaturze pokojowej
-bardzo dobry rozpuszczalnik żywic, tłuszczów i innych substancji organicznych.
29. Otrzymywanie cyjanków w reakcji węgla z amidkiem sodowym, otrzymywanie i właściwości cyjanowodoru oraz dicyjanu, otrzymywanie i właściwości tiocyjanianów.
2NaNH2 + 2C ↔ 2NaCn + 2H2↑
(CN)2 + H2 → 2HCN
NaCN + HCl → NaCl + HCN
H2S (g) + Hg(CN)2 → 2HCN + HgS
HCN - bezbarwna ciecz o zapachu gorzkich migdałów, bardzo trujący. Ma dużą temperaturę wrzenia (wiązania wodorowe)
N2 + 2C → C2N2 = (CN)2 bardzo trudno
Hg(CN)2 → Hg + (CN)2
Hg(CN)2 + HgCl2 → Hg2Cl2 + (CN)2
CuSO4 + 2KCN → Cu(CN)2 + K2SO4
Dicyjanian
-trujący gaz, zapach gorzkich migdałów
-dobrze rozpuszczalny w H2O i alkoholu
-pali się niebieskim płomieniem z czerwoną otoczką
-w roztworze alkalicznym dysproporcjonuje:
(CN)2 + 2OH- ↔ CN- + HCO- + H2O
Tiocyjaniany = rodanki
NaCN + S → Na SCN ma 2 postacie izomeryczne
|| ||
Na-N=C=S
||
Ze względu na wolne pary elektronowe, może tworzyć kompleksy np.: [Fe3+(NCS)6]3- czerwony
H-S-C≡N ↔ H-N=C=S
tiocyjanian izocyjanian

30. Otrzymywanie i własności węglików metali (węgliki jonowe i międzywęzłowe)
Węgliki są to związki węgla z pierwiastkami wykazującymi mniejszą od niego elektroujemność (czyli metale: krzem, bor).
Można je podzielić na węgliki jonowe (czyli tzw. węgliki typu soli) oraz na węgliki międzywęzłowe.
*Do pierwszej z grup należą węgliki metali grup IA, IIA, IIIA układu okresowego. Zawierają one aniony C4-, C22- lub C34-.
Otrzymywanie:
Poprzez ogrzewanie odpowiedniego metalu (lub jego tlenku) z węglem lub węglowodorami. Pod działaniem H2O na te węgliki tworzy się metan, acetylen lub metyloacetylen (są więc odpowiednio: metanki, acetylenki i allilki).
Przedstawicielem metanków jest węglik glinu Al4C3 do acetylenków: Na2C2, BaC2, Al2C6 i najważniejszy z nich → węglik wapnia CaC2.
CaC2 jest wytwarzany na dużą skalę poprzez ogrzewanie w piecach elektrycznych tlenku wapnia z koksem.
CaO + 3C → CaC2 + CO
Czysty CaC2 nie reaguje z azotem. Reakcję tą daje produkt techniczny (temp. 1200oC). Prowadzi do otrzymania cyjanoamidu wapnia CaCN2.
CaO2 + N2 → CaCN2 + C
który pod wpływem H2O wydziela amoniak:
CaCN2 + 3H2O → CaCO3 + 2NH3↑
CaCN2 używany jest jako nawóz sztuczny, azotniak.
Do allilków zaliczamy Mg2C3 (wprawdzie jedyny znany!). Z wodą reaguje:
Mg2C3 + 2H2O → 2MgO + HC≡C-CH3
→Węgliki międzywęzłowe powstają w bardzo wysokich temperaturach (2000oC) w wyniku bezpośredniego działania węgla na metale grup IVB, VB, VIB.
Cechy:
-trudnotopliwe, twarde i kruche zarazem, odporne pod względem chemicznym, ulegają tylko działaniu środków utleniających mają charakterystyczny połysk, dobre przewodnictwo elektryczne.
Ze względu na wysoką twardość i ogniotrwałość wyżej wymienione, mają zastosowanie do wyrobu materiałów, którymi pokrywa się ostrza do szybkościowego skrawania metali.
Węgliki chromu, manganu, żelaza, kobaltu i niklu (tj. metali o promieniu atomowym mniejszym od 1,3 A) zajmują pod względem własności miejsce pośrednie pomiędzy węglikami międzywęzłowymi a jonowymi. Od węglików międzywęzłowych różnią się one strukturą sieci przestrzennej oraz mniejszą odpornością chemiczną. Reagują np.: z H2O ......kwasami (np. Fe3C zwany cementytem).
31. Otrzymywanie oraz własności CO jako tlenku obojętnego i silnego reduktora (reakcje z tenem, tlenkami metali i chlorem).
CO powstaje w wyniku spalania C przy niedostatecznym dopływie O2. CO jest wytwarzany na dużą skalę jako składnik gazu generatorowego i wodnego.
2C + O2 → 2CO + 52,8 kcal
Jest gazem bezbarwnym, bezwonnym, silnie trującym. W H2O słabo się rozpuszcza. Nieco lżejszy od powietrza. W CO występuje hybrydyzacja dygonalna, tzn. że ulega w nim wymieszaniu orbital 2s i jeden z orbitali 2p.
:C≡O: - tworzy związki kompleksowe w których spełnia rolę donora elektronów
Jest silnym reduktorem, ze względu na duże powinowactwo chemiczne do ..................
Znajduje zastosowanie w metalurgii do redukowania tlenków metali.
W obecności węgla aktywnego lub katalizatora wytwarza z chlorem chlorek karbonylu = fosgen (gaz silnie trujący):
CO + Cl2 → COCl2
Z parami siarki daje tlenosiarczek węgla COS
Duże znaczenie praktyczne mają reakcje CO z H2, w wyniku których w zależności od ciśnienia, temperatury i użytego katalizatora powstają różne produkty (np. alkohol metylowy, alkohole wyższe, benzyna) np.:
CO + 2H2 → CH3OH ![]()
CH3COOH
nCO + (2n + 1)H2 → CnH2n+2 + nH2O
nCO + 2nH2 → CnH2n + nH2O
Gaz generatorowy: CO, H2, CH4, CO2
Reduktor
Fe2O3 + CO → 2Fe + 3CO2
CuO + CO → Cu + CO2
NaOH + CO → HCOONa
32. Reakcje CO z wodorem, z wytworzeniem CH3OH (CH3COOH), CH4, CH2=CH2.
Tlenek węgla jest związkiem słabo reaktywnym, ale wobec odpowiednich katalizatorów oraz ciśnienia i temperatury wchodzi w wiele ważnych technicznie reakcji:
CO + 2H2 ![]()
CH3OH ![]()
CH3COOH kwas octowy
CO + 3H2 ![]()
CH4 + H2O
2CO + 4H2 → CH2=CH2 + 2H2O
33. Karbonylki
Z wieloma metalami (Fe, Ni, Co, Cr, Mo_ tlenek węgla tworzy związki zwane karbonylkami,
Men(CO)m
-karbonylki proste
-karbonylki dwurdzeniowe
-karbonylki wielordzeniowe
Związki te otrzymuje się pod wpływem działania tlenku węgla pod wysokim ciśnieniem na rozdrobnione metale. Karbonylek niklu tworzy się pod zwykłym ciśnieniem.
Ni + 4CO → Ni(CO)4 (łatwolotna ciecz)
Fe + 5CO → Fe(CO)5
Fe(CO)5 żółty; Fe2(CO)9; Fe3(CO)12; Co2(CO)8; Co4(CO)12
Karbonylek Fe(CO)5 i Ni(CO)4 są cieczami dającymi się destylować, pozostałe są substancjami krystalicznymi, łatwo rozkładającymi się pod wpływem ogrzewania, a nawet pod wpływem światła.
Karbonylki wielordzeniowe otrzymuje się z karbonylków prostych w wyniku reakcji fotochemicznych np. Fe(CO)5 → naświetlany promieniowaniem nadfioletowym → powstaje Fe2(CO)9 lub w wyniku kondensacji w podwyższonej temperaturze przechodzi w → Fe3(CO)12.
Proste karbonylki metali gr. VI B są ciałami stałymi, VIII - cieczami.
Wszystkie są bezbarwne, wszystkie są diamagnetykami (!!wyjątek karbonylek wanadu - paramagnetyk).
Karbonylki jako typowe związki kowalencyjne - rozpuszczają się dobrze w rozpuszczalnikach organicznych np. w eterze. Można je przedestylować, w podwyższonej temperaturze rozkładają się na ..... i tlenek węgla.
*w szeregu pionowym układu okresowego - trwałość karbonylków wzrasta
*w szeregu poziomym - maleje (ze wzrostem liczby atomowej)
*wiele karbonylków wykazuje znaczną reaktywność i wstępuje w liczne reakcje prowadzące do otrzymania różnych związków pochodnych np.:
-wodorokarbonylki HMn(CO)5
-pochodne nitrozylowe Fe(CO)2(NO)2
-halogenkowe Fe(CO)4Br2
*są trujące, zwłaszcza lotne
*cząsteczki CO przyłączając się do centralnego atomu metalu tworzą wiązania koordynacyjne przy użyciu wolnej pary elektronowej atomu C
*cząsteczka Fe(CO)5 - kształt bipiramidy
*cząsteczka Ni(CO)4 - kształt tetraedryczny
*karbonylki wielordzeniowe - z dwu lub 3 oktaedrów
*karbonylki zawierają atomy metalu w zerowym stopniu utlenienia, jednak ich struktura elektronowa jest różna od struktury swobodnego atomu.
34. Toksyczność CO (czad, szkodliwość palenia tytoniu).
35. Otrzymywanie oraz własności CO2 jako bezwodnika kwasowego. Zastosowanie do produkcji wody sodowej.
36. Zastosowanie stałego CO2 (gaśnice śniegowe, suchy lód)
Dwutlenek węgla CO2 występuje w przyrodzie w stanie wolnym (np. powietrze) i w stanie związanym (węglany wapnia i magnezu). Tworzy się w procesach oddychania, fermentacji oraz utleniania i spalania połączeń organicznych w powietrzu.
*w technice otrzymuje się CO2 spalając węgiel przy obfitym dostępie powietrza:
C + O2 → CO2 + 94,0 kcal
*oraz jako produkt wypalania wapieni w temperaturze powyżej 900oC:
CaCO3 → CaO + CO2
*w pracowni chemicznej CO2 wywiązuje się w aparacie Kippa w wyniku działania kwasu solnego na marmur:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Właściwości CO2:
CO2 jest gazem bezbarwnym, bez zapachu, o kwaskowatym smaku, nie pali się ani też nie podtrzymuje palenia. Jego ciężar w warunkach normalnych jest 1,5 razy większy od ciężaru powietrza. Dobrze rozpuszcza się w wodzie, daje się łatwo skroplić ze względu na wysoką temperaturę krytyczną (31,3oC), skroplony przedstawia się jako ciecz bezbarwna ............. .
Skroplony CO2 jest rozprowadzany w handlu w stalowych butlach. Podczas swobodnego wypływu z butli ciecz paruje bardzo gwałtownie i oziębia się tak znacznie, że częściowo ulega zestaleniu, otrzymany w ten sposób suchy lód wykorzystuje się, zwłaszcza w mieszaninie z alkoholem metylowym, acetonem lub eterem, jako środek oziębiający.
Cząsteczka tlenku węgla ma budowę liniową typu sp. CO2 jest mało aktywny chemicznie. CO2 jest bezwodnikiem kwasu węglowego obecnego w małym stężeniu w roztworach wodnych tego gazu i nadającego im słabo kwaśny odczyn:
H2O + CO2 ↔ H2CO3 ![]()
H3O+ + CO22-
37. Zastosowanie CO2 do produkcji sody kalcynowanej
Soda kalcynowana - Na2CO3 - biała substancja krystaliczna, rozpuszczalna w wodzie. Tworzy hydraty, posiada właściwości higroskopijne, w roztworach wodnych hydrolizuje. Pod wpływem kwasów ulega rozkładowi wydzielając CO2.
Na skalę przemysłową węglan sodu otrzymuje się metodą amoniakalną Solvaya, której zasadniczym etapem są: wprowadzenie CO2 do roztworu chlorku sodu nasyconego amoniakiem. W wyniku czego powstaje wodorowęglan sodu oraz termalny rozkład (kalcynacja) odsączonego wodorowęglanu z utworzeniem węglanu sodu.
NH3 + CO2 + H2O → NH4HCO3
NH4HCO3 + NaCl ↔ NaHCO3 + NH4Cl
2NaHCO3 ↔ Na2CO3 + H2O + CO2
NH4Cl + Ca(OH)2 → CaCl2 + 2H2O + NH3
38. Rola biologiczna CO2, procesy fotosyntezy, oddychania, obecność CO2 w powietrzu, efekt cieplarniany.
..................
Fotosynteza - proces syntezy prostych związków organicznych z dwutlenku węgla i wody przebiegający dzięki wykorzystaniu energii świetlnej pochłanianej przez barwniki.
Fotosynteza przebiega według ogólnego równania:
6CO2 + 6H2O + energia świetlna → C6H12O6 + 6O2
Stanowi podstawę życia na Ziemi dostarczając tlenu i ogromnych ilości związków organicznych.
Oddychanie - procesy enzymatyczne przebiegające w komórce każdego organizmu, w których wyniku cząsteczki organiczne zostają rozłożone do CO2 i H2O, a powstająca energia zostaje zachowana i zmagazynowana w postaci użytecznej biologicznie.
Efekt cieplarniany - ............................................... ................................. ................................. ................................. ................................. ................................. ................................. ................................. ................................. ................................. ................................. ................................. ................................. ................................. ................................. ................................. ................................. ................................. ................................. ................................. ................................. ................................. ................................. ................................. ................................. ................................. ................................. .................................
Przyczyny:
Nadmierne gromadzenie się gazów cieplarnianych spowodowane między innymi przeszło stu letnim rozwojem przemysłu i spalaniem paliw kopalnych - węgla i ropy naftowej, emisją metanu (rolnictwo, odpady) i freonów (całkowicie pochodzą z przemysłu), a także wypalaniem lasów (wylesienie i pożary) oraz jednym z największych źródeł dwutlenku węgla - motoryzację.
Skutki:
Najgorszym z przewidywalnych skutków jest globalne ocieplenie klimatu. Spowodować to może podwyższenie poziomu mórz na kuli ziemskiej, które zostaną zasilone wodami z topniejących lodowców i lodów polarnych. Drugą poważną konsekwencją ocieplania się Ziemi jest tzw. wędrówka stref klimatycznych to znaczy przesunięcie się stref w kierunku biegunów. Wraz ze strefami przemieszczają się charakterystyczne dla danego klimatu opady.
Gazy cieplarniane:
-CH4
-CO2
-freony CF2Cl2
-NO
-O3 troposfera
39. Rola węgla w przyrodzie (organiczne związki węgla, toksyczność CO i rola biologiczna CO2).
Organiczne związki węgla - sądzono, że związki organiczne są produktami świata roślinnego i zwierzęcego, przełomem było otrzymanie przez Wöhlera w 1929 r. ??? mocznika z typowo nieorganicznego związku jakim jest cyjanian (izocyjanian) amonu:
NH4NCO ![]()
(NH2)2CO
Szczególne właściwości węgla:
-w związkach organicznych jest czterowartościowy
-ma zdolność łączenia się między sobą (katenacja)
-tworzy długie łańcuchy i złożone struktury pierścieniowe
-ma tendencję do tworzenia wiązań wielokrotnych
-ma skłonność do tworzenia trwałych, kowalencyjnych wiązań z H, O, N, S
*Węglowodory - zbudowane wyłącznie z węgla i wodoru
Alkany |
Alkeny |
Alkiny |
CnH2n+2 |
CnH2n |
CnH2n-2 |
|
|
|
*Areny - węglowodory aromatyczne, budowa pierścieniowa; wiązania zdelokalizowane łączące wszystkie atomy węgla.
*Halogenki - fluorowco pochodne węglowodorów, są to ciecze nierozpuszczalne w H2O, wzór ogólny R-X.
H3C-CH2 - Cl lub I, Br, F
Reszta węglowodorowa - Grupa funkcyjna
*Alkohole i fenole - u alkoholi grupa hydroksylowa jest połączona z tetraedrycznym atomem węgla R-CH, są to dobre rozpuszczalniki; u fenoli grupa hydroksylowa połączona jest z atomem węgla pierścienia aromatycznego Ar-OH, są to hydroksylowe pochodne arenów.
*Aldehydy i ketony: Aldehydy - grupa aldehydowa połączona z grupą alkilową lub anylową; Ketony - grupa karbonylowa połączona z dwiema resztami węglowodorowymi
*Kwasy karboksylowe - związki o wzorze ogólnym R-COOH
*Aminy - pochodne amoniaku R-NH2 ← grupa aminowa
*Amidy kwasowe - grupa -OH w grupie karboksylowej została zastąpiona grupą aminową -NH2
*Aminokwasy - związki dwufunkcyjne, cząsteczka zawiera grupę NH2 i COOH. Najprostszy aminokwas to kwas aminooctowy (glicyna). Występuje wiązanie peptydowe.
*Białka - polipeptydy złożone z więcej niż 100 reszt aminokwasowych.
*Węglowodany - związki o wzorze ogólnym CnH2nOn lub Cn(H2O)n.
Naturalne związki organiczne to: tłuszcze, białka, węglowodany
Podstawowe surowce w chemii organicznej to: gaz ziemny, ropa naftowa, węgiel kamienny.
40. Występowanie krzemu. Krzemionka, krzemiany, glinokrzemiany.
Występowanie krzemu - w związkach występuje na +4 stopniu utlenienia, właściwości kwasowe.
-jest kationoidem, tzn. występuje tylko w złożonych anionach
-w stanie rodzimym nie występuje
-najpospolitszym związkiem krzemu jest krzemionka, która występuje w przyrodzie w olbrzymich ilościach jako piaski i kwarc
-krzemionka uwodniona (kilka do kilkunastu %) występuje jako chalcedon
-krzem wchodzi w skład licznych krzemianów i glinokrzemianów, z których składa się skorupa ziemska (26,95%)
Krzemionka - SiO2 , dwutlenek krzemu
-najważniejszy związek krzemu z tlenem
-bezwodnik kwasów krzemowych
-bezbarwne ciało stałe
-nierozpuszczalny w wodzie i kwasach (oprócz fluorowodorowego)
SiO2 + 4HF → SiF4+ 2H2O - reakcja otrzymywania SiF4, wykorzystywana do trawienia szkła
-tworzy odmiany krystaliczne: kwarc, tryoymit, krystobalit ← odmiany polimorficzne
-główny składnik piasków i piaskowców
-w formie uwodnionej występuje jako chalcedon i jego odmiany:
*biały chalcedon zwyczajny
*czerwony korned??
*zielony oktyzopraz??
*plazma
*heliotrop
*krzemień
*agat
-stosowany do wyrobu szkła, produkcji materiałów budowlanych.
Krzemiany - sole kwasów krzemowych o wzorze ogólnym mSiO2 ∙ nH2O
-występują w przyrodzie
-nierozpuszczalne w wodzie i kwasach
-naturalne krzemiany odp. kwasom:
H2SiO3 - kwas metakrzmowy
H4SiO4 - kwas ortokrzemowy
H2Si2O5 - kwas dwumetakrzemowy
H6Si2O7 - kwas dwuortokrzemowy, itd.
-krzemiany i glinokrzemiany mają 5 podstawowych typów:
1)wysepkowy, np.:
-oliwin Mg2SiO4
-tortweityt Sc2(Si2O7)
2)łańcuchowy, np.:
-enstatyt MgSiO3
-spodumen LiAl(SiO3)2
3)pierścieniowy, np.:
-wolastonit Ca3(Si3O9)
-bentonit BaTi(Si3O9)
4)warstwowy, np.:
-talk Mg3(OH)2(Si4O20)
-kaolinit Al2(OH)4(Si2O5)
5)przestrzenny, np.:
-Ortoklaz KAlSi3O8
-Anoryt CaAl2Si2O3 ????
-laboratoryjnie otrzymuje się metakrzemiany o ogólnym wzorze Me2SiO3, stapiając krzemionkę SiO2 z sodą lub wodorotlenkami
2NaOH + SiO2 → Na2SiO3 + H2O
SiO2 ![]()
CO2 + Na2SiO3
-Na2SiO3 i K2SiO3 to jedyne krzemiany rozpuszczalne w wodzie (tzw. szkło wodne) ulegają hydrolizie, ponieważ są solami słabego kwasu.
-z rozcieńczonych roztworów wytrąca się trudno rozpuszczalny, galaretowaty kwas H2SiO3
-złożonym krzemianem sodowo-potasowym jest szkło
Glinokrzemiany
-podstawowy materiał tworzący litosferę
-związki, w których atomy glinu zastępują częściowo atomy krzemu.
-skorupa ziemska składa się ze skał i produktów ich wietrzenia.
Rozróżnia się 3 rodzaje skał:
1) magmowe - skrzepnięta magma (złożona z tlenków metali) pochodząca z głębi ziemi
2) osadowe - złożone głównie z węglanów wapniowców
3) metamorficzne - przeważnie łupki krystaliczne
-95% skorupy ziemskiej stanowi granit, główny składnik skał magmowych.
41. Kaolin (kaolinit) jako produkt wietrzenia skaleni. Reakcja kaolinizacji oraz wzór sumaryczny i tlenkowy kaolinu.
*Wietrzenie skaleni:
2NaAlSi3O8 + 2H2O + CO2 → Al2O3 ∙ 2SiO2 ∙ 2H2O + Na2CO3 + 4SiO2 + 2H2O (Kaolinit)
*Wzór tlenkowy:
Al2O3 ∙ 2SiO2 ∙ 2H2O
*Wzór sumaryczny:
Al2(OH)4(Si2O5)
*Kaolinit zbudowany jest z 2 warstw (pakietów):
-krzemotlenowej - Si2O5
-glinotlenowej - Al2O2(OH)4
42. Składniki gliny, produkcja wyrobów ceramicznych i cementu.
Gliny stanowią mieszaninę minerałów ilastych: kaolinit, holoizyd, montmorylonit, illit, endelit, będących produktami wietrzenia skał magmowych, głównie skaleni. Minerały te wykazują podobny skład ilościowy, różnią się stosunkiem SiO2 i Al2O3, a także zawartością związanej wody.
Najczystsze gatunki kaolinu (gatunek gliny zawierający głównie minerał kaolinit Al2(OH)4Si2O5 dają po wypaleniu biały produkt i używa się je do wyrobu porcelany. Masę porcelanową zawierającą 50% kaolinu oraz po 25% kwarcu i skaleni wypala się dwukrotnie. Pierwsze wypalanie w temp. 900oC daje porowaty produkt. Produkt ten pokrywa się szkliwem przez zanurzenie go w wodnej zawiesinie masy ceramicznej o niższej temperaturze topnienia niż masa porcelanowa.
W trakcie drugiego wypalania w 1400oC masa ta topi się i wytwarza szklistą warstwę nadającą elastyczny wygląd powierzchni gotowych wyrobów. W trakcie powtórnego wypalania ulegają stopieniu również skalenie obecne w masie ceramicznej. Powstała ciecz (zastygająca później na szkło w czasie oziębiania) wypełnia pory w pierwotnym produkcie, co powoduje że ostateczny produkt jest nieporowaty i nieprzepuszczalny dla gazów.
Z materiałów o najmniejszej czystości wyrabia się mniej szlachetne masy porowate (fajans) lub nieporowate (kamionka).
43. Otrzymywanie krzemu z krzemionki.
-wolny krzem otrzymuje się redukując SiO2 za pomocą metalicznego magnezu lub glinu:
SiO2 + 2Mg → Si + 2MgO + 88,3 kcal
SiO2 + CaC2 → Si↓ + 2CO + Ca
-po zapoczątkowaniu reakcji przez ogrzanie mieszaniny, reakcja przebiega dalej samoczynnie
-dla uniknięcia zbyt gwałtownego jej przebiegu wprowadza się HgO
-uzyskany krzem stanowi brunatny proszek (można go przekrystalizować rozpuszczając w stopionym, metalicznym glinie, i oziębiając otrzymany stop).
44. Własności półprzewodnikowe Si Ge Sn (odmiany alotropowej o nazwie cyna szara).
-krzem podobnie jak german wykazuje własności półprzewodnikowe
-jego przewodnictwo elektryczne wzrastające z temperaturą, może być znacznie podwyższone przez wprowadzenie odpowiednich domieszek
-własności półprzewodnikowe krzemu wykorzystuje się przy budowie różnego rodzaju elementów półprzewodniczących np. baterie słoneczne
Węgiel, krzem, german i cyna mają po jednej odmianie alotropowej krystalizującej w układzie regularnym i tworzącej sieć przestrzenną diamentu (w przypadku cyny odmianą taką jest tzw. cyna szara).
Diament jest typowym diaelektrykiem. Krzem, german i cyna szara są półprzewodnikami. Mają jakościowo taką samą strukturę elektronową a różnice ich własności wynikają tylko z różnej szerokości pasma wzbronionego.
45. Reaktywność krzemu, reakcje (w podwyższonej temperaturze) z: Cl2, O2, S, N2 i C.
46. Reakcje krzemu z zasadami oraz mieszaniną kwasów fluorowodorowego i azotowego ( z wytworzeniem H2SiF6, NO i H2O).
Czysty krzem podobnie jak krzemionka rozpuszcza się łatwo w zasadach:
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Si + 2OH- + H2O → SiO32- + 2H2
Reakcja z mieszaniną kwasu fluorowodorowego i azotowego
3Si + 18HF + 4HNO3 → 3H2SiF6 + 4NO + 8H2O
Si- - 4e- → Si4+ |∙3
N5+ + 3e- → N2+ |∙4
12 e-
47. Halogenki krzemu (SiX4), ich hydroliza.
Krzem tworzy z wszystkimi fluorowcami najczęściej połączenia typu SiX4 oraz Si2X6.
Fluorowcopochodne krzemu ulegają pod wpływem wody natychmiast hydrolizie:
SiX4 ![]()
SiO2 ∙ nH2O + 4HX
Odmiennie zachowuje się SiF4, który pod wpływem wody przechodzi w mocny kwas fluorokrzemowy
3SiF4 + 3H2O → H2SiO3 + 2H2(SiF6) /wg. Pajdowskiego/
SiF4 (czterofluorek krzemu) - bezbarwny gaz, w warunkach normalnych odznacza się nieprzyjemnym, drażniącym zapachem.
SiCl4 - bezbarwna ciecz, silnie dymiąca w powietrzu i reagująca gwałtownie z wodą, ogrzewany z krzemem do temperatury ok. 1400oC ulega redukcji do dwuchlorku krzemu: SiCl4 + Si ↔2SiCl2
SiBr4 - w normalnych warunkach jest cieczą
SiJ4 - w normalnych warunkach jest ciałem stałym
48. Otrzymywanie SiF4 z krzemu oraz z krzemionki (trawienie szkła).
SiO2 + 4HF = SiF4 + 2H2O
SiF4 - gaz w normalnych warunkach
Reakcja ta jest wykorzystywana do trawienia szkła. Ciekły HF rozpuszcza szkło pozostawiając gładkie ubytki, natomiast gazowy HF powoduje zmatowienie trawionych powierzchni.
SiF4 pod wpływem H2O przechodzi w stosunkowo mocny kwas fluorokrzemowy:
3SiF4 + 3H2O = H2SiO3 + 2H2(SiF6)
(Pajdowski str. 314)
49. Otrzymywanie na drodze syntezy oraz własności SiS2 i Si3N4
Siarczek krzemu SiS2 można otrzymać przez syntezę z pierwiastków w wysokiej temperaturze:
Si + 2S → SiS2
Jest to związek nietrwały hydrolizujący z wodą na siarkowodór i kwasy krzemowe. Ma budowę łańcuchową złożoną z tetraedrów SiF4 połączonych w przeciwieństwie do krzemianów krawędziami.
SiS2 + 3H2O → H2SiO3 + 2H2S
S S S
Si Si
S S S
Azotek krzemu Si3N4 powstaje przy syntezie z pierwiastków powyżej temperatury 1500oC. Jest to proszek biały, hydrolizujący z wodą na amoniak i kwasy krzemowe.
Si3N4 + 9H2O → 3H2SiO3 + 4NH3
(Trzebiatowski str. 324)
50. Polimorfizm i występowanie SiO2 (Kwarc, Trydymit, Krystobalit). Kwarc (kryształ górski) oraz SiO2 ∙ nH2O (Ametyst, Agat, Jaspis).
Polimorfizm - czyli wielopostaciowość - zjawisko występowania związku chemicznego, zależnie od warunków fizykochemicznych, w kilku postaciach krystalograficznych.
Odmiany krystaliczne SiO2 :
-Kwarc
-Trydymit
-Krystobalit
Każdy z nich występuje w dwóch odmianach - alfa i beta. Alfa tworzy się w temperaturze niższej, natomiast beta w temperaturze wyższej.
Występowanie SiO2 :
Najpospolitszym związkiem krzemu jest SiO2 , czyli kwarc lub krzemionka występująca w litosferze.
Krzemionka:
-w przyrodzie występuje w stanie wolnym (piasek, piasek morski - niemal czysta krzemionka),
-składnik krzemianów, soli kwasów krzemowych
-składnik organizmów roślinnych (usztywnia ściany komórek) i zwierzęcych (szkielet organizmów morskich)
Kryształ górski (kwarc):
-chemicznie czysta krzemionka występująca w przyrodzie
-bezbarwny, pewne domieszki nadają mu zabarwienie i występuje on wówczas jako:
*kwarc przydymiony - zawierający koloidalne rozpuszczone metale
*ametyst - zabarwiony fioletowo
*agat, jaspis, chalcedon - stanowiące produkty powolnego odwadniania żelu SiO2
51. Szkło kwarcowe i inne rodzaje szkła (butelkowe, laboratoryjne).
Szkło kwarcowe
-przy szybkim chłodzeniu stopiony kwarc krzepnie bezpostaciowo jako szkło kwarcowe
-znaczenie praktyczne dla celów optycznych i chemicznych
-bardziej odporne na działanie czynników chemicznych, wytrzymuje nagłe zmiany temperatury
-duża przepuszczalność promieni pozafioletowych (lampy kwarcowe, soczewki, pryzmaty do celów spektroskopii.
Szkło kwarcowe produkuje się przez wytop najczystszego piasku kwarcowego jako szkło przezroczyste lub mleczno mętne. Zmętnienie szkła kwarcowego pochodzi od mikroskopijnych banieczek powietrza zawartych w jego masie. Banieczki te można usunąć przez ogrzewanie stopionego szkła kwarcowego do dostatecznie wysokich temperatur. Struktura szkła kwarcowego i jego własności fizyczne różnią się zasadniczo od substancji krystalicznych.
Szkło butelkowe
-najpospolitsze i najtańsze szkło
-jest to szkło sodowe o przeciętnym składzie: Na2O ∙ CaO ∙ 6SiO2
-odcień brązowy lub zielonkawy
-mało odporne na działanie czynników chemicznych
Szkło laboratoryjne
-szkło zawierające potas (szkło turyngskie): 1,68 K2O, 1,25 Na2O, 0,67 CaO, 0,3 Al2O3, 6SiO2
-cenniejsze gatunki szkła laboratoryjnego zawierają trójtlenek boru, tlenek glinowy
52. Reakcje Si oraz SiO2 z zasadami
Krzem ma zdolność do ulegania działaniu nawet silnie rozcieńczonych wodorotlenków.
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Si + 2OH- + H2O → SiO32- + 2H2
Krzemionka SiO2 nierozpuszczalna w wodzie jest tlenkiem kwarcowym i z zasadami tworzy w wodzie krzemiany (tzw. szkło wodne).
SiO2 + 2NaOH → Na2SiO3 + H2O
SiO2 + 4NaOH → Na4SiO4 + 2H2O
53. Szkło wodne, kwasy meta- i ortokrzemowe oraz polikrzemowe. Struktura tetraedryczna (-SiO3-)n
Szkło wodne - stapiając 3-4 mole SiO2 z 1 molem Na2CO3 uzyskuje się produkt - szkło sodowe, który w czasie dłuższego ogrzewania w temperaturze ok. 800oC ulega odszkleniu. Szkło sodowe ogrzewane z wodą pod zwiększonym ciśnieniem daje syropowaty roztwór zwany w handlu szkłem wodnym. Znajduje on zastosowanie jako: klej mineralny, wypełniacz przy wyrobie mydła, środek do impregnowania drewna.
Kwas ortokrzemowy - uwodnienie SiO2 (z NaOH jak wyżej) powoduje powstanie dobrze rozpuszczalnych krzemianów sodowych (jak ortokrzemianu sodowego Na4SiO4) które pod działaniem H2O przekształcają się kwas ortokrzemowy H4SiO4.
Na4SiO4 + 4H2O ↔ H4SiO4 + 4NaOH
Kwas ortokrzemowy wykazuje tendencję do odszczepiania wody i kondensowania się z wytworzeniem kwasów wielokrzemowych. Szybkość kondensacji zależy od pH. pH w roztworze krzemianu sodowego ma dużą wartość (hydroliza soli silnej zasady i słabego kwasu) to pomimo obecności H4SiO4 kondensacja nie następuje i nie ma osadu. Wydzielanie galaretowatego osadu następuje przez dodanie chlorku amonowego NH4Cl
NH4+ + OH- ↔ NH3 + H2O
Galaretowaty żel powstały w procesie kondensacji to mieszanina kwasów krzemowych będących produktami kondensacji. Kwasy takie to kwasy polikrzemowe . Nie udaje się poza wyjątkami wydzielenie czystych kwasów krzemowych. Do wyjątków tych należy m.in.: kwas metakrzemowy H2SiO3.
Struktura tetraedryczna (-SiO3-)n
W anionach krzemianowych krzem ma liczbę koordynacji 4. Elementem budowy wszystkich krzemianów jest tetraedr SiO4. Ponieważ tetraedry łączą się ze sobą mostkami tlenowymi, łańcuch zbudowany z tetraedrów SiO4 można przedstawić ogólnym wzorem (-SiO3)n.
W strukturach warstwowych jest przestrzenne ułożenie ......... tetraedrów.
54. Wytrącanie żelu krzemionkowego
Krzemiany otrzymuje się również przez spalanie krzemionki
SiO2 ![]()
CO2 + Na2SiO3
Obok Na2SiO3 powstają również pewne ilości ortokrzemianu. Z wodnych roztworów orto- i metakrzemianów (Na2SiO3 i Na4SiO4) pod wpływem kwasów wytrąca się żel krzemionkowy (SiO2 ∙ nH2O) złożony głównie z kwasu metakrzemowego i ortokrzemowego oraz kwasów wielokrzemowych.
Żel wiąże w swych kanalikach zmienne ilości wody do 300 cząsteczek wody na jedną cząsteczkę SiO2 .
Odwodniony żel ma zdolność adsorbowania lotnych związków chemicznych i jest używany jako środek suszący.
np.:
Wolastonit CaSiO3
Oliwiny (Fe, Mg)2SiO4
Brazylit Pb3Si2O7, itd
Wyszukiwarka
Podobne podstrony:
Węglowce (2), 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
Litowce, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
tlenowce ci ga, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
wodór, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
tlenowce, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
Alkacymetria1, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia analityczna, 1.Alkacymetria
Alkacy redoksy, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia analityczna, 1.Alkacymetria
Chemia analityczna - ściąga, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia analityczna, instrukc
Kationy, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia analityczna, 3.Kationy i aniony
Redoksymetria(1), 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia analityczna, 7.Redoksymetria
SCN, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia analityczna, 3.Kationy i aniony
soczewki biofizyka optyka, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Biofizyka, Tematy
Mutacje1(1), 08. MEDYCYNA, 1.Analityka medyczna, I rok, Genetyka, mutacje
Mutacje pyania, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Genetyka, mutacje
Podstawy żywienia, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Fizjologia, Układ pokarmowy, podstawy
mutacje i naprawa DNA rozpiska, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Genetyka, mutacje
Krwionośny, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Fizjologia, Układ krwionośny
aaa. opracowania 24-48, Analityka Medyczna 2014-19 Uniwersytet Medyczny Wrocław, Chemia ogólna i nie
więcej podobnych podstron