Ilościowe oznaczanie zawartości białka w roztworze metodą Bradforda i pomiaru absorbancji w nadfiolecie.
Celem ćwiczenia jest zapoznanie się z metodami kalorymetrycznym pozwalającymi na ilościowe oznaczenie zawartości białka w roztworze, takimi jak:
metoda microbiuretowa
metoda Lowry'ego
metoda Bradforda,
a także przez pomiar absorbancji w nadfiolecie.
Podczas ćwiczenia zostanie oznaczone stężenie mysiego translacyjnego czynnika inicjacyjnego - 4E (eIF4E) w roztworze dwoma metodami: metodą Bradforda oraz metodą pomiaru absorbancji w nadfiolecie.
Metoda Bradforda wykorzystuje zdolność wiązania barwnika błękitu brylantowego Coomassie G-250 (ang.Coomasie Brillant Blue) z białkiem. W środowisku kwaśnym widmo absorpcji barwnika charakteryzuje się maksimum przy 465 nm, natomiast po związaniu białka maksimum przesuwa się w stronę fal dłuższych i występuje w przy 595 nm. Mając wyznaczoną krzywą kalibracyjną dla wzorcowego białka (np. BSA, IgG) można określać zawartość białka w badanej próbce poprzez pomiar zmiany absorbancji w 595 nm roztworu barwnika po dodaniu do niego badanej próbki.
Rys. Widmo absorpcji odczynnika Bradforda przed (----) i po dodaniu BSA (12 μg/ml)(----).
Większość białek dzięki obecności aminokwasów aromatycznych tryptofanu i tyrozyny, wykazuje maksimum absorbancji przy około 280 nm co pozwala na oznaczenie zawartości białka w roztworze przez bezpośredni pomiar absorbancji w nadfiolecie.
Przed przystąpieniem do ćwiczenia należy zapoznać się:
z zasadami ilościowego oznaczania białka metodą: microbiretową, Lowry'ego, Bradforda i pomiaru absorbancji w nadfiolecie na podstawie dostępnej literatury np.: i inni: „Ćwiczenia z Biochemii” red. L. Kłyszejko-Stefanowicz ,J. Walory, M. Pilarek, M. Kalinowska, H. Jaworska-Deptuch „Biochemia, ćwiczenia laboratoryjne”
własnościami spektralnymi aminokwasów aromatycznych
Przed ćwiczeniem odbędzie się kolokwium wstępne obejmujące następujące zagadnienia:
Stężenia roztworów: procentowe, molowe
Siła jonowa buforów, pH
Prawo Lamberta-Beera, molowy współczynnik ekstynkcji (ε)
Podstawowe informacje na temat budowy i właściwości aminokwasów i białek
Wyznaczanie parametrów kinetycznych w reakcji utleniania alkoholi katalizowanej przez dehydrogenazę alkoholową.
Celem ćwiczenia jest wyznaczenie parametrów kinetycznych jakimi są Km i Vmax dla reakcji utleniania alkoholi etylowego, benzylowego, 1-propanolu lub 1-butanolu przez dehydrogenazę alkoholową (EC 1.1.1.1) wyizolowaną z drożdży. Enzym ten, należący do grupy oksydoreduktaz, katalizuję reakcje utleniania alkoholi pierwszorzędowych do odpowiednich aldehydów, bądź reakcje odwrotną: redukcji aldehydu do alkoholu. Proces ten przebiega stereospecyficznie. W obydwu tych procesach wymagany jest odpowiedni kofaktor (NAD+, NADH).
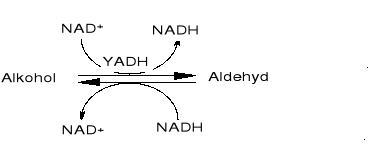
Wykonanie ćwiczenia
Grupa wykonująca ćwiczenie będzie badać szybkość reakcji enzymatycznej w stałych warunkach dla różnych stężeń substratu (z zakresu gdzie szybkość reakcji zależy od stężenia). Grupa powinna przeprowadzić pomiary kinetyczne dla etanolu i innego wybranego alkoholu pierwszorzędowego (pięć różnych stężeń dla każdego alkoholu). Wyznaczone szybkości należy zastosować do wyznaczenia Km i Vmax metodą Lineweavera-Burka, a otrzymane wyniki przedyskutować.
Przebieg reakcji będzie monitorowany spektrofotometrycznie przez zmiany absorbancji pochodzącej od odpowiedniej formy kofaktora.
Przed przystąpieniem do ćwiczenia należy przyswoić sobie następujące pojęcia:
Ogólne wiadomości na temat budowy i funkcji enzymów
Model Michaelisa-Mentena
Metody wyznaczania stałej Michaelisa (Km) i szybkości maksymalnej (Vmax) ze szczególnym uwzględnieniem metody Lineweavera-Burka.
Sens fizyczny Km i Vmax.
Typy inhibicji enzymatycznej i ich wyznaczania metodą Lineweavera-Burka.
Budowa dehydrogenazy alkoholowej .
Rola kofaktorów.
Struktura oraz właściwości spektralne w UV-Vis: NAD+, NADH.
Polecana literatura.
Biochemia - L. Streyer
Ćwiczenia z biochemi - L. Kłyszejko-Stefanowicz.
Mile widziane sięgnięcie do literatury oryginalnej dotyczącej badań nad kinetyką enzymatyczną (bez trudu mogą być wyszukane w różnych bazach danych dostępnych w Internecie a następnie w bibliotekach.
Ćwiczenie stanowi kontynuację ćwiczenia z Chemii Fizycznej.
Analiza elektroforetyczna białek w żelu poliakrylamidowym w warunkach denaturujących.
Istotę zjawiska elektroforezy stanowi wędrówka w polu elektrycznym cząsteczek mających dodatni lub ujemny ładunek elektryczny i proces rozdzielania tych cząsteczek na skutek różnicy szybkości ich wędrowania w roztworze (elektroforeza swobodna) bądź w nośnikach (np.: elektroforeza bibułowa, elektroforeza żelowa). W biochemii najczęściej stosowanym rodzajem elektroforezy jest jej wariant żelowy. W przypadku rozdziału i oczyszczania białek stosowane są żele poliakrylamidowe.
Celem powyższego ćwiczenia jest zapoznanie się z elektroforezą białek w żelu poliakrylamidowym w obecności SDS, która jest stosowana do oznaczania ich mas cząsteczkowych. Ćwiczenie obejmuje przygotowanie żelu piliakrylamidowego, próbek białkowych, rozdział elektroforetyczny oraz barwienie elektroferogramu.
Rys. Przykład rozdziału białek i analizy ich mas cząsteczkowych w 15 % żelu poliakrylamidowym wybarwionych metodą Coomassie Brilliant Blue.
Przed przystąpieniem do ćwiczenia należy zapoznać się z:
Istotą zjawiska elektroforezy
Elektroforezą bibułową
Elektroforezą żelową w szczególności elektroforezą białek w żelach poliakrylamidowych w tym :
polimeryzacją żelu poliakrylamidowego
metodą oznaczania mas cząsteczkowych białek
technikami wybarwiania żeli
Literatura:
„Ćwiczenia z Biochemii” red. L. Kłyszejko-Stefanowicz, PWN, Warszawa 1999 i następne
L. Stryer „Biochemia”, PWN, Warszawa 1997 i następne
J. Walory, M. Pilarek, M. Kalinowska, H. Jaworska-Deptuch „Biochemia, ćwiczenia laboratoryjne” WPW, Warszawa 2003
„Biofizyka dla biologów” red. M. Bryszewska i W. Leyko, PWN, Warszawa 1997
Frakcjonowanie wątroby szczura wg Schneidera i ilościowe oznaczenie w niej kwasów nukleinowych
Celem ćwiczenia będzie spreparowanie wątroby szczura laboratoryjnego w celu otrzymania frakcji kwasów nukleinowych, a następnie oszacowanie metodami kolorymetrycznymi ilości mg DNA i RNA w przeliczeniu na 100 mg wątroby.
Ćwiczenie zapoznaje studenta z podstawowymi metodami stosowanymi w preparatyce biochemicznej ( homogenizacja, wirowanie i pozyskiwanie supernatantu, ekstrakcja...), oraz sposobem wyznaczania stężenia przy pomocy krzywej kalibracyjnej ( kolorymetria ).
Metoda stosowana w ćwiczeniu będzie szybka i prosta, lecz posiadająca wadę - nierozdzielone składniki DNA i RNA, co ogranicza ilość stosowanych metod analitycznych.
Przed przystąpieniem do wykonywania ćwiczenia należy zapoznać się z opisem i zrozumieć celowość poszczególnych etapów frakcjonowania tkanki, oraz poznać ogólne wiadomości o budowie kwasów nukleinowych.
Opis ( wykonywany indywidualnie ) powinien zawierać oprócz krótkiej części opisowej , wyniki pomiarów absorbcji, wykres krzywej kalibracyjnej zależności absorbcji od mg DNA/RNA w próbce, oraz wyliczenie mg RNA/DNA w przeliczeniu na 100 mg wątroby,
Zagadnienia do kolokwium zaliczeniowego:
ogólne wiadomości o budowie kwasów nukleinowych
wiązanie glikozydowe
podstawowe metody wyodrębniania kwasów nukleinowych z tkanek - zasadnicze różnice
etapy frakcjonowania tkanki met. Schneidera ( jakie procesy tam zachodzą
podstawy kolorymetrii
Wyszukiwarka
Podobne podstrony:
biochemia 2009, Analityka semestr IV, Biochemia, Biochemia
42 opis, Analityka semestr IV, Biochemia, Biochemia
biochemia (1) egzam giełda, Analityka semestr IV, Biochemia, Biochemia
Wersja A-TEST, Analityka semestr IV, Biochemia, tłuszcze kwasy nukleinowe
biochemia kolo III, Analityka semestr IV, Biochemia, tłuszcze kwasy nukleinowe
ZAGADNIENIA EGZAMINACYJNE 2010 biochemia, Analityka semestr IV, Biochemia
biochemia egzamin wersja B, Analityka semestr IV, Biochemia, giłdy edz bioch
kolokwium III, Analityka semestr IV, Biochemia, Biochemia
poprawa enzymy pytania, Analityka semestr IV, Biochemia, Biochemia
koo cukry biochemia[1], Analityka semestr IV, Biochemia, Biochemia
DENATURACJA, Analityka semestr IV, Biochemia, Biochemia
cukry, Analityka semestr IV, Biochemia, Biochemia
pytanka opracowanie zagadnień, Analityka semestr IV, Biochemia, Biochemia
Kwas fusydowy, Analityka semestr IV, Biochemia, Biochemia
biochemia, Analityka semestr IV, Biochemia, Biochemia
biochemia 2009, Analityka semestr IV, Biochemia, Biochemia
zadania chrom, Analityka semestr IV, Analiza Instumentalna
więcej podobnych podstron