Nr ćwiczenia: 6 |
Data: 24.03.2011r. |
Grupa: 1 |
Wydział: Technologia Chemiczna Kierunek: Technologia Chemiczna |
Semestr: II |
Prowadzący: dr inż. Bogdan Wyrwas |
Przygotowanie:
|
Wykonanie:
|
Ocena: |
|
Wstęp teoretyczny
Chromatografia jonowymienna to rodzaj cieczowej chromatografii kolumnowej. Jest to metoda preparatywna używana do wydzielenia z mieszaniny żądanej substancji. W tej metodzie chromatografii faza stacjonarna, złoże, jest obdarzona ładunkiem. Stanowi je zazwyczaj żywica jonowymienna, zawierająca obdarzone ładunkiem grupy funkcyjne, oddziałujące z przeciwnie naładowanymi grupami związków, które mają zostać zatrzymane przez nośnik. Związki związane z jonowymieniaczem mogą być wymyte z kolumny przez stopniową elucję, a także poprzez zmianę stężenia soli lub pH.
Zasadnicze typy jonitów to:
Jonity kationowe - mają charakter kwasów lub soli kwasów i wymieniają z roztworem kationy (najczęściej jon wodorowy
lub kationy metali alkalicznych,
i
),Jonity anionowe - mają charakter zasad lub ich soli i wymieniają z roztworem aniony (np. jon wodorotlenowy
, anion
lub
),Jonity amfoteryczne (buforowe) zawierają zarówno grupy kwasowe i zasadowe (lub ich sole), mogą być również używane mieszaniny różnych jonitów.
Proces wymiany jonowej znajduje głównie zastosowanie do:
zmiękczania,
demineralizacji i odsalania,
usuwania fosforanów i azotanów,
usuwania azotu amonowego, metali i radionuklidów,
usuwania niektórych zanieczyszczeń organicznych.
Najważniejsze zalety chromatografii jonowej to
możliwość jednoczesnego oznaczania kilku jonów w czasie kilkunastu minut;
granice wykrywalności i oznaczalności na poziomie μg/ L;
niewielka ilość próbki potrzebna do analizy;
możliwość stosowania różnych detektorów; prosty sposób przygotowania próbek;
możliwość jednoczesnego oznaczania kationów i anionów, lub jonów organicznych i nieorganicznych
możliwość oznaczania jonów tego samego pierwiastka na różnych stopniach utlenienia
Technika stosowania jonitów
Rodzaj jonitu musi odpowiadać zadaniu jakie stawia mu analityk. W większości typowych rozdzieleń stosuje się jednofunkcyjne jonity silnie kwasowe lub silnie zasadowe. Należy stosować jonity o określonej wielkości ziaren, wpływa ona bowiem na przebieg rozdzielania. Wielkość ziarna zależy od wymiarów kolumny oraz rodzaju procesu. Jonit w kolumnie musi być ułożony równomiernie i powinien być zawsze przykryty roztworem, a złoże nie może zawierać pęcherzyków powietrza. Wysokość złoża żywicy jonowymiennej w kolumnie powinna być 10- 20 razy większa od średnicy kolumny.
Jonity służą głównie do zmiękczania wody, mają także zastosowanie w analizie chemicznej do usuwania przeszkadzających jonów z roztworu, oznaczania stężenia niektórych soli w roztworze, zagęszczania śladów oraz w chromatografii jonowymiennej. Do bardziej popularnych jonitów należą: Dowex, Wofatyt, Amberlit, Duolite, Gamranityt, Lewatyt, Varion.
Twardość wody - cecha wody, będąca funkcją stężenia soli wapnia, magnezu i innych metali, które są zdolne do tworzenia soli na wyższym niż pierwszy stopniu utlenienia.
Twardość wody dzieli się na:
nietrwałą (przemijającą, węglanową) - która jest generowana przez sole kwaśne kwasu węglowego - wodorowęglany
Ogólna twardość wody jest sumą twardości węglanowej i trwałej.
Nazwa "twardość nietrwała" wynika z faktu, że wodorowęglany są nietrwałe termicznie i podczas ogrzewania przekształcają się do nierozpuszczalnych w wodzie węglanów, które wytrącają się z roztworu (jest to proces odwrotny do rozpuszczania w wodzie skał węglanowych w obecności CO2), np.:
Ca2+ + 2HCO−3 ⇌ CaCO3 + H2O + CO2↑
Natomiast chlorki, siarczany i azotany są trwałe i pozostają również po przegotowaniu wody.
Twardość wody ma wpływ na jej napięcie powierzchniowe. Czym większe napięcie powierzchniowe wody, tym trudniej zwilża ona wszelkie powierzchnie, na skutek czego trudniej jest za jej pomocą czyścić zabrudzone powierzchnie. Twarda woda wymaga stosowania większych ilości mydła, gdyż powoduje wytrącenie trudno rozpuszczalnych soli kwasów tłuszczowych i metali odpowiedzialnych za twardość wody.
Duża, nietrwała twardość wody kotłowej stanowi często poważny techniczny problem, gdyż w trakcie wielu procesów technologicznych związanych z podgrzewaniem wody następuje wtedy osadzanie się tzw. kamienia kotłowego.
Twardość wody wyraża się w trzech różnych skalach:
milivalach na litr (mval/l) - 1 mval = 1 miligramorównoważnik (0,5 milimol) jonów Ca2+ oraz 1 mval = 50 mg CaCO3 w 1 litrze wody.
Typowa twardość wody użytkowej (kranowej) wynosi ok. 10 °n. Woda poniżej 3 °n jest uważana za miękką, zaś woda powyżej 30 °n jest uważana za twardą:
bardzo miękka: <75 mg CaCO3/dm3
miękka: 75-150 mg CaCO3/dm3
średnio twarda: 150-300 mg CaCO3/dm3
twarda: 300-500 mg CaCO3/dm3
bardzo twarda: >500 mg CaCO3/dm3
Twardość wody pitnej wg norm polskich powinna wynosić 60-500 mg CaCO3/dm3
OPRACOWANIE WYNIKÓW:
1. Rozdzielanie proste.
a) Po dodaniu kationitu do roztworu chlorku chromu (CrCl3), barwa kationitu pociemniała z koloru jasnobrązowego na ciemnobrązowy. Po dekantacji i zalaniu żywicy 2M H2SO4, żywica odbarwiła się, czyli przyjęła początkową barwę. Zaszły reakcje:
(K = kationit)
1) 3 HK + Cr3+ CrK3 + 3 H+
2) CrK3 + 3 H+ 3 HK + Cr3+
b) Po dodaniu kationitu do roztworu siarczanu (VI) miedzi (II) (CuSO4), barwa kationitu zrobiła się jaśniejsza, a roztwór przybrał barwę zielonkawą. Po dekantacji i zalaniu żywicy 2M NH3aq, żywica zmieniła barwę na ciemnoniebieską.
1) 2 HK + Cu2+ CuK2 + 2 H+
2) CuK2 + 4 NH3 Cu(NH3)4K2
2. Dejonizacja wody:
Twardość wody w stopniach niemieckich obliczmy ze wzoru
Twardość wody =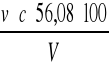
Gdzie: v - objętość EDTA zużyta do miareczkowania [ml]
c - stężenie EDTA [mol/l]
V - objętość próbki miareczkowanej wody [ml]
56,08 - masa molowa CaO [g/mol]
Przyjmujemy ze 1ml wody = 1g
50 ml wody wodociągowej z dodanymi 5 ml roztworu buforowego o pH = 10 oraz ok. 0,1 g wskaźnika czerni eriochromowej.
50 ml wody przegotowanej (przepuszczonej przez ROH) z dodanymi 5 ml roztworu buforowego o pH = 10 oraz ok. 0,1 g wskaźnika czerni eriochromowej.
50 ml wody przepuszczonej przez złoże jonowymienne (RH) z dodanymi 5 ml roztworu buforowego o pH = 10 oraz ok. 0,1 g wskaźnika czerni eriochromowej.
Miareczkowałam te 3 próby roztworem 0,02 M EDTA z biurety.
Obserwacje i wyniki:
Roztwór zmienił barwę z fioletowej na niebieską po dodaniu 13 ml.
Roztwór zmienił barwę z różowej na niebieską po dodaniu 7 ml.
Roztwór od samego początku był niebieski, nie wymagał miareczkowania.
Obliczenia:
0,02 mola EDTA - 1000 ml EDTA
X moli - 13 ml EDTA
X = 0,00026 mola
0,00026 mola - 50 ml wody
X moli - 1000 ml wody
X = 0,0052 mola
56,08 g CaO - 1 mol
X g - 0,0052 mola
X = 0,291616 g
0,291616 * 1000 = 291,616 mg
1 stopień niemiecki - 10 mg CaO
X - 291,616 mg CaO
X = 29,1616 stopnie.
Wg wzoru na twardość wody :
(5 ml * 0,02 M * 56,08 * 100) / 13 ml = 29,1616 stopnie niemieckie.
0,02 mola EDTA - 1000 ml EDTA
X moli - 7 ml EDTA
X = 0,00014 mola
0,00014 mola - 50 ml wody
X moli - 1000 ml wody
X = 0,0028 mola
56,08 g CaO - 1 mol
X g - 0,0028 mola
X = 0,0157024 g
0,157024 * 1000 = 157,024 mg
1 stopień niemiecki - 10 mg CaO
X - 157,024 mg CaO
X = 15,7024 stopnie.
Wg wzoru na twardość wody :
(5 ml * 0,02 M * 56,08 * 100) / 7 ml = 15,7024 stopnie niemieckie.
Twardość wody wynosi 0 stopni niemieckich.
(5 ml * 0,02 M * 56,08 * 100) / 0 ml = 0 stopni niemieckich.
Wnioski:
Wyniki doświadczeń są zgodne z przewidywaniami teoretycznymi. Badana woda cechuje się średnią twardością. Wyciąg z kolumny RH zawierał pewną ilość kationów, bo mogło być spowodowane przekroczeniem momentu przebicia kolumny.
3. Do wody wodociągowej i wody przepuszczonej przez złoże jonowymienne dodanie 2 M HCl i 0,5 M BaCl2
W probówce 1, gdzie była woda wodociągowa, zaobserwowaliśmy zmętnienie świadczące o obecności siarczanów; w probówce 2, gdzie była woda przepuszczona przez RH, zmętnienie było prawie niewidoczne.
Obecność zmętnienia świadczy o obecności siarczanów w roztworach.
Ba2+ + SO4-2 BaSO4 ↓
Do wody wodociągowej i wody przepuszczonej przez złoże jonowymienne dodanie 0,1 M AgNO3.
Po dodaniu do wody z kolumny RH roztworu AgNO3 roztwór lekko zmętniał, natomiast tam gdzie była sama woda wodociągowa roztwór zmętniał bardzo mocno, prawie zrobił się biały.
Obecność zmętnienia w każdej probówce świadczy o obecności chlorków w roztworach.
Ag+ + Cl- AgCl ↓
Wyszukiwarka
Podobne podstrony:
Ćw. 5 Rozdział metodą chromatografii bibułowej - sprawozdanie, Chemia ogólna i nieorganiczna
Ćw.4 - roztwory buforowe - sprawozdanie, Chemia ogólna i nieorganiczna
ćw 1 - skala PH SPRAWOZDANIE, Chemia ogólna i nieorganiczna
ćw. 2 - reakcje w układzie kwas - zasada SPRAWOZDANIE, Chemia ogólna i nieorganiczna
Ćw.3 - odczyn wodnych roztworów soli - sprawozdanie, Chemia ogólna i nieorganiczna
Sprawozdanie 8 (tabela), studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, sprawozdania
Ćw. 13 - rozdział przez ekstrakcję - sprawko, Chemia ogólna i nieorganiczna
Sprawozdanie 7, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, sprawozdania
Ćw. 10 i 11 - reakcje utleniania i redukcji - sprawko, Chemia ogólna i nieorganiczna
Ćw. 12 - rozdział przez strącania - sprawko, Chemia ogólna i nieorganiczna
chromatografia jonowymienna 2, Rok I, chemia fizyczna, chemia fizyczna-protokoły
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
rownowagi1, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
Nazewnictwo IUPAC, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Klasyfikacja i na
Zakres materiału obowiązujący na II kolokwium wykładowe, Chemia ogólna i nieorganiczna, giełdy
Teoria do I i II gr. anionów, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z kati
28, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Egzamin chemia
Chemia ogolna i nieorg 13 2010
więcej podobnych podstron