13.10.2010 |
|
|
Ćwiczenia 8 |
Napięcie powierzchniowe (Metoda stalagmometryczna) |
|
Celem tego ćwiczenia jest zbadanie wpływu alkoholi o różnych długościach łańcucha węglowego i różnych stężeniach na napięcie powierzchniowe wody.
Wykonanie ćwiczenia:
Umyty starannie stalagmometr umieściliśmy w statywie w pozycji pionowej.
Do stalagmometru zassaliśmy wodę destylowana tak, aby jej poziom sięgał powyżej górnej kreski. Następnie pozwoliliśmy wodzie swobodnie wyciekać ze stalagmometru. Od momentu, w którym menisk wody miną górna kreskę, liczyliśmy krople do chwili, gdy menisk wody miną dolną kreskę. Pomiar powtórzyliśmy 3 krotnie.
W analogiczny sposób przeprowadziliśmy pomiar ilości kropel wypływających ze stalagmometru dla czterech 1 M alkoholi.
Z 1 M alkoholu butylowego przygotowaliśmy roztwory o stężeniach: 0,5; 0,25; 0,125 M. Następnie przeprowadziliśmy pomiar ilości kropel wypływających ze stalagmometru dla każdego stężenia.
II Wyniki:
|
Stężenie [mol/dm3] |
Liczba kropel |
Gęstość w 22oC, [g/cm3]* |
Napięcie Powierzchniowe [dyna/cm] |
Nadmiar powierzchniowy Г [mol/cm2] |
||
|
|
1 próba |
2 próba |
3 próba |
|
|
|
Woda |
|
18 |
18 |
17 |
0,9977 |
72,75 |
|
Metanol |
1 |
18 |
18 |
18 |
0,9893 |
70,87 |
|
Etanol |
1 |
21 |
21 |
21 |
0,9855 |
60,51 |
|
Propanol |
1 |
25 |
25 |
25 |
0,9832 |
50,71 |
|
Butanol |
1 |
46 |
46 |
46 |
0,9816 |
27,52 |
0,0186 |
|
0,5 |
32 |
32 |
33 |
0,9885 |
39,42 |
0,0137 |
|
0,25 |
28 |
27 |
27 |
0,9891 |
46,66 |
0,0107 |
|
0,125 |
22 |
22 |
22 |
0,9995 |
58,58 |
0,0058 |
Tabela 1.
*- obliczone na podstawie wzoru:
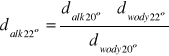
[g/cm3]
gdzie: ![]()
,![]()
- gęstości wody w odpowiednich temperaturach w skali Celsjusza(wynoszą one odpowiednio: 0,9982 g/cm3 i 0,9977 g/cm3)
![]()
,![]()
- gęstości odpowiednich wodnych roztworów alkoholi w określonych temperaturach w skali Celsjusza.
Gęstość wodnych roztworów alkoholi w 20 oC, [g/cm3] |
|
metanol 1M |
0,9898 |
Etanol 1M |
0,9860 |
Propanol 1M |
0,9837 |
Butanol 1M 0,5M 0,25M 0,125M |
0,9821 0,9890 0,9896 1,0000 |
Tabela 2.
Nie mogliśmy znaleść gęstości wodnych roztworów alkoholi, dlatego tak obliczaliśmy gęstości dla 22oC (taka temperatura panowała w laboratorium.
Wyniki zostały opracowane na podstawie wzorów:
1. Napięcia powierzchniowego cieczy:
σ = 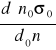
,
gdzie:
σ, σ0 - napięcie powierzchniowe cieczy badanej i wzorcowej,
n, n0 - liczba kropel cieczy badanej i wzorcowej,
d, d0 - gęstość cieczy badanej i wzorcowej.
2. Nadmiar powierzchniowy Gibasa:
Γ = - ![]()
(![]()
)
gdzie:
c - stężenie cieczy badanej
R - stała gazowa ![]()
T - temperatura pomiaru w skali Kelvina (dla naszego doświadczenia równa 293,15 K)
Wzór ten został opracowany na podstawie metody graficznego różniczkowania
![]()
![]()
![]()
czyli Γ = ![]()
![]()
(wywnioskowane na podstawie rysunku)
stąd:
Γ = ![]()
Cześć graficzna:
Z wykresu zależności napięcia powierzchniowego od liczby atomów węgla w cząsteczce alkoholu widać że w raz ze wzrostem liczby atomów węgla maleje napięcie powierzchniowe, co nie zgadza się z regułą Traube'go.
IV. Oszacowanie błędów
Błędy zostały oszacowane na podstawie metody różniczki zupełnej.
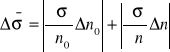
Po przekształceniach:
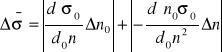
![]()
kropla
Wyniki szacunku błędów:
|
|
Błąd bezwzględny |
Błąd względny [%] |
|
Metanol |
1 |
7,94 |
11,22 |
|
Etanol |
1 |
6,30 |
10,42 |
|
Propanol |
1 |
4,89 |
9,66 |
|
Butanol |
1 |
2,15 |
7,83 |
|
|
0,5 |
3,45 |
8,75 |
|
|
0,25 |
4,34 |
9,32 |
|
|
0,125 |
5,97 |
10,21 |
|
Tabela 3.
V. Wnioski:
Wraz ze wzrostem łańcucha węglowego substancji rozpuszczonej napięcie powierzchniowe roztworu maleje. Również stwierdziliśmy, że im mniejsze stężenie alkoholu w roztworze, tym większe jest napięcie powierzchniowe.
Wyszukiwarka
Podobne podstrony:
Pomiar napięcia powierzchniowego, Sprawolki
Napięcie powierzchniowe1, Chemia Fizyczna, chemia fizyczna- laborki rozne, NAPIĘCIE POWIERZCHNIOWE
Ćw 13 - Wyznaczanie napięcia powierzchniowego, laboratorium fizyczne, Laboratorium semestr 2 RÓŻNE
napiecie powierzchniowe, Chemia Fizyczna, chemia fizyczna- laborki rozne, NAPIĘCIE POWIERZCHNIOWE
Pomiar napięcia powierzchniowego, Sprawolki
Napiecie powierzchniowe, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fiz
Sprawozdania z fizycznej 1, Napięcie powierzchniowe, Napięcie powierzchniowe
Napiecie powierzchniowe, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fiz
Pomia napięcia powierzchniowego, Mechanika i Budowa Maszyn PWR MiBM, Semestr I, Fizyka, laborki, spr
Chemia fizyczna, napiecie powierzchniowe
SPRAWOZDANIE Z WYZNACZANIA NAPIĘCIA POWIERZCHNIOWEGO 1
Pomiar napięcia powierzchniowego cieczy metodą stalagmomet, Technologia chemiczna, Chemia fizyczna
cw 14 - Wyznaczanie napięcia powierzchniowego cieczy za pomocą wagi torsyjnej, Sprawozdania jakieś,
Pomiar napięcia powierzchniowego metodą odrywania i metodą stalagmometru, Pwr MBM, Fizyka, sprawozda
Ćw 13 - Napięcie powierzchniowe - teoria, laboratorium fizyczne, Laboratorium semestr 2 RÓŻNE
napiecie powierzchniowe VIII, Chemia fizyczna
Wyznaczanie współczynnika napięcia powierzchniowego cieczy za pomocą stalagmometru, Pollub MiBM, fiz
fizyka, Napięcie powierzch.cieczy-rurki włoskowate, Pracownia Fizyczna - Ćwiczenie 22
więcej podobnych podstron