![]()
Inżynieria Środowiska I
|
WYZNACZANIE WSPÓŁCZYNNIKA ELEKTROCHEMICZNEGO I STAŁEJ FARADAYA |
18.05.2010 |
Ćw. nr 13 |
Arkadiusz Gużda |
|
I Opis teoretyczny.
Proces rozpadu drobin związków chemicznych na jony pod wpływem rozpuszczalnika nazywamy dysocjacją. Zjawisko te polega na powstawaniu jonów dodatnich, kationów, i jonów ujemnych, anionów. Dysocjacji elektrolitycznej towarzyszy proces przeciwny, tzn. spotykanie się, będących w ciągłym ruchu jonów o znakach przeciwnych, zwaną rekombinacją. Ilość dysocjowanych drobin zależy od: temperatury, stężenia roztworu, rodzaju rozpuszczalnika.
Stosunek liczby drobin dysocjowanych N do całkowitej liczby drobin No w roztworze nazywamy stopniem dysocjacji.
![]()
Ponieważ jony są cząstkami posiadającymi ładunek, mogą one „przenosić” prąd elektryczny. Umieszczenie w roztworze elektrod z przyłożoną do nich różnicą potencjałów powoduje uporządkowany ruch jonów. Proces taki wraz z towarzyszącymi mu zjawiskami chemicznymi zachodzącymi na elektrodach i w elektrolicie nazywamy elektrolizą.
Przewodnictwo większości elektrolitów rośnie ze wzrostem stężenia roztworu, osiągając maksimum, po czym maleje
Wzrost temperatury powoduje wzrost ruchliwości jonów i stopnia dysocjacji.
Wyróżnia się dwa rodzaje przewodników: metale i elektrolity. Przepływ prądu przez elektrolity podporządkowany jest prawu Ohma.
Prawo Ohma mówi, że napięcie elektryczne U na końcach odcinka przewodnika jest proporcjonalne do natężenia prądu elektrycznego I płynącego przez ten przewodnik: U = RI, gdzie R jest oporem elektrycznym.
I PRAWO ELEKTROLIZY FARADAYA
Ponieważ każdy docierający do elektrody jon niesie zarówno ładunek, jak i masę, a produkty rozkładu elektrolitycznego pojawiają się wyłącznie na powierzchni elektrod nigdy zaś w elektrolicie wiec ilość masy substancji wydzielonej na elektrodzie jest proporcjonalna do przeniesionego przez elektrolit ładunku Q:
m=kQ ;k-współczynnik proporcjonalności, (równoważnik elektrochemiczny) równy masie substancji wydzielonej przez prąd o natężeniu 1Aw czasie 1s (ładunek 1C)
Jeśli przez elektrolit przepływa stały prąd o natężeniu I w czasie t trwania elektrolizy to:
m=kIt
II PRAWO FARADAYA
Masy substancji wydzielonej na elektrodzie z dowolnego roztworu mają się do siebie jak równoważniki chemiczne tych substancji, czyli
![]()
Ponieważ m=kIt, to: ![]()
Jeśli ładunek przeniesiony w trakcie obu elektroliz jest jednakowy to: k=aR
(a - współczynnik proporcjonalności, a=1/F) k=R/F
(F- stała Faradaya)
I prawo można, więc zapisać także jako: ![]()
(gdy It=F, wtedy m=R)
Stała Faradaya jest równa ładunkowi, którego przepływ powoduje wydzielanie na elektrodzie masy równej równoważnikowi chemicznemu danej substancji.
Stała Faradaya wynosi 9,6490*104C/gramorównoważnik i nie zależy od rodzaju wydzielającej się substancji.
III Obliczenia :
Pierwsze prawo elektrolizy mówi, że ilość masy m wydzielonej na elektrodzie jest równa iloczynowi natężenie prądu I w czasie trwania elektrolizy t i równoważnika elektrochemicznego k:
![]()
W celu obliczenia współczynnika k przekształciłam ten wzór do postaci:
![]()
po podstawieniu wartości z wykonanego ćwiczenia otrzymujemy równoważnik elektrochemiczny k :
![]()
![]()
Z równania
![]()
można obliczyć Stałą Faraday'a :
![]()
Gdzie ![]()
Z tablic odczytałam wartość masy atomowej miedzi i otrzymałem następującą wartość współczynnika chemicznego:
R=63,57/2=31,8
Stała Faraday'a według moich pomiarów wynosi:
![]()
Obliczanie niepewności:
Niepewność wzorcowania amperomierza wynosi:
ΔdI=0,01 A
Na podstawie powyższych danych obliczam niepewność całkowitą:
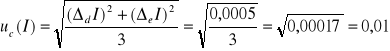
A
Niepewność wzorcowania sekundomierza wynosi:
Δdt=0,1 s ![]()
Na podstawie powyższych danych obliczam niepewność całkowitą:
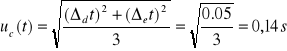
Niepewność wzorcowania wagi wynosi:
Δdm=0,01 g
Niepewność eksperymentatora wynosi:
![]()
Obliczam niepewność całkowitą:
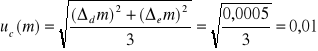
g
Niepewność całkowitą obliczyłam ze wzoru zawartego w skrypcie:
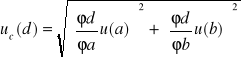
Dla współczynnika elektrochemicznego obliczonego ze wzoru ![]()
niepewność u(k) wynosi:
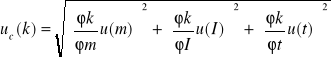
Pochodne cząstkowe wynoszą:
![]()
![]()
![]()
czyli,
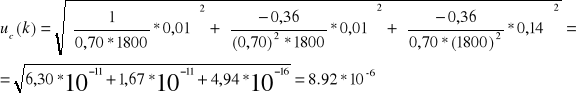
Natomiast u(F) wynosi:
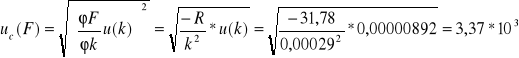
IV Wnioski
Celem doświadczenia było wyznaczenie równoważnika elektrochemicznego i stałej Faradaya. Obliczona na podstawie pomiarów masy, natężenia prądu i czasu stała Faradaya wynosi:
![]()
Według moich obliczeń współczynnik elektrochemiczny wynosi:
![]()
Po uwzględnieniu rachunku błędów obliczone wielkości nie są zyt porównywalne z wielkościami tablicowymi, które wynoszą:
![]()
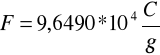
Mogło być to spowodowane błędami w obliczeniach, zmęczeniem umysłu czy też innych czynników, które mogły spowodować takie rozeznania.
6
m1,m2 - wydzielone masy
R1, R2 - równoważniki chemiczne
R=A/W (A-masa atomowa, W-wartościowość)
R-równoważnik chemiczny
A-masa atomowa
W-wartościowość
W=2 A=63,57 ![]()
![]()
stad R=31.78 ![]()
![]()
Niepewność eksperymentatora wynosi:
![]()
Niepewność eksperymentatora wynosi:
![]()