Olak Ewelina
Pluta Anna
Rembowska Aleksandra
Biotechnologia, B-1
Laboratorium z biotechnologii
Ćwiczenie 2
Temat:
Biosynteza α - amylazy bakteryjnej hodowli wstrząsanej.
Data wykonania ćwiczenia: 10.03.2009 r.
Wstęp teoretyczny
Skrobia ma budowę łańcucha α - glikozydowego. W czasie hydrolizy rozpada się na cząsteczki glukozy, które są homopolimerami zwanymi glukozanami lub glukanami.
Dwoma głównymi składnikami skrobi są:
amyloza
amylopektyna
Amyloza nie ma rozgałęzień i jest zbudowana jest z reszt glukozy połączonych wiązaniami α - 1,4 - glikozydowymi.
Amylopektyna jest rozgałęzioną formą skrobi, w której na jedno wiązanie α -1,6-glikozydowe przypada około trzydzieści wiązań α-1,4-glikozydowych. Amylopektyna charakteryzuje się mniejszym stopniem rozgałęzienie niż glikogen.
Zarówno amylopektyna, jak i amyloza są szybko hydrolizowane przez α - amylazę.
Skrobia jest najważniejszym źródłem węglowodanów w pożywieniu i znajduje się kaszach, ziemniakach, roślinach strączkowych i innych warzywach.
Cel ćwiczenia
Celem ćwiczenia jest poznanie zasad prowadzenia hodowli wstrząsanej oraz zbadanie wpływu wybranego parametru (składu pożywki) dla rozwoju drobnoustrojów.
Materiał i metodyka
Materiał biologiczny
Stosujemy szczep Bacillus licheniformis wyhodowany w Instytucie Biochemii Technicznej Politechniki Łódzkiej. Szczep, uprzednio przechowywany na skosach agarowych w temperaturze 4oC, został uaktywniony poprzez przeniesienie na świeże skosy i inkubację w temperaturze 39oC w ciągu 1 godziny.
Uaktywnione szczepy zostały przeniesione do kolb o różnym składzie pożywki (różne stężenie laktozy). Następnie prowadzono hodowlę wstrząsaną przy parametrach:
obroty wstrząsarki - 240 rpm
amplituda - 4,5 cm
temperatura - 39oC
czas procesu - 40 godzin
Metody analityczne
Oznaczenie aktywności α - amylazy w cieczach po hodowli Bacillus licheniformis
Wykonanie
Do oznaczenia aktywności stosujemy metodę Fischera-Steina. Za jednostkę aktywności przyjmuje się taką ilość enzymu, która w ciągu 3 minut w temperaturze 25oC hydrolizuje 1% roztwór skrobi, uwalniając taką ilość cukrów redukujących, która odpowiada 1 mg maltozy.
Z kolb po hodowli wstrząsanej o różnym stężeniu laktozy w pożywce pobieramy po 0,5 ml cieczy pohodowlanej i rozcieńczamy odpowiednio wodą destylowaną:
0,5% - 200-krotne rozcieńczenie
1% - 400-krotne rozcieńczenie
2% - 600-krotne rozcieńczenie
3% - 600-krotne rozcieńczenie
Z odpowiednio rozcieńczonych roztworów pobieramy po 0,5 ml. Przenosimy do probówek zawierających po 0,5 ml 1% roztworu skrobi. Następnie inkubujemy przez 3 minuty w temperaturze pokojowej. Po upływie tego czasu dodajemy po 1 ml kwasu 3,5-dinitrosalicylowego.
Równolegle wykonujemy próbę kontrolną o składzie: 0,5 ml wody destylowanej, 0,5 ml 1% roztworu skrobi, 1 ml kwasu 3,5-dinitrosalicylowego.
Następnie mieszaniny wstawiamy do wrzącej łaźni wodnej na 5 minut, po czym schładzamy.
Dodajemy po 8 ml wody destylowanej i dokonujemy pomiaru absorabancji na „SPECOL-u” przy długości fali 540 nm wobec próby kontrolnej.
Wyniki
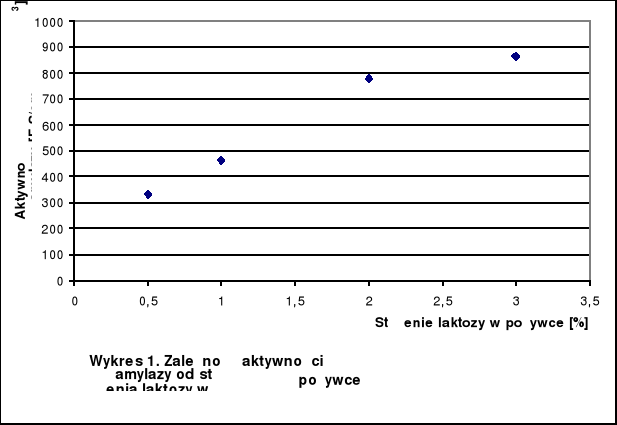
Tabela 1.: Wyniki pomiarów absorbancji i aktywności
Stężenie laktozy [%] |
Absorbancja |
Aktywność α - amylazy [F-S/cm3] |
0,5 |
0,415 |
332 |
1 |
0,290 |
464 |
2 |
0,325 |
780 |
3 |
0,361 |
866 |
Przykładowe obliczenia:
Akt = A540 * R * 4 (z krzywej wzorcowej)
Dla 0,5%:
Akt = 0,415 * 200 * 4 = 332
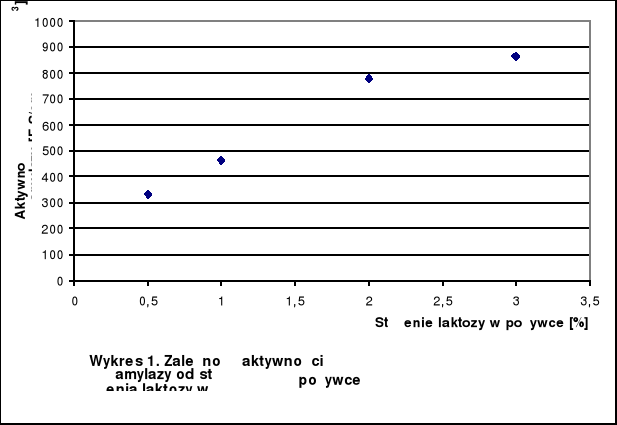
Tabela 2.: Wyniki zbiorcze
|
Aktywność α - amylazy [F-S/cm3] |
|||
Stężenie laktozy[%] |
0,5 |
1 |
2 |
3 |
Grupa 1. |
208 |
360 |
804 |
768 |
Grupa 2. |
260 |
485 |
811 |
993 |
Grupa 3. |
240 |
608 |
1080 |
1032 |
Grupa 4. |
332 |
464 |
780 |
866 |
Grupa 5. |
124 |
222 |
568 |
600 |
Grupa 6. |
216 |
328 |
756 |
804 |
Grupa 7. |
188 |
400 |
936 |
1032 |
Wnioski
W zakresie 0,5% - 2% laktozy rośnie aktywność α - amylazy. Powyżej 2% następuje zahamowanie wzrostu.
Największa aktywność α - amylazy wystąpiła przy 3%, co sugeruje, że optymalne stężenie laktozy znajduje się pomiędzy 2% a 3%.
Oznaczenie wzrostu biomasy
Wykonanie
Oznaczenie wykonujemy metodą pośrednią poprzez pomiar zmętnienia w zawiesinie pohodowlanej, po 20-krotnym rozcieńczeniu wodą destylowaną.
Pomiar wykonujemy na „SPECOL - u” przy długości fali 535 nm, stosując jako próbę kontrolną wodę.
Wyniki
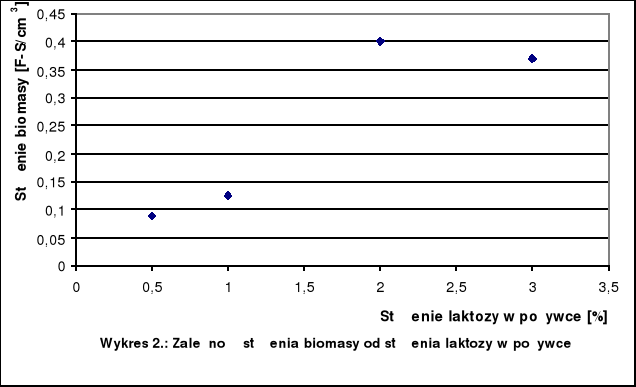
Tabela 3.: Wyniki pomiarów stężenia biomasy
Stężenie laktozy [%] |
Stężenie biomasy |
0,5 |
0,09 |
1 |
0,125 |
2 |
0,400 |
3 |
0,370 |
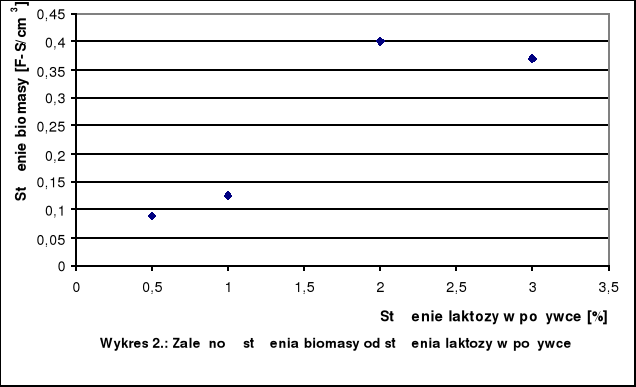
Tabela 4.: Wyniki zbiorcze pomiaru stężenia biomasy
|
Stężenie biomasy |
|||
Stężenie laktozy [%] |
0,5 |
1 |
2 |
3 |
1. |
0,31 |
0,47 |
0,86 |
0,80 |
2. |
0,35 |
0,48 |
0,83 |
0,75 |
3. |
0,3 |
0,37 |
0,820 |
0,80 |
4. |
0,09 |
0,125 |
0,400 |
0,370 |
5. |
0,257 |
0,331 |
0,79 |
0,7 |
6. |
0,23 |
0,31 |
0,85 |
0,72 |
7. |
0,28 |
0,51 |
0,88 |
0,83 |
Wnioski
W zakresie od 0,5% do 2% nastąpił gwałtowny wzrost stężenia biomasy wraz ze wzrostem stężenia laktozy. Powyżej 2% obserwujemy spadek stężenia biomasy.
3
Wyszukiwarka
Podobne podstrony:
Biotechnologia wyklad(1), Studia PŁ, Ochrona Środowiska, biotechnologia
Biotechnologia 2, Studia PŁ, Ochrona Środowiska, biotechnologia
Immobilizacja - Zarys, Studia PŁ, Ochrona Środowiska, Biochemia, Biotechnologia
Enzymy przemysłowe - 2008, Studia PŁ, Ochrona Środowiska, Biochemia, Biotechnologia
Semantyka pojęć biotechnologii, Studia PŁ, Ochrona Środowiska, Biochemia, Biotechnologia
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
Zadanie koncowe, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Ćwiczenie nr2, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Zadanie końcowe, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
tabEnzymy, Studia PŁ, Ochrona Środowiska, Biochemia, laborki
spr57, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
KLASYFIKACJA GLEB, Studia PŁ, Ochrona Środowiska, Gleboznawstwo
monia 11, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
sprEnzymyII, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
2011 info dla studentow sesja letnia OŚ, Studia PŁ, Ochrona Środowiska, Chemia, ogólna i nieorganicz
KOND41vmac, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II s
więcej podobnych podstron