Praca inżynierska. Razem z wnioskami i bibliografią 30 stron.
Całość pracy - 200 zł.
KOD pracy-PR1
Napisz chomikujpracepisemne@gmail.com
PROJEKT INŻYNIERSKI
Utlenianie stopów typu Fe-Cr-Al. W różnych środowiskach korozyjnych
Słowa kluczowe: stop, korozja, reakcja utlenienia, zgorzeliny, żaroodporność
W mojej pracy został omówiony wpływ korozji na stopy. Do czego doprowadza korozja oraz jak możemy ją zwalczyć lub zapobiec jej, aby nie występowała. Praca zawiera również wiadomości o zgorzelinach (jak powstają, jakie mają właściwości oraz jakie spełniają zadanie) oraz o żaroodporności
Spis Treści
Wstęp
Ze względu na stosunkowo łatwą i tanią produkcję stop typu Fe-Cr-Al z grupy AFA (Alumina Forming Alloys) ma bardzo szerokie zastosowanie w różnych gałęziach przemysłowych: jest najczęściej stosowanym materiałem do tworzenia drutów oporowych w elektrycznych piecach stosowanych w przemyśle metalurgicznym, ceramicznym i chemicznym oraz wszędzie, gdzie jest wymagane zastosowanie wysokiej temperatury np. przy produkcji turbin gazowych, do wyrobu elementów pieców przemysłowych, jako komory spalania, jako elementy osłonowe w energetycznym przemyśle, do budowy elektrod, w ogniwach paliwowych, jako elementy w przemyśle motoryzacyjnym i lotniczym, również, jako zewnętrzna warstwa obudowy statków kosmicznych. Stale te mogą być wykorzystywane, jako materiał konstrukcyjny przeznaczony do pracy w atmosferach gazów przemysłowych, które są zanieczyszczone między innymi O2, SO2 oraz parą wodną [1].
Stale i stopy narażone są na działanie utleniających atmosfer czy też atmosfer zawierających związki siarki i inne. W zależności od rodzaju przemysłu, ten rodzaj materiałów poddawany jest działaniom atmosfer zawierających różne prężności cząstkowe par tlenu i siarki (od 10-15 do 10-20 Pa tlen oraz od 10-5 do 10-4 Pa siarki) [2]. W sytuacji, kiedy obok tlenu gazy spalinowe zawierają dodatkowo siarkę, to stale i stopy w takim składzie atmosfer pracują w ekstremalnie agresywnych warunkach. Dzieje się tak dlatego, że prężność tlenu w takiej atmosferze jest kilka rzędów razy wyższa niż prężność par siarki, a to powoduje odmienny (utleniająco-siarkujący) charakter chemiczny atmosfer. W takich właśnie warunkach stale zaliczane do grupy AFA powinny wykazywać odporność na wysokotemperaturową korozję ze względu na niskie ciśnienie cząstkowe par siarki, które jest niewystarczające, aby wytworzyć produkty siarkowania. Niestety często stale te ulegają szybkiej degradacji w atmosferach o złożonym składzie chemicznym, ponieważ składniki gazów mogą ze sobą reagować powodując wytwarzanie się związków chemicznych pomiędzy nimi.
Na powierzchni tych materiałów w trakcie procesu np. wysokotemperaturowego siarkowania przebiegającego w atmosferach takich jak gazowa siarka, siarkowodór, gazy spalinowe, merkaptany czy inne tworzą się wielowarstwowe zgorzeliny siarczkowe, które ze względu na swoją budowę wykazują słabe właściwości ochronne i nie zabezpieczają stali przed degradacją. Natomiast w atmosferach utleniających tworzy się ochronna warstwa tlenku glinu, który może występować w różnych odmianach krystalograficznych. Wytworzona warstwa tlenku glinu zasadniczo przeciwdziała degradacji rdzenia metalicznego.
Korozja to zjawisko niemożliwe do całkowitego wyeliminowania, ale można je znacznie ograniczyć. Metale i ich stopy w wyniku korozji ulegają nieodwracalnemu zniszczeniu (około 10% produkcji światowej), ponieważ metale te tylko w części można odzyskać w procesie hutniczym ze skorodowanych elementów konstrukcji, urządzeń i maszyn. Umiejętne zapobieganie korozji może skutecznie obniżyć degradację materiałów i środowiska głównie poprzez stosowanie metod ochrony przeciwkorozyjnej oraz właściwy dobór materiałów. W znaczący sposób można obniżyć koszty eksploatacji poprzez prawidłowe zaprojektowanie konstrukcji z uwzględnieniem zagrożeń korozyjnych i metod ochrony przed korozją.
Ze względu na szerokie zastosowanie stopu typu Fe-Cr-Al, tak ważne jest prowadzenie szczegółowych i wyczerpujących badań tematu jej utleniania.
Korozja - następstwem reakcji utleniania
Zjawisko korozji metali i stopów
Niszczenie materiału pod wpływem chemicznego lub elektrochemicznego oddziaływania
środowiska, to zjawisko zwane korozją. Różnorodne materiały ulegają zjawisku korozji, nie tylko metaliczne. W zasadzie od typu przewodności elektrycznej na granicy faz materiał-środowisko i od rodzaju środowiska zależy mechanizm korozji różnych materiałów. Charakter głównie elektrochemiczny korozja ma dla materiałów o wysokiej przewodności. Przy niskiej przewodności lub przy jej braku korozja zachodzi jako proces chemiczny lub fizykochemiczny [2].
Korozję metali i ich stopów obserwuje się przede wszystkim na ich powierzchniach w postaci nagromadzenia się stałych produktów reakcji takich jak np. rdza, tlenki, zgorzelina. Jeśli produkty reakcji odpadają od podłoża metalicznego wówczas obserwuje się nierówności powierzchni pierwotnie gładkiej lub wżery. Również mogą tworzyć się rozpuszczalne w środowisku korozyjnym produkty (jony metali) zanieczyszczające w niektórych przypadkach niebezpiecznie środowisko. W zależności od charakteru zniszczenia korozyjnego rozróżnia się: korozję ogólną, która może być równomierna lub nierównomierna oraz korozję miejscową np. punktową, wżerową, międzykrystaliczną, szczelinową.
Stan powierzchni metalowego elementu istotnie wpływa na szybkość przebiegu korozji. Przyspieszenie przebiegu korozji może być również spowodowane uprzywilejowaną orientacją krystalograficzną powierzchni metalu narażonej na działanie atmosfery utleniającej. Proces korozji gazowej może ułatwić i przyspieszyć obróbka mechaniczna, powodująca wzrost naprężeń własnych, zwiększenie liczby defektów sieciowych w zewnętrznej warstwie metalu lub stopu oraz umożliwiająca wprowadzenie drobnych cząsteczek wyrwanych z narzędzia, a także utworzenie warstewek tlenków lub wodorotlenków w wyniku lokalnego nagrzania metalu. Podobny wpływ wywiera także obróbka elektroerozyjna lub chemiczna. Równomierne narastanie zgorzeliny i jej odkształcenie plastyczne bez mikroszczelin i pęknięć utrudniają większe wymiary i bardziej nieregularne kształty nierówności utworzonych w wyniku niedokładnej obróbki powierzchni metalu lub stopu, a to sprzyja zatem przyspieszonej korozji gazowej.
Korozja chemiczna
W wyniku działania suchych gazów lub cieczy (płynne elektrolity) nieprzewodzących prądu elektrycznego następuje korozja chemiczna metali. Korozja chemiczna polega na chemicznym oddziaływaniu ośrodka na materiał i tworzeniu z pierwiastkami lub związkami pochodzącymi z otoczenia określonych związków chemicznych [2].
Korozja chemiczna w odróżnieniu od korozji elektrochemicznej przebiega na sucho, bez udziału elektrolitu. Najczęstszym przykładem korozji chemicznej jest korozja gazowa. Terminem korozji gazowej określa się korozję chemiczną zachodzącą w warunkach eliminujących możliwość kondensacji par i zapewniających wyłącznie kontakt powierzchni metalu z reagentem pochodzącym z fazy gazowej. Korozja gazowa występuje w wysokich temperaturach [3]. Może mieć ona miejsce nie tylko podczas kontaktowania metalu z tlenem, ale także z innymi chemicznie czynnymi gazami, jak Cl2, SO2, suchy HCl, H2S czy też suche pary H2O.
Korozja gazowa przynosi szczególnie dotkliwe straty w przemyśle: chemicznym, energetycznym, w transporcie samochodowym i lotniczym - czyli wszędzie tam, gdzie mnóstwo elementów konstrukcyjnych jest narażonych na działanie gorących par i gazów. Również znaczne straty korozja gazowa powoduje w procesie wytwarzania metali, głównie wskutek tworzenia się zgorzeliny podczas obróbki plastycznej i cieplnej metali i stopów, zwłaszcza stali, stając się tym samym przedmiotem szczególnego zainteresowania technologów obróbki plastycznej i cieplnej.
Korozja elektrochemiczna
Jednym z najczęściej występujących mechanizmów korozji jest korozja elektrochemiczna. Będąca przyczyną największych zniszczeń tworzyw i stalowych konstrukcji, korozja elektrochemiczna, wywoływana jest przepływem ładunków elektrycznych przez granicę metal - elektrolit pod wpływem lokalnej różnicy potencjałów. Obecność lokalnych ogniw na powierzchni metalu może wynikać zarówno z niejednorodności materiału pod względem strukturalnym, jak i chemicznym. Korozję elektrochemiczną zazwyczaj dzieli się korozję atmosferyczną zachodzącą pod wpływem oddziaływania wilgotnego powietrza i zawartych w nim zanieczyszczeń oraz na korozję w płynach, czyli grupę procesów zachodzących w środowisku roztworów elektrolitów (kwasów, zasad, soli) [4].
Powierzchnia każdego metalu lub stopu może zostać potraktowana jako zbiór elektrod dodatnich i ujemnych, krótko zwartych przez sam metal (rys.1) . Między elektrodami, którymi są elementy struktury stopów lub metali, występuje różnica potencjałów. Poprzez działanie elektrolitu (np. woda lub roztwory wodne soli, kwasów i zasad) na metal tworzą się lokalne mikroogniwa i następuje lokalny przepływ prądu elektrycznego. Towarzyszą temu procesowi reakcje chemiczne redukcji i utleniania. Na elektrodzie zwanej katodą zachodzi reakcja chemiczna redukcji (reakcja katodowa) i jest związana z przepływem umownego prądu dodatniego z roztworu elektrolitu do elektrody. Z kolei na elektrodzie zwanej anodą przebiega reakcja chemiczna utleniania (reakcja anodowa), która związana jest z przepływem dodatnich ładunków elektrycznych z elektrody do elektrolitu. Proces korozji przebiega w wyniku elektrochemicznych procesów zachodzących w mikroogniwach na powierzchni metalu poddanego działaniu elektrolitu [3].
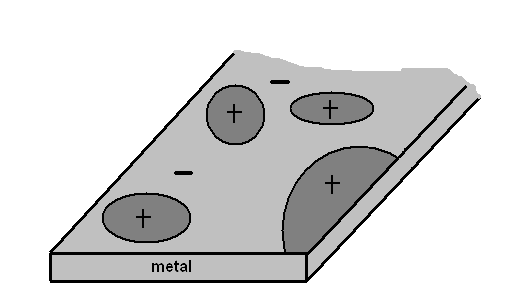
Rys. 1. Rozmieszczenie lokalnych ogniw korozyjnych na powierzchni metalu [3].
Metody ochrony przed korozją
Do czasowej ochrony przed korozją stosuje się smary i oleje nasycone inhibitorami organicznymi, pokrycia te jednak mogą być łatwo usunięte z powierzchni metalu. Korozji zapobiega się między innymi przez stosowanie trwalszej ochrony w postaci różnego rodzaju powłok ochronnych (wytworzenie na powierzchni przedmiotu cienkich warstewek ochronnych: tlenkowych lub fosforanowych, osadzenie warstwy innego metalu, pokrywanie farbami, emaliami i tworzywami sztucznymi), stopowanie materiałów (metali) celem nadania im odporności na działanie środowiska bądź przeciwdziałanie elektrokorozji technikami ochrony katodowej lub anodowej (pasywacja) [3]. Najlepszą odporność na korozję spośród tworzyw metalicznych wykazują metale łatwo ulegające pasywacji (chrom, cyrkon, tytan).
W zasadzie poprzez prawidłowy dobór materiału i unikanie bezpośrednich połączeń różnych metali można znacznie ograniczyć lub zapobiec korozji metali. Należy w miarę możliwości obierać materiały o małej różnicy potencjałów elektrodowych. Przy łączeniu dwóch różnych metali należy unikać połączeń, w których anody o małej powierzchni stykają się z katodami o dużej powierzchni. W konstrukcji należy unikać wystąpienia miejsc, w których zbierają się zanieczyszczenie lub elektrolity, jak również nie należy pozostawiać przestrzeni pozbawionych wentylacji. Ważne jest, aby właściwie dobrać materiał i poddać go odpowiedniej obróbce cieplnej, np. prawidłowo wykonane wyżarzanie ujednorodniające zmniejsza skłonność do powstawania ogniw galwanicznych, a obniżenie stężenia węgla w stali i przez to ograniczenie tworzenia się węglików, zapobiega w istocie korozji międzykrystalicznej [3].
Utlenianie metali i ich stopów
Poddany działaniu środowiska utleniającego metal bądź stop powoduje wytworzenie produktów reakcji, które w zależności od warunków zewnętrznych i składu tworzyw mogą być lotne, ciekłe lub stałe. Produkty tworzą się z reguły na powierzchni metalu, lecz w pewnych warunkach proces utleniania może zachodzić równocześnie lub nawet wyłącznie w głębi fazy metalicznej w wyniku rozpuszczania się w niej utleniacza, następuje tzw. utlenianie wewnętrzne[2]. Małe stężenie tlenu w otaczającej atmosferze, niewystarczające do wytworzenia się warstwy produktu reakcji tlenu z metalem podstawowym jest częstą przyczyną tego zjawiska. Głównymi składnikami powodującymi utlenianie wewnętrzne jest wodór, tlen, azot. Stosunkowo szybko migrują one w głąb materiału tworząc obszary międzywęzłowe. Wodór wnikając do metalu reaguje z węglem i tlenem tworząc węglowodorki np. metan (korozja wodorowa).
Do odosobnionych przypadków należy tworzenie się ciekłych i gazowych produktów utleniania metali oraz stopów. Stałe produkty utleniania zwykle tworzą się w szerokim zakresie temperatur na metalach i w zależności od szybkości powstawania określa się je mianem zgorzelin lub warstw nalotowych [2].
Proces utleniania w wysokich i podwyższonych temperaturach zachodzi dzięki dyfuzji jednego lub obu reagujących substratów poprzez warstwę produktu. W najprostszym przypadku - utleniania czystego metalu i tworzenia się jednofazowej zwartej zgorzeliny.
Kinetyka i mechanizm utleniania metali
Produkt reakcji utleniania w każdym przypadku korozji pozostaje na powierzchni metalu w postaci mniej lub bardziej zwartej warstwy i rozdziela reagujące substraty. W przypadku dostatecznie zwartych warstw i przy odpowiednio niskich temperaturach może wówczas dojść do całkowitego zahamowania procesu. Zjawisko to zwane pasywacją metalu ma miejsce w przypadku glinu. Utlenianie metalu ogranicza się wówczas do zmatowienia oraz do uformowania bardzo cienkiej (nalotowej) warstwy tlenków. Za podstawowy warunek odpowiedniej szczelności warstwy tlenkowej oraz jej wykorzystaniu do ochrony metalu przed dalszą korozją przyjmuje się jej większą objętość w stosunku do objętości metalu, z którego powstał tlenek. Nie jest to jednakże warunek wystarczający dla pasywacji metalu oraz ciągłości warstwy tlenku [5]. Przy dużej różnicy objętości może dochodzić do silnych naprężeń, pęknięcia warstwy oraz do tworzenia dróg szybkiej dyfuzji tlenu. Najtrwalsze warstwy ochronne powinny, zatem spełniać nie jeden, lecz zespół kryteriów koniecznych, przede wszystkim muszą być dostatecznie cienkie, dobrze przylegać do powierzchni metalu oraz mieć współczynnik rozszerzalności cieplnej bardzo bliski współczynnikowi metalu.
W literaturze podaje się następujące kryteria warunkujące właściwą szczelność warstwy tlenkowej [4]:
jeżeli
>1 warstwa może być szczelna,
jeżeli
<1 warstwa nie może być szczelna
gdzie: W, w - odpowiednio: masa molowa tlenku i metalu
D, d - odpowiednio: gęstość tlenku i metalu.
Tabela 1 Wartości stosunku
dla metalu Fe, Cr, Al. [4].
Metal |
Tlenek |
(W∙D)/(w∙d) |
Al |
Al2O3 |
1,21 |
Cr |
Cr2O3 |
2,03 |
Fe |
Fe2O3 |
2,16 |
Chcesz uzyskać dostęp do całej pracy? Napisz chomikujpracepisemne@gmail.com
2
Wyszukiwarka
Podobne podstrony:
2 23 lutego 2011 Izolowanie mikroorganizmów z różnych środowisk naturalnych
Potencjał Elektorodowy Metali w Różnych Środowiskach, Sprawozdania - Fizyka
2 Izolowanie mikroorganizmów z różnych środowisk naturalnych
2 23 lutego 2011 Izolowanie mikroorganizmów z różnych środowisk naturalnych
Słownik środowiskowy wybranej grupy społecznej na przykładzie gwary policjantów, Prace pedagogika
ochrona środowiska kulturowego i turystyka, Pomoce naukowe, studia, ochrona srodowiska
Nowe media jako środowisko wychowawcze (Pedagogika społeczna), Pedagogika, Studia stacjonarne I sto
cygan,ochrona środowiska, OCENA ODDZIAŁYWANIA GARBARNI NA ŚRODOWISKO
ERA, Ochrona Środowiska, OOŚ, ocena oddziaływań na środowisko
3.3 Biomasa roslinna odnawialne zrodlo energii w srodowisku, Przedmioty do wyboru na sem. 3 i 4, prz
Lista pomocnicza etapu kwalifikowania, Ochrona Środowiska, OOŚ, ocena oddziaływań na środowisko
egzamin- 2, WODA- W produktach spożywczych woda występuje w różnych postaciach, ogólnie i dzieli się
Lista kontr-inwestycja, Ochrona Środowiska, OOŚ, ocena oddziaływań na środowisko
DEGRADACJA ŚRODOWISKA PRZYRODNICZEGO I JEJ WPŁYW NA ZDROWIE, INNE KIERUNKI, biologia
lista1, Ochrona Środowiska, OOŚ, ocena oddziaływań na środowisko
więcej podobnych podstron