zawartość białka w produktach roślinnych :
Ryż |
9% |
Strączkowe |
20-40% |
Ziemniaki |
2% |
Mąka pszenna |
10% |
Owoce |
<1% |
Podział białek :
Albuminy
Globuliny
Prolaminy
Gluteiny
Albuminy- mała masa cząsteczkowa , dobra rozpuszczalność w wodzie (α-laktoalbumina, albuminy surowicy.)
Globuliny- słabo lub brak rozpuszczalności w wodzie. Rozpuszczalne są solach 0,5 M NaCl (laktoglobulina, faseolina )
Prolaminy- duża zawartość kwasu glutaminowego i proliny , nierozpuszczalne w wodzie i soli, rozpuszczalne w 50-90% etanolu i gliadynie .
Gluteiny- duża zawartość kwasu glutaminowego, rozpuszczalne w 0,2% roztworze NaOH
Podział białek Cd.
Oznaczanie białek na podstawie zawartości azotu :
Klejdahl
Wbudowywanie barwinków
Miareczkowanie formolowe
Oznaczanie UV 260-280 nm. (TR, PH, TYR)
IR amidy I i II
Analizowaną próbkę mineralizuje się w stężonym kwasie siarkowym z dodatkiem selenu jako katalizatora, nadtlenku wodoru jako utleniacza (jeśli jest konieczny) i siarczanu potasu służącego do podwyższenia temperatury wrzenia kwasu siarkowego. Po mineralizacji próbki, azot w niej zawarty występuje w postaci kwaśnego siarczanu amonu.
Ostudzony roztwór zadaje się roztworem mocnej zasady i oddestylowuje wydzielony amoniak do roztworu nasyconego kwasu borowego z dodatkiem wskaźnika mieszanego (czerwień metylowa + zieleń bromokrezolowa). Roztwór amoniaku w kwasie borowym oznacza się przez miareczkowanie mianowanym roztworem kwasu solnego (0,01 M do uzyskania barwy początkowej, takiej jak przed absorpcja amoniaku).
Mineralizacja :
Białko +![]()
2.Destylacja :
alkalizacja i oddestylowanie amoniaku :
![]()
3.Miareczkowanie mianowanym roztworem kwasu solnego.
Mnożnik dla białka :
Mnożnik opiera się na przeciętnej zawartości azotu w białkach roślinnych i zwierzęcych (16%) 100/16=6,25
Białko |
Zawartość N w białku |
Mnożnik |
Mleko |
15,7 |
6,37 |
Mięso |
16 |
6,25 |
Jęczmień Rzepak, fasola |
16,7 |
6,00 |
Owies, groch |
17,6 |
5,7 |
Bawełna, len |
18,2 |
5,5 |
|
|
|
VIII. wyznaczanie mas cząsteczkowych :
Średnia masa cząsteczkowa
Ultrawirówka (sedymentacja)
Chromatografia żelowa
Ultrawirowanie- oparte na sedymentacji , osadzanie cząstek rozpuszczonego polimeru w zależności od masy, kształtu, współczynnika sedymentacji . Pod wpływem pola odśrodkowego, przyśpieszenie osiągane w ultrawirówce 10- 100xg
Chromatografia Żelowa :
Sefadex- spolimeryzowany dekstran , polisacharyd otrzymywany czasie fermentacji z sacharozy przez Leuconostoc mesentereoides .
Sefadexy- hydrofilowe moczone w wodzie, lipofilowe LH-20 do wymywania polimerów organicznych. Rozdział uwarunkowany ograniczona dyfuzją cząsteczek do wnętrza żelu.
Wysoko sprawna chromatografia wykluczenia :
Chromatografia wykluczenia ( ang. EC- exclusion chromatography ) określana tez jako chromatografia filtracyjna lub żelowa (ang. GPC- Gel permeation chromatography) jest specyficznym typem chromatografii .
O rozdziale decyduje wielkości i kształt cząstek analizowanych składników .
W kolumnie umieszcza się fazę stacjonarną o określonej wielkości porów. Małe cząsteczki mogą migrować do wnętrza porów i powrotem do przestrzeni pomiędzy ziarnami wypełnienia , gdzie przemieszcza się faza ruchoma. Natomiast cząsteczki o rozmiarach przewyższających wielkości porów posuwają się głównym strumieniem fazy ruchomej. W wyniku tego procesu następuje opóźnienie przesuwania się w kolumnie małych cząstek , tym większe im mniejsza jest cząsteczka. Ostanie kolumnę opuszczają cząsteczki o najmniejszej masie , są to zwykle cząsteczki fazy ruchomej . Można przyjąć że czas trwania rozdziału sprowadza się do czasu przepływu fazy ruchomej przez złoże kolumny.
Wypełnienia :
Wypełnienia do chromatografii żelowej dzieli się na wypełnienia (żele) miękkie, półtwarde i twarde. :
Żele twarde są oparte na materiałach nieorganicznych takich jak szkło, żele krzemionkowe, żele krzemionkowe modyfikowane.
Żele półtwarde są produkowane z polistyrenu, octanu poliwinylu polimetakrylanu metylu.
Żele miękkie są wytwarzane z częściowo sieciowanego polistyrenu , polidekstranu , poliakryloamidu.
Oznaczanie wartości odżywczej :
metoda chemiczna - analiza aminokwasów
metoda biologiczna
Metoda chemiczna :
hydroliza kwasowa w 6M HCL w 24 h w temp. 120 C , niszczy: tryptofan, serynę, treoninę .
hydroliza zasadowa: niszczy : argininę, cysteinę, cystynę, serynę i treoninę
Hydroliza enzymatyczna - nie wykorzystujemy w oznaczaniu zawartych aminokwasów w białkach no tracą łańcuch polipeptydowy w określonych miejscach . Próbkę po hydrolizie należy oczyścić i przeprowadzić oznaczenie.
Automatyczny analizator aminokwasów (AAA) :
Rozdział ( na zasadzie jonowymiennych ugrupowań , pH buforu dostosowane do pH aminokwasu ) prowadzony na kolumnach wypełnionych żywica jonowymienną - kationit z grupami sulfonowymi, wymiana jonowa między grupami kationitu ![]()
i aminokwasem ![]()
.
Wysoko sprawna chromatografia jonowymienna :
w chromatografii jonowymiennej wykorzystuje się zjawisko wymiany jonów w centrach umieszczonych na powierzchni stałego nośnika .
o rozdziale decydują oddziaływania międzycząsteczkowe jonów pochodzących z próbki z grupami jonowymiennymi a proces wymiany jonowej zależy od pH i mocy jonowej fazy ruchomej.
Wypełnienia :
nowoczesne wypełnienia do chromatografii jonowymiennej , są otrzymywane przez chemiczne wiązanie związków zawierających grupy jonowymienne z powierzchnią inertnego nośnika. Materiały zawierające grupy jonowymienne zdolne do wymiany kationów nazywane są kationitami , natomiast zdolne do wymiany anionów anionitami.
W zależność od właściwości wyróżnia się :
Kationity silnie kwasowe , głównie na bazie silnie sulfonowej
Kationity słabo kwasowe, np. z grupą karboksylową
Anionity silnie zasadowe, głównie na bazie grupy czteroalkiloamoniowej.
Anionity słabo zasadowe na bazie amin trzeciorzędowych
Chromatografia na kolumnach jonowymiennych znajduje zastosowanie w oznaczaniu nonowych substancji organicznych i nieorganicznych
pH buforów :
3,0 -kwas asparaginowy, treonina, seryna
3,5- kwas glutaminowy, prolina glicyna, walina
4,25- metionina, izoleucyna, leucyna
5,28- lizyna, histydyna, arginina
Aminokwasy są wymywane odpowiednim zestawem. Stosowana jest ninhydryna - barwnik dający niebieskie zabarwienie z aminokwasami, prócz proliny która daje barwę żółtą. Reakcja zachodzi powoli, przyspiesza się ją podwyższając temperaturę. Mieszaninę umieszczamy na fotokolorymetrze, który ma dwa filtry . Następnie na rejestrator , gdzie rejestrowane są odpowiednie piki aminokwasów.
Ninhidryna:
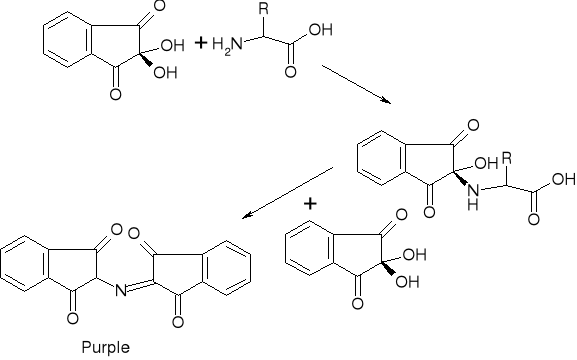
XI. Detekcja pochodnych AA po kolumnie :
Ninhidryna :
Pierwszo i drugorzędowe AA
Produkty- 570 nm. dla pierwszorzędowych
440 nm. dla drugorzędowych AA
Czułość 10-tki pikomoli
OPA aldehyd ortoftalowy :
Pierwszorzędowe AA
Drugorzędowe AA gdy próbka utleniona przed derywatyzacją
Czułość 10pmoli
Metody analizy AA :
Rozdział AA:
Zazwyczaj wymagają derywatyzacji po kolumnie
Jono-wymienna- silnie kationowo wymienne kolumny
Jonowymienne- silne anionowo - dla detekcji elektrochemicznej bez upochodnienia.
Parowania jonów -faza odwrócona HPLC
Rozdział pochodnych AA :
Różnorodność odczynników
Wszystkie rozdziały techniką RPLC
Metody biologiczne :
Stosuje się wskaźnik aminokwasów ograniczających CS :
![]()
Zawartość aminokwasów egzogennych w :
a-badane białko
aj-białku wzorcowym (białko jaja kurzego)
Badanie białek :
Metody oczyszczania białek :
Techniki wirowania
Wytrącania- różnice rozpuszczalności
Chromatografia kolumnowa :
Żelowa GPC
Wiązania białek :
Jonowymienna
Powinowactwa
HPLC
Metody Elektroforetyczna
Właściwość funkcjonalne |
Sposób działania |
Przykłady produktów |
Rozpuszczalność
Absorpcja i wiązanie wody
Lepkość
Żelowanie
Kohezyjność Adhezyjność
Elastyczność
Emulsyjność
Absorpcja tłuszczu
Wiązanie substancji smakowo zapachowych
Pianotwórczość |
Solwatacja
Tworzenie wiązań wodorowych inkluzja wody
Gęstnienie wiązanie wody
Tworzenie matrycy koagulacja
Spoiwo lepiszcze
Tworzenie oddziaływań hydrofobowych , wiązań dwusiarczkowych
Tworzenie emulsji stabilizacja emulsji tłuszczowych
Wiązanie wolnego tłuszczu
Adsorpcja, inkluzja , regeneracja
Tworzenie błonki wokół pęcherzyków |
Napoje
Mięso, wędliny, chleb
Zupy, sosy
Mięso sery, galarety
Wędliny ciasta
Mięso pieczywo
Wędliny, zupy, ciasta
Mięso wędliny
Analogi mięsa, pieczywo
Kremy, desery, biszkopty, bezy |
Białka są składnikiem żywność charakteryzującym się :
Wysoką wartością odżywczą
Stanowią źródło aminokwasów niezbędnych do wzrostu i prawidłowego funkcjonowania organizmu
Są źródłem energii
Oraz odgrywają rolę składników modelujących cechy funkcjonalne
Zapotrzebowanie na białko :
Zapotrzebowanie na białko jest związane szczególnie w ostatnich latach z rozwojem nowych asortymentów żywności oraz z zapotrzebowaniem na żywność szybką i wygodną .
Dodatek białka do żywność stwarza stwarza szerokie możliwość zmian nie tylko wartości żywieniowej ale głownie właściwości funkcjonalnych .
Stad tez oznace w ostatnich latach zapotrzebowanie na preparaty białkowe, które ze względu na unikatowe właściwości zarówno technologiczne jak i żywieniowe.
Właściwości białek w żywności :
zdrowotne i żywieniowe :
nieobecność czynników toksycznych
niski poziom czynników antyodżywczych i innych substancji szkodliwych , oraz możliwość ich termicznej inaktywacji .
duża zawartość białka
czystość mikrobiologiczna
wysoka biologiczna wartość odżywcza
Funkcjonalne :
Korzystne właściwość fizykochemiczne w zakresie adsorpcji wody i tłuszczu
Zdolność zatrzymania wody i tworzenia struktur
Zdolność emulgowania tłuszczu
Sensoryczne :
Neutralność w zakresie barwy, smaku, zapachu
Zdolność do dobrego komponowania się podstawowymi surowcami w produkcie .
Właściwości funkcjonalne białek możemy podzielić na :
Organoleptyczne: barwa, smak zapach , tekstura
Kinestetyczne: gładkość, zmętnienie
Właściwości wynikające z obecności wody:
Rozpuszczalność, rozpraszalność, absorpcja wody, żelowanie, zdolność zatrzymywania wody, synereza, lepkość.
Powierzchniowe: tworzenie emulsji, pienienie się , napowietrzanie, tworzenie błon , stabilizacja.
Strukturalne : elastyczność, kohezja, gumowatość
Teksturalne: lepkość, adhezja, tworzenie struktur
Reologiczne : agregacja, żelowanie, tworzenie włókien elastycznych
Inne: współdziałanie z dodatkami, enzymatyczne, właściwości modyfikujące.
Efekt pH :
Ładunek jest determinowany głownie przez grupy kwasowe i zasadowe cząsteczki : (COOH, NH2) jonizacja tych grup zależy do pH
Punkt izoelektryczny - białek pH przy którym cząsteczka nie ma ładunku.
Powyżej PI- ma ładunek ujemny
Poniżej PI ma ładunek dodatni
Szybkość migracji proporcjonalna do ładunku i dlatego elektroforezę prowadzi się w roztworach
buforowanych.
Elektroforeza żelowa :
Nośnikiem żelu płytka , lub w kształcie płytki
Porowaty i chemiczne stabilny żel
Chromatograficzna natura żelu może być wykorzystana do wsparcia rozdziału np… wielkość porów -rozdział wg ciężarów cząsteczkowych
MEKC
Micelarna elektrochemiczna chromatografia kapilarna- Micellar elektrokinetic chromatography (MEKC)
Środek powierzchniowo czynny dodawany jest w nadmiarze do bufora, aż do wytworzenia miceli. Micele maja hydrofobowe jądro i zewnętrzny ładunek powodujący ruchliwość elektroforetyczną w zewnętrznym polu elektrycznym. Ruchliwość naładowanych miceli stanowi wypadkową ruchliwości elektroforetycznej i elektroosmotycznej.
Rozdziela naładowane i obojętne związki.
MEKC proces chromatograficzny lub pseudochromatograficzny -rozdział w oparciu o pseudsostacjonarną fazę.
Zastosowania :
Białka i peptydy produkty mięsnych, mleczarskich i zbożowych
AA i biogenne aminy
Produkty reakcji Maillarda
Witaminy
Fenolowe przeciwutleniacze w herbatach i winie
Dodatki do żywności ( barwniki, środki słodzące, konserwanty)
Kwasy organiczne w napojach
Pozostałości i zanieczyszczenia żywności
Związki toksyczne
Co to jest elektroforeza ??
Technika rozdziału oparta o ruch naładowanych cząstek
Medium-płynie
Pod wpływem pola elektrycznego
Elektroforeza- nazwa pochodzi połączenia słów elektro- i greckiego phoresis- przenoszenie, a podstawa technik elektroforetycznych jest fakt, ze cząstka obdarzona, ładunkiem i umieszczona w polu elektrycznym przemieszcza się .
Do katody (elektrody ujemnej) wędrują cząstki obdarzone ładunkiem dodatnim i ten proces nosi nazwę kataforezy. Natomiast do anody (elektrody dodatniej) wędrują cząstki obdarzone ładunkiem ujemnym i ten proces nosi nazwę anaforezy .
Szybkość poruszania się cząstek w polu elektrycznym jest zróżnicowana i stanowi podstawę elektroforetycznego rozdzielenia mieszanin, przy czym prędkość ta jest wielkością charakterystyczną dla danej cząstki iż zależy od wielu czynników : które można podzielić na trzy zasadnicze grupy :
Właściwości rozdzielanych cząstek
Środowisko w którym cząstki wędrują podczas elektroforezy
Rozdział przeprowadza się w kapilarach ze stopionej krzemionki
(kwarcu) SiO2 wypełnionych roztworem elektrolitu nośnego .
Najczęściej stosowane są kapilary o średnicy wew. 25-75um i długości
około 50 cm Z zew. Stopiona krzemionka pokryta jest warstwą
poliamidową, celem zwiększenia jej wytrzymałości.
Elektroforeza kapilarna :
W elektroforezie kapilarnej decydujące znaczenie ma
jeszcze jedno zjawisko- elektroosmoza
gdy do końców kapilary wypełnionej roztworem elektrolitu
przyłożymy wysokie napięcie , obserwujemy przepływ
elektroosmotyczny , który polega na przemieszczaniu się. całej
masy elektrolitu w kierunku jednej z elektrod.
Przepływ osmotyczny Przepływ laminarny
Materiały żelowe :
Agaroza :
Polisacharydy otrzymane z agaru
„prawdziwa elektroforeza” cząsteczki nie są absorbowane na nośniku
Dużo zastosowań do badań enzymów i wirusów
Poliakrylamid (PAGE) :
Polimeryzacja akrylamidu w obecności N,N` -methylene- bis acrylamide
Wielkość porów może być kontrolowana
Mobilność cząstek obdarzonych ładunkiem zależy od :
Mobilności elektroforetycznej
Molekularne sita -pory nośnika
SDS-PAGE
Siarczan sodu dodecylu , surfaktant amoniowy (detergent)
SDS wiąże się. z miejscami hydrofobowymi białek i wspiera rozdział poprzez :
Zmniejszenie agregacji cząstek białka
Wprowadzenie dużego ładunku - na białku- wpiera rozdział zgodnie
ciężarem cząstek - bardziej niż wielkością ładunku.
Próbka wprowadzana od strony anody
Podstawowe metody detekcji w CE
Metoda detekcji |
Limit detekcji (mol/dm ^3) |
Spektrofotometria absorpcyjna |
|
S. fluorescencyjna |
|
NMR |
|
Elektrochemia |
|
Konduktometria |
|
Potencjometria |
|
Amperometria |
|
Radiometria |
|
Micelarna elektrokinetyczna chromatografia kapilarna :
Odmianą CE pozwalającą na rozdział cząstek obojętnych. Stosowane są jonowe związki powierzchniowo czynne w stężeniu przekraczającym krytyczne stężenie micelarne (CMC) . do najczęściej stosowanych surfaktantów amoniowych należą SDS (
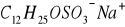
)
Elektroforeza w nośnikach :
Wyeliminowanie zjawiska konwekcji cieczy, oraz znaczne ograniczenie dyfuzji., a także uproszczenie sposobu nanoszenia próbek. Zmniejszenie ich ilości i uproszczenie aparatury uzyskano dzięki wprowadzeniu podłoży będących nośnikami elektrolitu, podczas elektroforezy . nośnikiem może być odpowiednio uformowana, porowata masa, nasączona cieczą przewodzącą prąd. Cząstki obdarzone ładunkiem migrują w cieczy wypełniającej pory nośnika. O szybkości ich migracji decydują w tym przypadku nie tylko ładunek , ale często także rozmiary cząstek.
Białka
Fibrylarne -białka strukturalne nierozpuszczalne w wodzie i soli. Oporne na działanie alkaliów i kwasów
Kolagen
Elastyna
Kreatyna
Złożone :
Fosfoproteidy- gr. kwasu fosforowego.
Chromoproteidy -gr. hemowa, hemoglobina, mioglobina
Lipoproteidy- połączenia lipidami transport tłuszczu.
Glikoproteiny - kompleksy węglowodanowe z białkiem.