Zadanie 1
Toluen utlenia się katalitycznie do aldehydu benzoesowego według równania:
C6H5 - CH3 + O2 → C6H5CHO + H2O
Stosuje się 250% nadmiar powietrza w stosunku do stechiometrii reakcji. Rzeczywisty stopień konwersji toluenu do aldehydu wynosi 36%. Ponad to 8% toluenu spala się zgodnie z reakcją:
C6H5-CH3 + 9O2 → 7CO2 + 4H2O
Sporządzić bilans materiałowy dla 1 tony toluenu na godzinę.
Zadanie 2
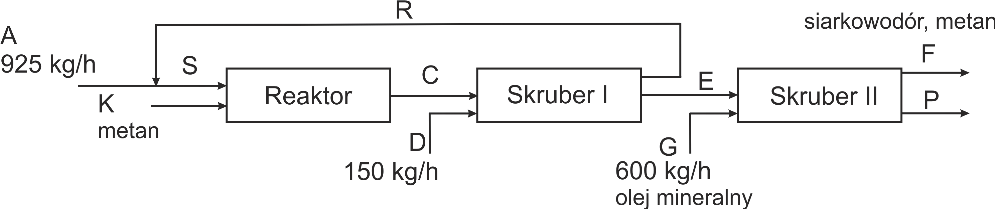
Dwusiarczek węgla otrzymuje się według reakcji:
CH4 + 4S = CS2 + 2H2S
stosując 10% nadmiar CH4. Stopień konwersji siarki wynosi 82%. W skruberze I usuwa się 98% nieprzereagowanej siarki za pomocą ciekłej siarki. Sporządzić bilans materiałowy procesu korzystając ze schematu:
Zadanie 3
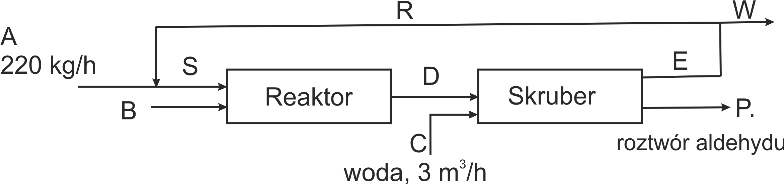
Aldehyd octowy otrzymuje się według reakcji:
C2H4 + 0,5O2 = CH3CHO
stosując 250% nadmiar etylenu w reaktorze. Stopień przemiany tlenu wynosi 87%. Strumień A zawiera 99,8 % wagowych etylenu, natomiast strumień B 99,5% wagowych tlenu. Z mieszaniny poreakcyjnej aldehyd octowy usuwany jest całkowicie w skruberze zraszanym wodą. Stężenie roztworu aldehydu wynosi 10% wagowych. Sporządzić bilans materiałowy posługując się schematem:
Wyszukiwarka
Podobne podstrony:
Zadania 5 bilans masowy b.ftalowy, Studia, ETC
Zadania bilanse, Akademia Górniczo - Hutnicza, Technologia Chemiczna, Studia stacjonarne I stopnia,
Zadania 6 Sankey, Studia, ETC
Zadanie do modułu 3, Studia, Semestry, semestr IV, Metody badań pedagogicznych, Zadania
Biotechnologia zadania bilansowe
zadania dodatkowe, Ekonomia- studia, Finanse publiczne i rynki finansowe
wymiana masy, Studia
ZADANIE A7(11), Studia, Politechnika
Zadania z kół z fizy, Studia Mechatronika, sem 1 i sem 2, fizyka
Załącznik 2 do zadania do moduł 4, Studia, Semestry, semestr IV, Metody badań pedagogicznych, Zadani
lista 1, bilans masy
Zadania z trescia - hydrologia, studia, geografia UJ, hydrologia, ćwiczenia
Przedmiot badania i zadania psychologii rozwojowej, STUDIA, Psychologia rozwojowa
Ćw 3 - zadania wraz z wynikami, STUDIA UE Katowice, semestr I mgr, fir 1 testy, Decyzje inwestycyjne
Zadania L3 I6X4S1, Studia, WAT Informatyka, s3 - GK - lab grafika komputerowa, Lab4
Zadania L3 I6Y3S1, Studia, WAT Informatyka, s3 - GK - lab grafika komputerowa, Lab3
2013PODATKI Zadania na ćwiczenia, Studia Administracja GWSH, Podatki I Prawo Podatkowe
więcej podobnych podstron