RÓWNOWAGA CHEMICZNA - PRZYKŁADOWE ZADANIA - ROK AKAD. 2007/2008
ZADANIE 1.
Chinolina jest zasadą o pKb = 9.12. Oblicz:
a) pH,
b) ułamek zprotonizowanej chinoliny w 0.01 M wodnym roztworze.
a)
Z + H2O ↔ ZH+ + OH-
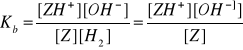
Stężenie [mol l-1] |
Z |
ZH+ |
OH- |
Początkowe |
0.01 |
0 |
0 |
Zmiana w celu osiągnięcia równowagi |
-x |
+ x |
+ x |
W stanie równowagi |
0.01 - x |
x |
x |
![]()
przyjmujemy, że x jest bardzo małe i 0.01 - x ~ 0.01
x2 ≈ Kb x 0.01
x2 ≈ 10-9.12 x 10-2
x ≈ √ 10-11.12
x = √x 10-12 ∙ 100.88 = 10-6 . √100.88 = 10-6 ∙ 7.6
pOH = - log [7.6 ∙ 10-6] = - log [7.6] + 6 = -0.88 + 6 = 5.12
pOH = 5.12
pH = 14 - 5.12 = 8.88
b)
![]()
![]()
ZADANIE 2.
Obliczenie stałej równowagi reakcji biochemicznej.
Glukoza (aq) + Pi(aq) ↔ G6P (aq)
Pi = H2PO4-
ΔGo = +14.0 kJ mol-1
Temp. 37oC
![]()
![]()
Ponieważ funkcja ex jest czuła dla wartości x, należy je oszacować w końcu obliczeń.
ZADANIE 3.
Reakcja A:
izomeryzacja 6-fosforanu glukozy (G6P) do 6-fosforanu fruktozy (F6P), która jest początkowym etapem beztlenowego rozkładu glukozy przebiega zgodnie ze schematem:
G6P (aq) ↔ F6P (aq)
Reakcja B:
wiązanie O2(g) przez hemoglobinę, Hb, we krwi można zapisać wg schematu:
Hb (aq) + 4 O2 (g) ↔ Hb (O2)4 (aq)
Aktywność i stany standardowe
Substancja |
Stan standardowy |
Aktywność |
c.stałe |
Czyste, 1 bar |
1 |
Ciecz |
Czysta, 1 bar |
1 |
Gaz |
Czysta, 1 bar |
p/po |
Substancja |
Stężenie molowe, 1 M |
[1]/co |
Po = 1 bar (= 105 Pa)
Co = 1 M (= 1 mol/dm3)
Aktywności dla gazu doskonałego i roztworu rozcieńczonego są wielkościami bezwymiarowymi.
Podaj Q (iloraz reakcji) dla reakcji A i B.
A.
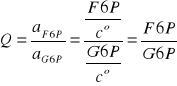
B.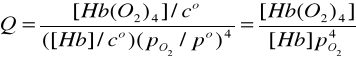
ZADANIE 4.
Reakcja A:
izomeryzacja 6-fosforanu glukozy (G6P) do 6-fosforanu fruktozy (F6P), która jest początkowym etapem beztlenowego rozkładu glukozy przebiega zgodnie ze schematem:
G6P (aq) ↔ F6P (aq)
Reakcja B:
wiązanie O2(g) przez hemoglobinę, Hb, we krwi można zapisać wg schematu:
Hb (aq) + 4 O2 (g) ↔ Hb(O2)4 (aq)
Aktywność i stany standardowe
Substancja |
Stan standardowy |
Aktywność |
c.stałe |
Czyste, 1 bar |
1 |
Ciecz |
Czysta, 1 bar |
1 |
Gaz |
Czysta, 1 bar |
p/po |
Substancja |
Stężenie molowe, 1 M |
[1]/co |
Po = 1 bar (= 105 Pa)
Co = 1 M (= 1 mol/dm3)
Aktywności dla gazu doskonałego i roztworu rozcieńczonego są wielkościami bezwymiarowymi.
Rozpatrując reakcje A, dla której Δr Go = + 1.7 kJ mol-1 w temp. 25oC oszacuj ułamek F6P (izomer fosforanu fruktozy) będący w równowadze z G6P (izomer fosforanu glukozy) w tej samej temperaturze.
Definicja ułamka:
![]()
G6P ↔ F6P
![]()
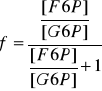
![]()
![]()
ΔrG = - RT ln K
stąd:
![]()
![]()
F6P = 33% i G6P = 67%
ZADANIE 5.
Reakcja przyłączenia tlenu do hemoglobiny (Hb) i mioglobiny (Mb).
Równowaga chemiczna może dotyczyć bardziej złożonych procesów, aniżeli np. konwersja tlenku węgla. Przykładem takiego złożonego procesu jest reakcja przyłączania tlenu do cząsteczki hemoglobiny i mioglobiny. Przyłączanie tlenu do hemoglobiny ma miejsce w krwi. W uproszczony sposób reakcja może być przedstawiona w sposób następujący:
Hb(aq) + 4 O2 (g) ↔ Hb(O2)4 (aq) (1)
Natomiast reakcja przyłączania0 tlenu do mioglobiny ma miejsce w mięśniach i przebiega w sposób następujący:
Mb(aq) + O2 (g) ↔ MbO2 (aq)
dla której stałą równowagi można zapisać w postaci:
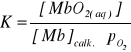
(2)
gdzie: pO2 - cząstkowe ciśnienie tlenu wyrażone w barach.
Oba białka są ze sobą powiązane i hemoglobina może być uznana w pierwszym przybliżeniu jako tetramer mioglobiny.
Z równania (2) wynika, że ułamek nasycenia mioglobiny tlenem, s, można wyrazić następująco:
![]()
(3)
Wyprowadzenie równania (2):
[MbO2 ]= K ∙ [Mb] ∙ pO2
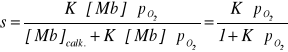
Teraz rozpatrzmy równowagę pomiędzy Hb i O2 :
Hb(aq) + O2 (g) ↔ HbO2 (aq) ![]()
HbO2 (aq) + O2 (g) ↔ Hb(O2)2 (aq) ![]()
Hb(O2)2 (aq) + O2 (g) ↔ Hb(O2)3 (aq) ![]()
Hb(O2)3 (aq) + O2 (g) ↔ Hb(O2)4 (aq) ![]()
Ażeby wyprowadzić wyrażenie na [Hb(O2)2] wykorzystamy wyrażenia [HbO2] i K2, a następnie wyrażenie [HbO2] przedstawimy za pomocą [Hb] i K1, itd. Otrzymamy w ten sposób następujące wyrażenia:
[HbO2] = K1 p [Hb] Hb(O2)2 = K1K2 p2 [Hb]
Hb(O2)3 = K1K2K3 p3 [Hb] Hb(O2)4 = K1K2K3K4 p4 [Hb]
Całkowita ilość tlenu dołączona do hemoglobiny wynosi:
[O2] związany = [HbO2] + 2 [Hb(O2)2] + 3 [Hb(O2)3] + 4 [Hb(O2)4]
= (1+ 2 K2p + 3 K2K3 p2 + 4 K2K3K4 p3) K1 p [Hb]
przy czym wykorzystuje się fakt, że n O2 cząsteczek jest dołączonych do Hb(O2)n, zatem stężenie O2 w Hb(O2)2 wynosi 2 [Hb(O2)2], itd. Całkowite stężenie hemoglobiny wynosi:
[Hb] całkowite = (1+ K1 p + K1K2 p2 + K1K2K3 p3 + K1K2K3K4 p4) [Hb]
Ponieważ każda cząsteczka Hb ma 4 miejsca, do których może się przyłączyć tlen (O2), zatem ułamek wyniesie:
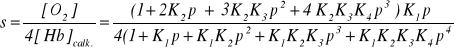
Dane doświadczalne mogą być aproksymowane kiedy przyjmiemy: K1 = 0.01, K2 = 0.02, K3 = 0.04, K4 = 0.08, a ciśnienie zostanie wyrażone w torach.
Wiązania tlenu przez hemoglobinę stanowi przykład „wiązania kooperacyjnego”. Przy tym typie wiązania, wiązanie liganiu, którym jest tlen (O2) do biopolimeru (Hb), jest uprzywilejowane termodynamicznie (K wzrasta) w miarę wzrostu liczby ligandów, do momentu osiągnięcia wartości, która odpowiada maksymalnej liczbie miejsc.
Kooperacyjne wiązanie tlenu przez hemoglobinę może być wyjaśnione przez efekt sferyczny - alotropię sferyczną, w którym to następuje dostosowanie się kształtu molekuły (zmiana kształtu / profilu), do sytuacji, kiedy wiązanie substratu ułatwia wiązanie jego kolejnych cząsteczek.
Różne kształty krzywych nasycenia Mb i Hb powodują w konsekwencji różnicę w dostępności tlenu w organiżmie człowieka. W szczególności bardziej stromy przebieg krzywej Hb, powoduje, że Hb może więcej zebrać tlenu w płucach i go udostępnić(uwolnić) w innych narządach organizmu. W płucach p ≈ 105 torów (14 kPa) i s ≈ 0.98, zatem odpowiada to pełnemu nasyceniu. W tkance mięśni w stanie spoczynku, ciśnienie, p, odpowiada wartości 38 torów (5 kPa), co odpowiada s ≈ 0.75; z tego wynika, ze ilość tlenu jest ciągle wystarczająca. Jeśli lokalne cząstkowe ciśnienie spadnie do 22 torów (3 kPa), s obniża swoją wartość do 0.1.
Należy zauważyć, że najbardziej stroma część krzywej odpowiada cząstkowemu ciśnieniu tlenu w tkance. Mb uwalnia tlen tylko wtedy, kiedy p osiągnie wartość poniżej 22 torów (3 kPa), tak że Mb służy jako zapasowy zbiornik uruchamiany wtedy, kiedy tlen z Hb ulegnie wyczerpaniu.
Zależność s = f (p) jest pokazana na rys. 1.
Rys. 1.
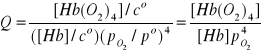
Wyszukiwarka
Podobne podstrony:
Rownowaga chem 1, Farmacja, Chemia Fizyczna, zadania
Cisnienie osmotyczne, Farmacja, Chemia Fizyczna, zadania
Program wykladow 07 - 08, Farmacja, Chemia Fizyczna, zadania
Ekstrakcja 2, Farmacja, Chemia Fizyczna, zadania
Destylacja, Farmacja, Chemia Fizyczna, zadania
tech.chem. PGd chemia fizyczna wyklady, Technologia chemiczna, Chemia fizyczna, Wykłady, wykłady na
ula-chem.bazy, Chemia fizyczna
Aniony I-III(1), Farmacja, Farmacja, - Chemia Fizyczna
chemia fizyczna zadania
chemia fizyczna zadania
chem.fiz.równowagi fazowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
Przykładowe zadania z równowagi chemicznej CD CH 2010 2011, Technologia chemiczna, Chemia fizyczna,
zadania fizyczna ćw. 4, Chemia fizyczna dr Cysewski farmacja CM UMK Bydgoszcz
, chemia fizyczna, Równowagi pH w roztworach buforowych
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
Egzamin - chemia fizyczna (2), Egzamin chem.fiz
laborki 3, Chemia fizyczna dr Cysewski farmacja CM UMK Bydgoszcz
chemia fizyczna laboratoria, iwona chem. fiz. ćw. 91
więcej podobnych podstron