|
INSTYTUT INŻYNIERII ŚRODOWISKA UNIWERSYTET ZIELONOGÓRSKI
|
|
|
CHEMIA OGÓLNA LABORATORIUM
|
|
I ROK INŻYNIERII ŚRODOWISKA STUDIA DZIENNE GRUPA 17 B
|
05.05.2011
|
|
REAKCJE UTLENIANIA I REDUKCJI
TEMAT V
AUTORZY OPRACOWANIA:
Jakub Burdajewicz Marek Stańko
|
||
I CZĘŚĆ TEORETYCZNA
Reakcją utleniania - redukcji - nazywamy proces, w którym następuje wymiana elektronów między substancją redukującą, a substancją utleniającą, na skutek, czego atomy pierwiastków biorących udział w reakcji zmieniają swój stopień utlenienia.
Utlenianie - polega na oddawaniu elektronów przez atomy lub grupy atomów zwane reduktorami. Jest to proces deelektronizacji.
Redukcja - polega na przyjmowaniu elektronów przez atomy lub grupy atomów zwane utleniaczami. Jest to proces elektronizacji.
Ogólny schemat reakcji wygląda następująco:
Red1 + Utl1 = Red2 + Utl2
Przykład bilansu redoks
Reakcja sumaryczna: O2 + C → CO2
Reakcja połówkowa redukcji: O2 + 4e- = 2O-2
Reakcja połówkowa utlenienia: C - 4e- = C+4
Utleniacze - są to atomy, jony lub cząsteczki posiadające zdolność przyjmowania elektronów tzn. odbierania ich od innych atomów lub grup atomów, powodując w ten sposób ich utlenienie. Przykłady utleniaczy: fluor, chlor, brom, tlen.
Do najsilniejszych utleniaczy należą te związki chemiczne, w których pierwiastki występują na maksymalnych stopniach utlenienia.
Przykłady:
nadtlenek wodoru (H2O2),
nadmanganian (VII) potasu (KMnO4),
kwas azotowy (V) (HNO3),
dichromian (VI) potasu (K2Cr2O7).
Reduktory - są to atomy, jony lub cząsteczki posiadające zdolność oddawania elektronów innym atomom, jonom lub cząsteczkom, powodując redukcję tych substancji. Przykłady reduktorów: sód, potas, wodór, węgiel.
Do najsilniejszych reduktorów należą te związki chemiczne, w których pierwiastki występują na minimalnych stopniach utlenienia.
Przykłady:
azotan (III) potasu (KNO2),
tlenek siarki (IV) (SO2),
chlorek cyny (II) (SnCl2).
Stopień utlenienia
Stopniem utlenienia pierwiastka wchodzącego w skład określonej substancji nazywamy liczbę dodatnich lub ujemnych ładunków elementarnych, jakie przypisalibyśmy atomom tego pierwiastka gdyby cząsteczki tej substancji miały budowę jonową.
Przy wyznaczaniu stopni utlenienia pierwiastków obowiązują następujące zasady:
W elektrycznie obojętnej cząsteczce suma stopni utlenienia wszystkich atomów budujących daną cząsteczkę jest zawsze równa zero.
W kationach i w anionach suma stopni utlenienia wszystkich atomów budujących dany jon jest zawsze równa ładunkowi tego jonu.
Pierwiastki w stanie wolnym mają zawsze stopień utlenienia równy zero.
Uwaga! Dotyczy to zarówno jednoatomowych pierwiastków (np. Mg, Na, S), jak i cząsteczek pierwiastków (np. O2, Cl2)
Litowce w związkach chemicznych występują na +I stopniu utlenienia.
Berylowce w związkach chemicznych występują na +II stopniu utlenienia.
Wodór w związkach chemicznych występuje na ogół na +I stopniu utlenienia.
Wyjątek! W wodorkach litowców oraz w wodorkach berylowców wodór występuje na -I stopniu utlenienia.
Fluor we wszystkich związkach chemicznych występuje na -I stopniu utlenienia.
Tlen w związkach chemicznych występuje na ogół na -II stopniu utlenienia.
Uwaga! W nadtlenkach tlen występuje na -I stopniu utlenienia.
W ponadtlenkach tlen występuje na -1/2 stopnia utlenienia.
W fluorku tlenu (OF2) występuje na +II stopniu utlenienia.
II CZĘŚĆ EKSPERYMENTALNA
Doświadczenia wykonywane podczas zajęć obrazowały procesy towarzyszące rekcjom utleniania i redukcji.
Doświadczenie 1.
Do czterech probówek nalano po 1 cm3 HCl. Następnie do każdej wrzucono próbkę innego metalu. Zaobserwowano następujące zjawiska.
Mg + 2HCl = MgCl2 + H2↑
Mg0 - 2e- → Mg+2 ·1 utlenienie
2 Reduktor - Mg
2H+1 + 2·1e- → H20 ·1 redukcja Utleniacz - HCl
Fe + HCl = FeCl2 + H2↑
Fe0 - 2e- → Fe+2 ·1 utlenienie
2 Reduktor - Fe
2H+1 + 2·1e- → H20 ·1 redukcja Utleniacz - HCl
Zn + HCl = ZnCl2 + H2↑
Zn0 - 2e- → Zn+2 ·1 utlenienie
2 Reduktor - Zn
2H+1 + 2·1e- → H20 ·1 redukcja Utleniacz - HCl
Cu + HCl = reakcja nie zachodzi
W probówkach 1, 2 i 3, podczas zachodzących reakcji zauważono wydzielanie się gazu, jakim był wodór.
W przypadku probówki 4 widocznych objawów zachodzenia jakichkolwiek reakcji nie zaobserwowano. Przeprowadzono, więc dodatkowe „badanie”. Metal, który nie zareagował z kwasem solnym wrzucono do probówki ze stężonym kwasem azotowym (V).
Cu + 4HNO3(stęż.) = Cu(NO3)2 + 2NO2 + 2H2O
Cu0 - 2e- → Cu+2 ·1 utlenienie
2 Reduktor - Cu
N+5 + 1e- → N+4 ·2 redukcja Utleniacz - HNO3(stęż.)
W czasie tej reakcji, po ogrzaniu probówki pojawiło się lekkie, zielono - niebieskie zabarwienie, jakie daje azotan (V) miedzi (II).
Doświadczenie 2.
Utworzono trzy zestawy po trzy probówki. Do każdej z dziewięciu probówek wlano taką samą ilość nadmanganianu potasu (kolor malinowy). Następnie do pierwszej probówki z każdego zestawu wlano kwasu siarkowego (VI), do drugiej wodorotlenku sodu, a w trzeciej został sam nadmanganian potasu. Do pierwszego zestawu dodano azotanu (III) sodu, do drugiego bromku potasu, do trzeciego siarczanu (IV) sodu.
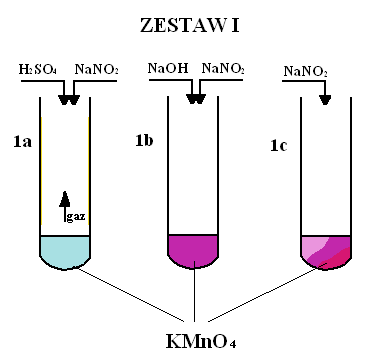
Obserwacje:
1a) Po dodaniu do pierwszej probówki kwasu i soli zaobserwowano zmianę barwy z malinowej na jasnoniebieską.
1b) Po dodaniu do drugiej probówki zasady i soli nie zaobserwowano żadnej zmiany barwy bądź innych objawów reakcji.
1c) Po dodaniu do trzeciej probówki samej soli zaobserwowano zmianę barwy w czasie z malinowej na jasnoróżową, poprzez fioletową, na ciemnoczerwonej skończywszy.
Zachodziły następujące reakcje:
1a) 2KMnO4 + 3H2SO4 + 5NaNO2 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
Mn+7 + 5e- → Mn+2 ·2 redukcja
10
N+3 - 2e- → N+5 ·5 utlenienie
1b) 2KMnO4 + 4NaOH + NaNO2 = 2Na2MnO4 + NaNO3 + 2KOH + H2O
Mn+7 + 1e- → Mn+6 ·2 redukcja
2
N+3 - 2e- → N+5 ·1 utlenienie
1c) 2KMnO4 + H2O + 3NaNO2 = 2MnO2 + 3NaNO3 + 2KOH
Mn+7 + 3e- → Mn+4 ·2 redukcja
6
N+3 - 2e- → N+5 ·3 utlenienie
We wszystkich tych reakcjach utleniaczem był KMnO4, a reduktorem NaNO2.
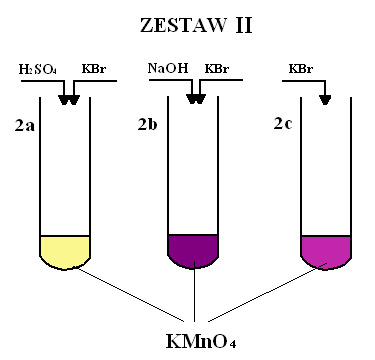
Obserwacje:
2a) Po dodaniu do pierwszej probówki soli i kwasu zaobserwowano zmianę barwy z malinowej na jasnożółtą.
2b) Po dodaniu do drugiej probówki soli i zasady nie zaobserwowano widocznych zmian w barwie roztworu bądź klarowności.
2c) Po dodaniu do trzeciej probówki samej soli zaobserwowano zmianę barwy z malinowej na jasnofioletową.
Zachodziły następujące reakcje:
2a) 2KMnO4 + 8H2SO4 + 10KBr = 2MnSO4 + 6K2SO4 + 5Br2 + 8H2O
Mn+7 + 5e- → Mn+2 ·2 redukcja
5
2·Br- - 2·1e- → Br20 ·5 utlenienie
2b) 6KMnO4 + 5NaOH + 6KBr = 6K2MnO4 + HBrO3 + 5NaBr + 2H2O
Mn+7 + 1e- → Mn+6 ·6 redukcja
6
Br- - 6e- → Br+5 ·1 utlenienie
2c) 2KMnO4 + 6KBr + 4H2O = 2MnO2 + 8KOH + 3Br2
Mn+7 + 3e- → Mn+4 ·2 redukcja
6
2·Br- - 2·1e- → Br20 ·3 utlenienie
We wszystkich tych reakcjach utleniaczem był KMnO4, a reduktorem KBr.
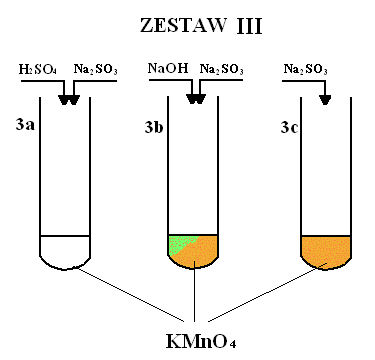
Obserwacje:
3a) Po dodaniu do pierwszej probówki kwasu i soli zaobserwowano odbarwienie malinowego roztworu manganianu potasu.
3b) Po dodaniu do drugiej probówki soli i zasady zaobserwowano, w pierwszej chwili zmianę barwy z malinowej na jasnozieloną, następnie na pomarańczową z ciemnobrązowym osadem.
3c) Po dodaniu do trzeciej probówki samej soli zaobserwowano zmianę barwy z malinowej na pomarańczową z ciemnobrązowym osadem.
Zachodziły następujące reakcje:
3a) 2KMnO4 + 3H2SO4 + 5Na2SO3 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
Mn+7 + 5e- → Mn+2 ·2 redukcja
10
S+4 - 2e- → S+6 ·5 utlenienie
3b) 2KMnO4 + 2NaOH + Na2SO3 = 2Na2MnO4 + K2SO4 + H2O
Mn+7 + 1e- → Mn+6 ·2 redukcja
2
S+4 - 2e- → S+6 ·1 utlenienie
3c) 2KMnO4 + 3Na2SO3 + H2O = 2MnO2 + 2KOH + 3Na2SO4
Mn+7 + 3e- → Mn+4 ·2 redukcja
6
S+4 - 2e- → S+6 ·3 utlenienie
We wszystkich tych reakcjach utleniaczem był KMnO4, a reduktorem Na2SO3.
Doświadczenie 3.
Utworzono dwa zestawy po trzy probówki. W pierwszym zestawie do wszystkich probówek wlano takie same ilości dichromianu potasu (pomarańczowy) i kwasu siarkowego (VI). W drugim zestawie do wszystkich probówek wlano takie same ilości chromianu potasu (żółty) i kwasu siarkowego (VI). Następnie do pierwszej probówki w każdym zestawie wlano azotanu (III) sodu, do drugiej siarczanu (IV) sodu, a do trzeciej bromku potasu.
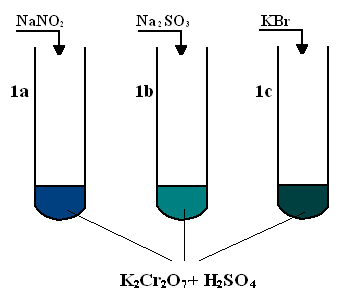
Obserwacje:
1a) Po dodaniu do pierwszej probówki soli azotanowej zaobserwowano zmianę barwy z pomarańczowej na ciemnoniebieską.
1b) Po dodaniu do drugiej probówki soli siarczynowej zaobserwowano zmianę barwy z pomarańczowej na jasną butelkową zieleń.
1c) Po dodaniu do trzeciej probówki soli bromkowej zaobserwowano zmianę barwy z pomarańczowej na butelkową zieleń.
Zachodziły następujące reakcje:
1a) K2Cr2O7 + 4H2SO4 + 3NaNO2 = Cr2(SO4)3 + 3NaNO3 + K2SO4 + 4H2O
Cr+6 + 3e- → Cr+3 ·2 redukcja
6
N+3 - 2e- → N+5 ·3 utlenienie
1b) K2Cr2O7 + 4H2SO4 + 3Na2SO3 = Cr2(SO4)3 + 3Na2SO4 + K2SO4 + 4H2O
Cr+6 + 3e- → Cr+3 ·2 redukcja
6
S+4 - 2e- → S+6 ·3 utlenienie
1c) K2Cr2O7 + 7H2SO4 + 6KBr = Cr2(SO4)3 + 3Br2 + 4K2SO4 + 7H2O
Cr+6 + 3e- → Cr+3 ·2 redukcja
6
2·Br- - 2·e- → Br20 ·3 utlenienie
We wszystkich reakcjach K2Cr2O7 stanowił rolę utleniacza, a sole były reduktorami.
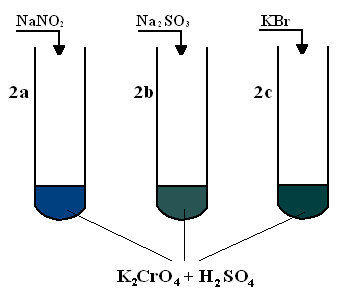
Obserwacje:
2a) Po dodaniu do pierwszej probówki soli azotanowej zaobserwowano zmianę barwy z żółtej na ciemnoniebieską.
2b) Po dodaniu do drugiej probówki soli siarczynowej zaobserwowano zmianę barwy z żółtej na jasną butelkową zieleń.
2c) Po dodaniu do trzeciej probówki soli bromkowej zaobserwowano zmianę barwy z żółtej na ciemną butelkową zieleń.
Zachodziły następujące reakcje:
1a) 2K2CrO4 + 5H2SO4 + 3NaNO2 = Cr2(SO4)3 + 3NaNO3 + 2K2SO4 + 5H2O
Cr+6 + 3e- → Cr+3 ·2 redukcja
6
N+3 - 2e- → N+5 ·3 utlenienie
1b) 2K2CrO4 + 5H2SO4 + 3Na2SO3 = Cr2(SO4)3 + 3Na2SO4 + 2K2SO4 + 5H2O
Cr+6 + 3e- → Cr+3 ·2 redukcja
6
S+4 - 2e- → S+6 ·3 utlenienie
1c) 2K2CrO4 + 8H2SO4 + 6KBr = Cr2(SO4)3 + 3Br2 + 5K2SO4 + 8H2O
Cr+6 + 3e- → Cr+3 ·2 redukcja
6
2·Br- - 2·e- → Br20 ·3 utlenienie
We wszystkich tych reakcjach K2CrO4 stanowił rolę utleniacza, a sole były reduktorami.
III PODSUMOWANIE I WNIOSKI
1a) Z kwasami beztlenowymi nie reagują pierwiastki, które w szeregu napięciowym znajdują się pod wodorem - mają mniejszą elektroujemność.
1b) W odpowiednich warunkach nawet kwas beztlenowy może stać się utleniaczem i doprowadzić do zajścia reakcji redoks.
2a) Manganian potasu jest najsilniejszym utleniaczem, ale w zależności od środowiska otrzymujemy różne produkty końcowe:
W środowisku kwaśnym ulega redukcji do bezbarwnego lub bladoróżowego roztworu manganu(II):
MnO4- + 8H+ + 5e- → Mn2- + 4H2O
W środowisku słabo zasadowym i neutralnym redukuje się do tlenku manganu(IV), który wydziela się z roztworu w postaci brązowego osadu:
MnO4- + 2H2O + 3e- → MnO2 + 4OH-
W środowisku silnie zasadowym redukuje się do zielonego manganianu(VI):
MnO4- + e- → MnO42-
2b) Sole azotanowe (III), siarczynowe (IV) i bromkowe w reakcjach z manganianem potasu mogą zachowywać się jak reduktory.
3a) Chromiany i doi chromiany mają silne właściwości utleniające; reakcje najczęściej zachodzą w środowisku kwaśnym, przy czym obserwujemy zmianę barwy z żółtej bądź pomarańczowej na zieloną (różne jej odcienie w zależności od reagujących związków).
Podsumowując reakcje redoks zależą głównie od biorących w nich udział związków. Najsilniejsze utleniacze to nadmanganian potasu, chromian potasu i dichromian potasu, chociaż mogą być nimi również związki beztlenowe. Przeprowadzenie reakcji redoks pomaga w uzgodnieniu najtrudniejszych reakcji.
IV LITERATURA
A.Bielański: ,,Podstawy chemii nieorganicznej ”, Wyd. III, PWN Warszawa 1997.
Hermann Tadeusz W. „Chemia fizyczna .Podręcznik dla studentów farmacji i analityki medycznej”, Wydawnictwo Lekarskie PZWL 2007
L. Jones, P. Atkins, ,,Chemia ogólna”, PWN Warszawa 2004
Wyszukiwarka
Podobne podstrony:
Laboratorium 4 Reakcje utleniania i redukcji, Studia - Inżynieria materiałowa, Chemia ogólna i nieor
06 Sprawozdanie z reakcji utleniania i redukcji Naprawiony
Ćw. 10 i 11 - reakcje utleniania i redukcji - sprawko, Chemia ogólna i nieorganiczna
Cw10 Reakcje utleniania i redukcji, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia
instrukcja - REAKCJE UTLENIANIA I REDUKCJI, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, l
Wyklad 4. Reakcje utleniajaco-redukcyjne, pwr biotechnologia(I stopień), I semestr, Chemia ogó
Stała szybkości reakcji jodowania acetonu, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Walkowiak, Chemia ogólna, Reakcje utleniająco redukcyjne
Wykład 4. Reakcje utleniajaco-redukcyjne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Kinetyka reakcji elektroutlenienia 1-propanolu, studia, chemia, chemia fizyczna, sprawozdania, spraw
W15S-Reakcje utlenienia-redukcji, chemia, szkolka
Chemia - Reakcje utleniania i redukcji, Reakcje utleniania i redukcji to są reakcje, w których pierw
W15 reakcje utlenienia redukcji
5 Reakcje utleniania i redukcji Reakcje w roztworach
CHEM OG, cw 4, REAKCJE UTLENIANIA I REDUKCJI
3.Reakcje utleniania i redukcji, Notatki AWF, Biochemia
3.Reakcje utleniania i redukcji, Zad
Reakcje utleniania i redukcji
więcej podobnych podstron