Aminokwasy, białka i peptydy w kosmetyce
AMINOKWASY
Aminokwasy - organiczne związki chemiczne zawierające zasadową grupę aminową -NH2 oraz kwasową grupę karboksylową -COOH lub - w ujęciu ogólniejszym - dowolną grupę kwasową, np. sulfonową -SO3H. Aminokwasy są tzw. solami wewnętrznymi (amfolitami).
AMINOKWASY BIAŁKOWE
Aminokwasy jak już było wspomniane są podstawowymi elementami budowy białek. Białka wszystkich gatunków są zbudowane z 20 standardowych aminokwasów, które należą do szeregu L.
Aminokwasy wchodzące w skład białek często nazywane są aminokwasami białkowymi. Możemy je podzielić na pierwszo-, drugo- i trzeciorzędowe. Podział ten jednak jest związany z procesem biosyntezy białek, nie zaś z rzędowością grup aminowych. Wszystkie aminokwasy białkowe należą do grupy α - aminokwasów, co oznacza że obie grupy funkcyjne tj. grupa aminowa i karboksylowa przyłączone są do tego samego atomu węgla, oznaczanego często Cα. Aminokwasy białkowe za wyjątkiem glicyny należą zgodnie z projekcją Fischera do szeregu konfiguracyjnego L.
Np. L-alanina
Popularne aminokwasy:
L-Alanina
L-Walina
L-Leucyna
L-Seryna
L-Cysteina
L-kwas asparginowy
L-Asparagina
Związki na rysunku (po kolei,
od lewej do prawej): walina, alanina,
prolina, tyrozyna, tryptofan, cysteina.
Właściwości fizyczne aminokwasów:
Krystaliczne, bezbarwne, rozpuszczalne w rozpuszczalnikach polarnych (woda, alkohol), a nie rozpuszczalne w niepolarnych.
Właściwości chemiczne:
Obecność grup o charakterze zasadowym i kwasowym w jednej cząsteczce powoduje, że aminokwasy zachowują się jak związki amfoteryczne. Czyli są
w stanie reagować zarówno z kwasem jak i z zasadą .
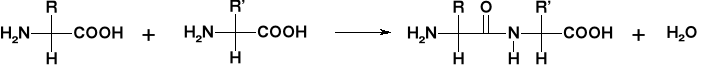
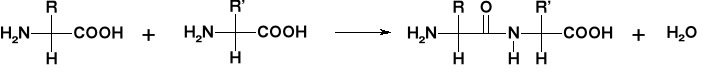
Jedną z najważniejszych reakcji jest kondensacja która prowadzi do powstawania peptydów a następnie do powstawanie super struktur jakimi są białka.
Kondensacja dwóch aminokwasów daje nam związek o nazwie
dipeptydu. Wiązanie pomiędzy sąsiednimi aminokwasami nosi nazwę wiązania peptydowego. Reakcja kondensacji zachodzi między grupą karboksylową i aminową dwóch aminokwasów.
Wiązanie peptydowe można zhydrolizować zarówno w warunkach kwasowych, zasadowych jak i w obojętnych z użyciem odpowiednich enzymów. W wyniku hydrolizy zostaną odtworzone pojedyncze aminokwasy
Reakcja cyklokondensacji- zachodzi miedzy grupą minową i karboksylową tego samego aminokwasu-wewnątrzcząsteczkowa reakcja kondensacji. Np. kwas 4-aminomasłowy pod wpływem temperatury kondensuje się do laktanu. Pierścienie laktanowe są elementami składowymi penicyliny.
Aminokwasy ulegają reakcji dezaminacji (pozbawienie cząsteczki grupy aminowej): hydrolitycznej, redukcyjnej, bezpośredniej.
Punkt izoelektryczny-takie pH środowiska, w którym cząsteczka aminokwasu w danych warunkach jest obojętna. W tym punkcie cząsteczka nie może „wędrować” w polu elektrycznym.
Punkt izojonowy- takie pH środowiska, w którym liczba protonów związanych z grupą -NH2jest równa liczbie protonów odczepionych przez grupy -COOH.
Podział aminokwasów:
a) ze względu na ilość grup karboksylowych i aminowych:
obojętne (1 grupa -NH2 i 1 grupa -COOH)
kwaśne (więcej grup -COOH niż -NH2)
zasadowe (więcej grup -NH2 niż -COOH)
obojętne z układem cyklicznym
b) ze względu na polarność grup -R w sąsiedztwie węgla alfa:
polarne (np. arginina, cysteina, glicyna)
niepolarne (alanina, leucyna)
c) egzogenne i endogenne
egzogenne (nie syntetyzowane w ludzkim organizmie, ale niezbędne do jego funkcjonowania)
endogenne (organizm sam je syntetyzuje, np. glicyna, cysteina)
d) glikogenie (ich metabolizm prowadzi do powstania glukozy -alanina, kwas asparginowy)
ketogenne (ich metabolizm prowadzi do powstania związków ketonowych)
AMINOKWASY W KOSMETYCE:
-nawilżają skórę, są składnikiem NMF (naturalnego czynnika nawilżającego) występującego w warstwie rogowej, którego zawartość wywiera wpływ na wygląd i elastyczność skóry
-stosowane w odżywkach do włosów
-mają zdolności do neutralizowania ładunków elektrycznych na włosach
-mają zdolność pobudzania fibroblastów (elastyny, kolagenu)- oligopeptydy
-nadają jędrność skóry- oligopeptydy
-spłycają drobne zmarszczki
BIAŁKA
Białka to naturalne polipeptydy czyli polimeryczne związki zbudowane głównie z aminokwasów połączonych ze sobą wiązaniami peptydowymi.
Synteza białek odbywa się w rybosomach. Główne pierwiastki białek: C, H, O, N a także S i P oraz niektóre jony metali (Mn2+, Zn2+, Mg2+, Fe2+, Cu2+, Co2+). Większość białek ma naturę koloidalną. Białka są wrażliwe na czynniki fizyczne tj. temperatura, stężone roztwory kwasów i zasad oraz soli metali ciężkich. Ulegają procesowi denaturacji (utrata nieodwracalna struktury białka) oraz koagulacji (utrata odwracalna struktury białka).
Wiązanie pomiędzy dwoma aminokwasami (wiązanie peptydowe)
jest wiązaniem pomiędzy węglem grupy karboksylowej poprzedniego
aminokwasu i azotem grupy alfa-aminowej drugiego aminokwasu.
Wiązanie pomiędzy węglem i azotem ma charakter wiązania częściowo
podwójnego. Obrót wokół tego wiązania nie jest swobodny.
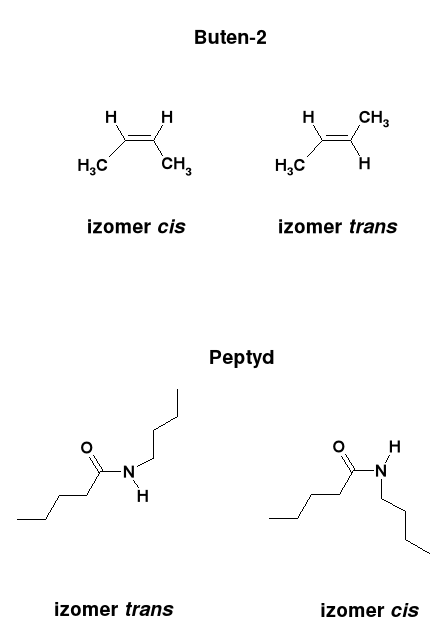
Gdy obrót wokół wiązania nie jest swobodny (np. wiązanie podwójne C=C), to może wystąpić izomeria geometryczna typu cis - trans:
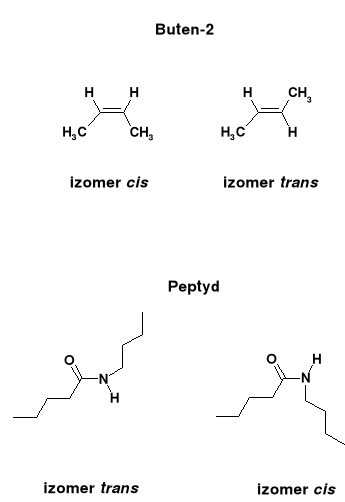
Wiązania peptydowe w polipeptydach są płaskie i zawsze typu trans.
Białka:
-biorą udział lub są podłożem różnych procesów fizjologicznych
-są nośnikami i magazynami różnych substancji
-biorą udział w utlenianiu tkankowym, krzepnięciu krwi, procesach odpornościowych
-uczestniczą w procesach widzenia, przewodnictwie bodźców nerwowych, skurczu mięśni, dostarczaniu energii, regulacji procesów metabolicznych oraz regulacji ciśnienia…
Itd. Itp.
Białka ze względu na skład dzielimy na :
-Białka proste (proteiny) zbudowane są wyłącznie z aminokwasów.
-Białka złożone (dawniej - proteidy)
Podział białek ze względu funkcję:
wytwarzanie i przekazywanie impulsów nerwowych
bufory
kontrola wzrostu i różnicowania
Podział białek ze względu na budowę strukturalną:
-fibrylarne (alfa-keratyna, beta-keratyna)
-globularne : proste i skoniungowane
Białka dzielimy również ze względu na właściwości odżywcze - wyróżnia się białka doborowe i niedoborowe.
Ze względu na skalę przestrzenną pełną strukturę białka można opisać na czterech poziomach:
cukrów w glikoproteidach
lipidów w lipoproteidach
kwasów nukleinowych w nukleoproteidach
barwników w chromoproteidach
resztę kwasu fosforowego w fosfoproteidach.
Zastosowanie białek w kosmetyce:
-kolagen, elastyna, keratyna, białka mleka, jedwabiu
-niektóre proteiny roślinne (pszenica, kukurydza, soja, migdały)
-nawilżają, tworzą film ochronny
-wchłaniają i zatrzymują wodę
-przede wszystkim zastosowanie mają produkty częściowej lub całkowitej hydrolizy białek naturalnych. Układy te, w zależności od stopnia hydrolizy, różnią się między sobą zdolnością wchłaniania i zatrzymywania wody, własnościami filmotwórczymi i powinowactwem do keratyny naskórka, warunkującymi trwałość powstającego filmu.
KERATYNA- stosowana w: szampony, płyny kondycjonujące, środki do trwałej ondulacji, farby do włosów (subst. Ochronna)
KOLAGEN- zawiera glicynę i prolinę, hydroksyprolinę i hydroksylizynę; idealnie wiąże wodę, stosowany w kremach, odżywkach do włosów, kremach przeciwzmarszczkowych, filmotwórczych. Formy kolagenu: naturalny , kolagen bez telopeptydów (lek stosowany doustnie), kolagen nierozpuszczalny (stosowany w kompresach chirurgicznych oraz rozpuszczalnych niciach chirurgicznych).
ŻELATYNA- otrzymywana w procesie denaturacji kolagenu na gorąco w środowisku kwaśnym i zasadowym. Rzadko stosowana w obawie przed chorobą prionową.
ELASTYNA- nadaje skórze elastyczności, do celów kosmetycznych otrzymywana po odtłuszczeniu z aort lub więzadeł bydlęcych, używa się tylko hydrolizatów elastyny, stosowana często w kremach przeciwzmarszczkowych.
ALBUMINA-białko globularne, wygładza zmarszczki i regeneruje, ściąga skórę. Występuje głównie w białku kurzego jaja.
JEDWAB I MLEKO- białka „obce, zewnętrzne” dla ciała ludzkiego. Jedwab wygładza i nawilża. Mleko zawiera niezbędne nienasycone kwasy tłuszczowe (NNKT)-> witamina F.
FIBROINA I SERYCYNA-białka fibrylarne z jedwabiu naturalnego, nawilżają i chronią, tworzą film nieokluzyjny.
KAZEINA- białko globularne występujące w mleku, otrzymywane podczas strącania enzymów lub kwasów z mleka. Ma charakterystyczny zapach, nawilża skórę, regeneruje włosy, przeciwzmarszczkowy.
Białka z pszenicy i kukurydzy- zeina
Białka z soi- aminokina stymuluje produkcję kolagenu
Proteoglikany- składają się z białka nośnikowego, na którym są umocowane glikozaminoglikany (GAG).
Wyszukiwarka
Podobne podstrony:
Zagadnienia na egzamin Chemia Kosmetyczna Semestr II
Zagadnienia egzaminacyjne TUK Chemia kosmetyczna, Kosmetologia
Egzamin Chemia kosmetyczna
Przykładowe egzaminy, Studia - Chemia kosmetyczna UŁ, I rok, II semestr, MATEMATYKA wykłady
pracownia z chemii !!!!, kosmetologia, chemia kosmetyczna, przykladowe pytania i odpowiedzi na egzam
GLAUKONIT I TALK, chemia kosmetyczna
pytania leki, Płyta farmacja Poznań, III rok, Chemia leków, egzamin
Moc borowin, Studium kosmetyczne, Chemia kosmetyczna
Identyfikacja składników kosmetyków., Referaty, Chemia kosmetyczna
CHEMIA KOSMETYCZNA Chemia nieorganiczna (tlenki, kwasy, sole
Chemia nieorganiczna egzamin
Shop for chemia kosmetyczna ksi
Chemia wody egzamin
Chemia pytania egzaminacyjne
chemia 28.10.2007, Chemia kosmetyczna
ETAP PRAKTYCZNY PIELEGNACJA STÓP, kosmetyka egzamin praktyczny-projekty
Egzotyczne oleje w kosmetykach, Studium kosmetyczne, Chemia kosmetyczna
więcej podobnych podstron