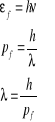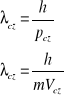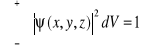Falowe właściwości cząstek
Fizyk francuski Louis de Broglie sformułował w 1924 r. hipotezę:
Jeśli światło, które traktujemy jako falę wykazuje cechy korpuskularne (ma naturę dualną) to również cząstki (np. elektrony) powinny wykazywać właściwości falowe. Zatem ruch cząstki możną opisać w języku falowym. Fale odpowiadające cząstkom są to tzw. fale materii (fale de Broglie'a).
W 1929 r. de Broglie otrzymał nagrodę Nobla.
Hipoteza fal materii
foton
|
|
cząstka |
|
wnioskując z analogi |
|
Elektron przyśpieszony w polu elektrycznym przy napięciu U uzyskuje energię kinetyczna ![]()
, stad ![]()
Zatem 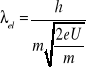
; ![]()
Jeśli U = 100 V to ![]()
Kwantowanie orbit zgodnie z hipoteza de Broglie'a
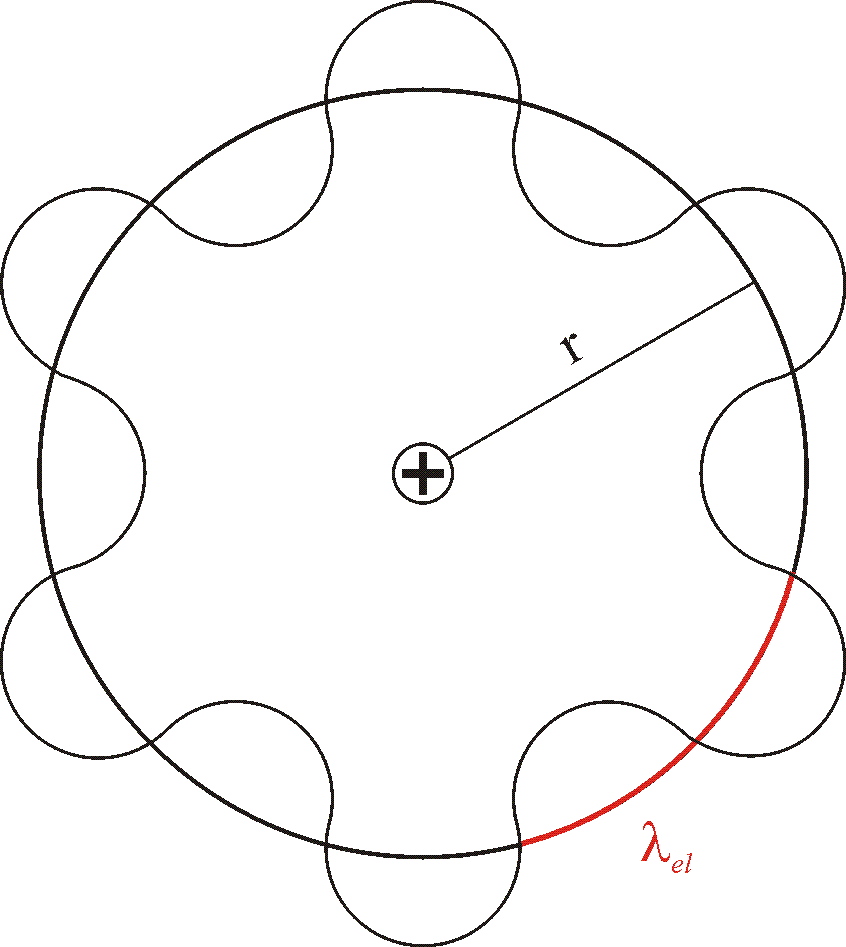
λel - długość fali de Broglie'a związanej z elektronem
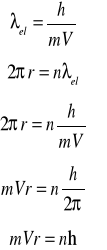
Otrzymujemy warunek kwantowy Bohra
Warunek kwantowy Bohra zawiera treść falową:
na obwodzie bohrowskiej orbity mieścić się musi całkowita liczba długości fali związanej z elektronem.
Najprostszym sposobem pogodzenia obrazu korpuskularnego z falowym jest przyjęcie interpretacji statystycznej:
natężenie fali związanej z cząstką w jakimś punkcie daje prawdopodobieństwo znalezienia cząstki w tym punkcie.
Fale de Broglie'a nazywamy falami prawdopodobieństwa.
Odpowiednikiem doświadczenia Younga byłoby, w przypadku fal materii, następujące doświadczenie.
P - w tym punkcie jest maksymalne prawdopodobieństwo dotarcia elektronu
P2 - w tym punkcie prawdopodobieństwo dotarcia elektronu jest równe zero
|
Rysunek przedstawia formowanie się obrazu interferencyjnego w doświadczeniu A. Lorii. Na ekran kierował on strumień kilku elektronów na sekundę. Po dostatecznie długim czasie uwidacznia się interferencyjna struktura obrazu. |
Rząd wielkości λel jest taki, jak długość fali promieniowania X, zatem falowe właściwości elektronów można doświadczanie zbadać tak samo, jak zbadano falową naturę promieniowania X.
Należy wiązkę elektronów skierować na kryształ. Doświadczenie taki przeprowadzili Clinton Davisson i Lester Germer (fizycy amerykańscy) i niezależnie fizyk angielski George Thomson oraz fizyk polski Szczepan Szczeniawski.
Doświadczenie Davissona-Germera (1927 r.)
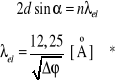
Otrzymana z równania Bragga długość fali okazała się równa długości fali obliczonej ze wzoru *.
Fala płaska de Broglie'a nie nadaje się do opisu ruchu cząstki, bo nie jest zlokalizowana przestrzennie. Taką lokalizację przestrzenną posiada paczka falowa.
E. Schrödinger wprowadził założenie, że cząstkom można przypisać fale ograniczone w przestrzeni (paczki falowe). Paczkę falową można złożyć z widma ciągłego fal, w pewnym przedziale częstości.
![]()
|
Superpozycja dwóch fal harmonicznych o mało różniących się częstotliwościach (dudnienia). |
|
|
|
Superpozycja n fal harmonicznych
Paczka falowa Prędkość grupowa ma sens fizyczny prędkości ruchu cząstki. |
Erwin Schrödinger korzystając z analogii klasycznych, zapisał równanie, pozwalające znaleźć funkcję falową ψ opisującą cząstkę w określonym stanie oraz energię ε cząstki w tym stanie.
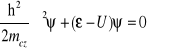
równanie Schrödingera
gdzie:
ε - energia całkowita cząstki
U - energia potencjalna
![]()
Max Born zaproponował związanie amplitudy fali de Broglie'a w każdym punkcie przestrzeni z prawdopodobieństwem znalezienia cząstki w otoczeniu tego punktu.
Prawdopodobieństwo znalezienia cząstki w elemencie objętości dV otaczającym punkt jest równe kwadratowi modułu funkcji falowej opisującej cząstkę pomnożonemu przez ten element objętości:
![]()
gdzie:
ψ - funkcja falowa ψ(x,y,z,t)
![]()
Kwadrat modułu amplitudy fali de Broglie'a w danym punkcie jest miarą prawdopodobieństwa znalezienia się cząstki w tym punkcie.
Rozumowanie prowadzące do równania Schrödingera
Równanie fali rozchodzącej się w kierunku osi x zapisujemy:
![]()
Przyjmując t jako parametr obliczmy pochodną cząstkową
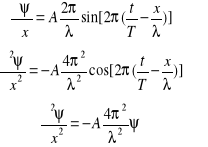
Stąd
![]()
Dla cząstki energia mechaniczna
![]()
gdzie ![]()
(ze wzoru na długość fali de Broglie'a)
Zatem:
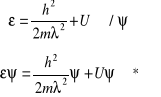
ale ![]()
. Wstawiamy do wzoru *
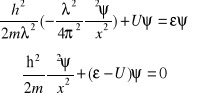
Równanie opisuje dualną naturę cząstek:
m - masa, jest atrybutem cząstki materialnej
ψ - funkcja falowa
|
gęstość prawdopodobieństwa znalezienia cząstki w punkcie o współrzędnych (x,y,z) |
|
prawdopodobieństwo znalezienia cząstki w obszarze dV |
|
pewność znalezienia cząstki |
Zasada nieoznaczoności Wernera Heisenberga
Zasada nieoznaczoności Heisenberga jest konsekwencją falowego opisu ruchu mikrocząstek, z wykorzystaniem pojęcia paczki falowej.
Z teorii ruchu falowego wynika, że rozciągłość Δx pewnego ciągu fal jest związana z faktem, iż musi on zawierać fale o liczbach falowych z przedziału Δk (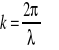
).
Wykazano, że miedzy Δx i Δk istnieje związek:
Δx * Δk ≥ 1
ale liczba falowa 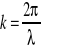
, zaś 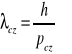
, stąd 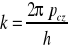
oraz ... (?)
Możemy więc zapisać:
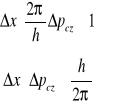
![]()
zasada nieoznaczoności
Heisenberga
Iloczyn nieoznaczoności współrzędnej położenia cząstki w kierunku danej osi (Δx) i nieoznaczoności rzutu pędu cząstki na daną oś układu współrzędnych (Δpx) nie może być mniejszy od 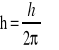
.
Przykłady:
Prędkość o masie 0,1 g określona jest z dokładnością
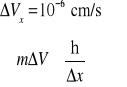
stąd można obliczyć ![]()
(niemierzalne)
Nieoznaczoność położenia elektronu w atomie w najgorszym przypadku równa rozmiarom atomu (10-10 m). Wówczas nieoznaczoność prędkości Vx ≈ 106 m/s. Tego rzędu ...
nieoznaczoność energii
t - nieoznaczoność czasu
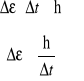
W stanie podstawowym atomu t = ∞ ; = 0
W stanie wzbudzonym 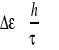
; - czas życia w stanie zbudzonym 10-8 s
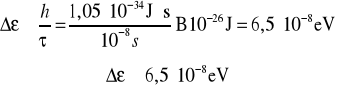
![]()
Wyemitowany kwant energii przy przejściu atomu ze stanu wzbudzonego do stanu podstawowego równa się:
![]()
![]()
Energia wypromieniowanego fotonu nie jest dokładnie równa - 0. Nieoznaczoność energii wynosi .
Falowe właściwości cząstek • Fizyka 2002 - 2003 |
8
|
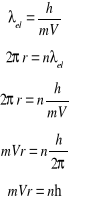
Wyszukiwarka
Podobne podstrony:
Urządzenia 1 - podstawowe właściwości łuku(1), Politechnika Lubelska, Studia, Studia, sem VI, z kser
Badanie właściwości ferroelektrycznych, Politechnika Lubelska, Studia, Studia, sem IV
Urządzenia 1 - podstawowe właściwości łuku, Politechnika Lubelska, Studia, Studia, sem VI, z ksero n
21 Falowe właściwości cząstek
Wyznaczanie skręcalności właściwej roztworów - MICHAŁEK, Politechnika Lubelska, Studia, Studia, sem
protokół Badanie podstawowych właściwości materiałów i przyrządów, Politechnika Lubelska, Studia, St
21 Spis Narzędzi, Politechnika Lubelska, Studia, Studia, organizacja produkcji, laborki-moje, techno
Mikromaszyny 21 protokół, Politechnika Lubelska, Studia, semestr 5, Sem V, Nowy folder
PKM, Politechnika Lubelska, Studia, Studia, organizacja produkcji, laborki-moje, od majka, SPRAWOZDA
Drgania Ćwiczenie nr 13, Politechnika Lubelska, Studia, semestr 5, Sem V, Sprawozdania, Laborka, Lab
2.3, Politechnika Lubelska, Studia, Studia, organizacja produkcji, laborki-moje, laborki-mojeókrzste
Str.4 - Karta technologicza zbiorcza, Politechnika Lubelska, Studia, Studia, organizacja produkcji,
więcej podobnych podstron