Aldehydy
Aldehydy (podobnie ketony) należą do grupy związków zawierających grupę karbonylową C=O, która w znacznym stopniu wpływa na właściwości chemiczne związków tej grupy. Zarówno aldehydy jak i ketony są produktami utlenienia alkoholi. Aldehydy powstają przez utlenienie alkoholi I-rzędowych, ketony to wynik utlenienia alkoholi II-rzędowych. Obecność wodoru tuż obok grupy karbonylowej w aldehydach powoduje, że utleniają się one dość łatwo dalej do kwasów karboksylowych, zaś pozbawione wodoru ketony utleniają się znacznie trudniej.
Nazwy aldehydów tworzymy przez dodanie do nazwy głównego łańcucha struktury końcówki -al lub tworząc nazwę na podobieństwo nazwy odpowiedniego kwasu, zastępując słowo kwas słowem aldehyd. Niektóre aldehydy maja nazwy zwyczajowe, będące dość powszechnie w użyciu. W uproszczonych, schematycznych wzorach strukturalnych grupę aldehydową zapisujemy jako -CHO:
Utlenianie alkoholi I-rzędowych np. przez łagodne ogrzewanie z dichromianem potasowym K2Cr2O7 w kwasie siarkowym. Ponieważ otrzymany aldehyd łatwo ulega dalszemu utlenieniu do kwasu karboksylowego, należy go jak najszybciej usunąć ze środowiska reakcji (np. przez oddestylowanie).
Teoretycznie aldehydy można również otrzymać przez redukcje odpowiedniego kwasu karboksylowego. W praktyce stosujemy redukcję odpowiednich chlorków kwasowych (tak alifatycznych jak i aromatycznych):
Aldehydy aromatyczne (pochodne benzenu) otrzymujemy także przez utlenianie odpowiednich metylowych pochodnych.
Ze względu na polaryzacje wiązania C=O węgiel karbonylowy w aldehydach wykazuje pewien niedobór elektronów (przyjmuje częściowy ładunek dodatni) zaś atom tlenu charakteryzuje częściowy ładunek ujemny. Reakcje aldehydów to zatem głównie reakcje addycji nukleofilowej - reagent zawierający ładunek ujemny (np. pochodne amoniaku) atakuje dodatnio naładowany węgiel karbonylu. W aldehydach arylowych, ze wzglądu na tworzenie się struktur rezonansowych, w których ładunek dodatni przenosi się z węgla aldehydowego na pierścień, reakcje te przebiegają trudniej niż w aldehydach alifatycznych:
Najbardziej charakterystyczne reakcje addycji nukleofilowej to:
— reakcje z kwasem cyjanowodorowym, w wyniku której otrzymujemy cyjanohydrynę, którą można przeprowadzić poprzez hydrolizę grupy nitrylowej CN w a-hydroksykwas:
— reakcje z bezwodnym alkoholem prowadzące do otrzymania acetali. Aldehyd zmieszany z bezwodnym alkoholem tworzy nietrwały związek o charakterze zarówno alkoholu jak i eteru, zwany hemiacetalem. W obecności kwasu hemiacetal reaguje dalej z alkoholem dając trwały związek zwany acetalem:
Acetale, będąc "podwójnymi" eterami mają właściwości zbliżone do eterów, i tak jak etery ulegają rozpadowi pod wpływem kwasów (patrz). W odróżnieniu jednak od prostych eterów reakcja ta zachodzi wyjątkowo łatwo, już pod wpływem rozcieńczonych kwasów w temperaturze pokojowej
— reakcje addycji nukleofilowej. Związki karbonylowe (aldehydy i ketony) ulegają dość łatwo reakcji addycji nukleofilowej z pochodnymi amoniaku. Produkty addycji są nietrwałe, łatwo tracą cząsteczkę wody dając trwałe pochodne. Produkty takiej reakcji często służą do identyfikacji wyjściowych związków karbonylowych.
Reakcja przebiega według mechanizmu:
Najczęściej stosowane reagenty nukleofilne to hydroksylamina, hydrazyna, fenylohydrazyna i semikarbazyd:
Reakcje redoksowe, w których jedna cząsteczka związku zachowuje się jak utleniacz a druga cząsteczka tego samego związku jak reduktor, nazywamy reakcjami dysproporcjonowania. Aldehydy, będące pośrednim etapem utlenienia węgla alkoholu mogą zarówno ulegać dalszemu utlenieniu do kwasu jak i redukcji do alkoholu. Reakcja, w której jedna cząsteczka aldehydu utlenia drugą cząsteczkę aldehydu do kwasu, sama redukując się do alkoholu, nosi nazwę reakcji Cannizzaro. Reakcje takie przebiegają w przypadku aldehydów nie zawierających wodoru w pozycji a, pod wpływem silnie zasadowego środowiska:
Mieszanina dwóch różnych aldehydów także może podlegać reakcji Cannizzaro, dając w efekcie mieszaninę wszelkich możliwych kwasów i alkoholi. Natomiast reakcja Cannizzaro w mieszaninach zawierających aldehyd mrówkowy (HCHO) przebiega prawie jednokierunkowo, dając w efekcie kwasu mrówkowy (HCOOH) i odpowiedni alkohol.
Jeżeli aldehyd (lub keton) zawiera wodór w pozycji a, to nie ulega reakcji Cannizzaro, natomiast ulega reakcji zwanej kondensacją aldolową. Reakcja ta zachodzi w środowisku słabo alkalicznym lub słabo kwaśnym i polega na połączeniu dwóch cząsteczek aldehydu w cząsteczkę aldolu (aldehydoalkohol) czyli b-hydroksyaldehydu.
Reakcja kondensacji aldolowej może zachodzić także "krzyżowo" pomiędzy dwiema cząsteczkami różnych aldehydów (ketonów). Podobnie jak w reakcji Cannizzaro, w przypadku reakcji aldolowej w mieszaninie aldehydów otrzymujemy mieszaninę wszystkich możliwych produktów.
Aldole ulegają bardzo łatwo reakcji dehydratacji (odwodnienia) dając w efekcie nienasycone aldehydy z wiązaniem podwójnym między atomem a i b.
Kondensację aldolową wykorzystuje się między innymi do syntezy alkoholi. Łącząc odpowiednie aldehydy (lub ketony) w zaplanowany aldol i uwodorniając ten ostatni, redukujemy zarówno wiązanie podwójne jak i karbonyl, otrzymując nasycony alkohol. Jest to bardzo skuteczna metoda otrzymywania alkoholi o bardziej skomplikowanej strukturze.
Aldehydy są zazwyczaj cieczami, słabo rozpuszczalnymi w wodzie. Wyjątkami są dwa pierwsze aldehydy - mrówkowy, który jest gazem (t.wrz. -21°C) i octowy, będący bardzo lotną cieczą (t.wrz. 20°C), oba dobrze rozpuszczalne w wodzie. Aldehyd mrówkowy w postaci 40% wodnego roztworu nosi nazwę formaliny, często stosowanej do konserwacji preparatów biologicznych. Aldehydy mrówkowy występują także w postaci polimerycznej (paraformaldehyd - —(C2OCH2O)n— ), zaś zarówno mrówkowy jak i octowy tworzą także trimery: trioksan w przypadku formaldehydu i paraldehyd w przypadku aldehydu octowego. Obie te postacie są ciałami stałymi:
Związki karbonylowe zmieszane ze stężonym, wodnym roztworem wodorosiarczynu sodowego (wodorosiarczanu(IV) - NaHSO3), dają produkt addycji, będący krystalicznym ciałem stałym, słabo rozpuszczalnym w wodzie. Stosując tę reakcje, możemy oddzielić związek karbonylowy od innych składników roztworu (poprzez odsączenie krystalicznego osadu), a następnie w miarę potrzeby odtworzyć związek karbonylowy przez potraktowanie osadu kwasem lub zasadą.
Do wykrywania aldehydów (patrz cukry) służą przede wszystkim reakcje utleniania - szczególnie bardzo charakterystyczna reakcja lustra srebrowego z odczynnikiem Tollensa i reakcja z odczynnikiem Fehlinga
(CuII —> CuI).
Bardzo czułą reakcją dowodzącą obecności aldehydów jest reakcja z odczynnikiem Schiffa - kwasem fuksynosiarkowym(IV). W obecności grupy aldehydowej powstaje charakterystyczne zabarwienie
czerwono - fioletowe
Kwasy karboksylowe
Kwas karboksylowy w postaci zjonizowanej |
Kwas karboksylowy w postaci elektrycznie obojętnej |
Atom wodoru w grupie karboksylowej może się łatwo odszczepiać w formie jonu wodorkowego, co zgodnie z teorią Arrheniusa nadaje tym związkom charakter kwasowy. Kwasy karboksylowe tworzą chętnie wiązania wodorowe z grupami nukleofilowymi - aminową, hydroksylową i innymi.
Kwasy karboksylowe z krótkimi grupami alifatycznymi są dobrze rozpuszczającymi się w wodzie cieczami o ostrym, nieprzyjemnym zapachu i toksycznych własnościach. Wraz ze wzrostem długości grupy alifatycznej wzrasta temperatura topnienia tych kwasów. Kwasy karboksylowe o długich (powyżej 10 atomów węgla) grupach alitatycznych nazywają się kwasami tłuszczowym i są ciałami stałymi w temp. pokojowej.
Otrzymywanie
Charakterystyczne reakcje
Kwasy karboksylowe ulegają takim samym reakcjom jak zwykłe kwasy nieorganiczne. Tworzą one sole z zasadami nieorganicznymi. Reagują również z alkoholami tworząc estry. Estry kwasów tłuszczowych z gliceryną nazywane są tłuszczami.
Tworzenie chlorków kwasowych
W wyniku reakcji z trichlorkiem fosforu (PCl3) lub chlorkiem tionylu (SOCl2) przechodzą w chlorki kwasowe:
Odwadnianie
Inną charakterystyczną reakcją dla kwasów karboksylowych jest reakcja odwadniania w wyniku której powstaje bezwodnik kwasowy:
Redukcja do alkoholi
Pod wpływem tetrahydroglinianu litu kwasy karboksylowe redukują się do odpowiednich alkoholi. W pierwszym etapie tej reakcji tworzy się kompleksowa sól kwasu karboksylowego:
W dalszych etapach następują kolejne przeniesienia anionów wodorkowych od glinu do atomu węgla grupy karboksylowej, przy czym anion karboksylanowy redukuje się najpierw do aldehydu, a następnie do alkoholanu:
Otrzymany alkoholan poddaje się następnie hydrolizie w celu wydzielenia wolnego alkoholu:
Fenole
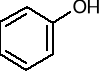
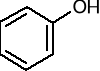
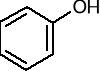
Fenole - związki, w których grupa hydroksylowa jest bezpośrednio połączona z pierścieniem aromatycznym - ArOH
Nazewnictwo:
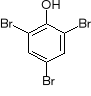
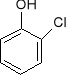
nazwy systematyczne dla fenoli tworzy się dodając przedrostek hydroksy do nazwy węglowodoru, np.
![]()
![]()
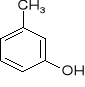
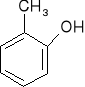
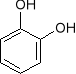
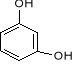
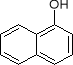
Dla niektórych fenoli zachowano nazwy zwyczajowe:
![]()
![]()
Właściwości fizyczne:
Fenole to przeważnie ciecze lub ciała stałe o niskich temperaturach wrzenia lub topnienia w porównaniu do alkoholi o porównywalnej masie cząsteczkowej. Słabo rozpuszczają się w wodzie. Są substancjami bezbarwnymi. Między cząsteczkami fenoli, podobnie jak w alkoholach, powstaje wiązanie wodorowe.
Fenol - substancja stała, krystaliczna, o charakterystycznym zapachu, słabo rozpuszczalna w zimnej wodzie, zaś dobrze w ciepłej; działa bakteriobójczo
Otrzymywanie fenoli:
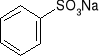
-poprzez stapianie sulfonianów z alkaliami:
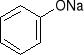
+ NaOH NaHSO3 +
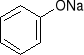
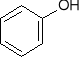
+ HCl NaCl +
-z aromatycznych halogenopochodnych poprzez stapianie z NaOH - reakcja zachodzi w bardzo drastycznych warunkach (temp 360C, ciśnienie 300 atm)
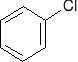
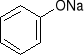
+ NaOH H2O HCl +
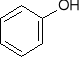
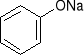
+ HCl NaCl +
Właściwości chemiczne:
-fenole wykazują bardziej kwasowe właściwości niż alkohole
-wodny roztwór fenolu wykazuje odczyn słabo kwaśny i nosi nazwę kwasu karbolowego
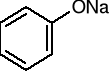
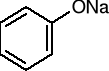
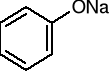
-fenole reagują z roztworami wodorotlenków dając sole zwane fenolanami (pod wpływem kwasów nieorganicznych fenolany przekształcają się z powrotem w odpowiednie fenole - patrz otrzymywanie)
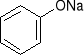
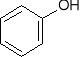
+ NaOH H2O +
-w przeciwieństwie do alkoholi fenole reagują bezpośrednio z diazometanem z wytworzeniem eterów metylowo-arylowych (reakcja alkilowania)
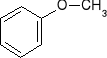
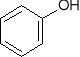
+ CH2N2 N2 +
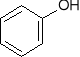
-reagują z chlorkami kwasowymi , a produktami są estry (reakcja acylowania)
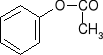
+
CH3 - CO - Cl HCl +
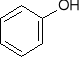
-ulegają reakcji substytucji elektrofilowej (np. bromowania lub nitrowania)
+ Br2 + HBr
+ H2O
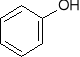
+ HNO3(rozcieńczony)
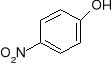
+ H2O
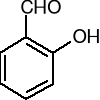
- Fenol reaguje z chloroformem dając aldehyd salicylowy (substytucja)
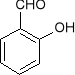
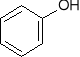
+ CHCl3
redukuje się do benzenu w reakcji z płynem cynkowym
fenole dają charakterystyczne zabarwienie roztworu FeCl3, który barwi się pod wpływem fenolu na fioletowo
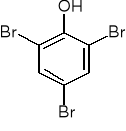
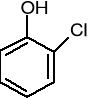
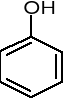
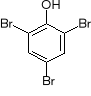
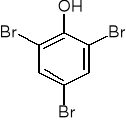
2,4,6-tribromohydroksybenzen
(2,4,6-tribromofenol)
o-chlorohydroksybenzen
(o-chlorofenol)
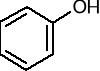
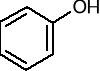
hydroksybenzen (fenol)
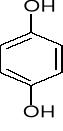
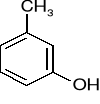
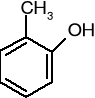
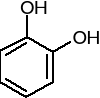
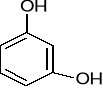
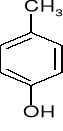
m-krezol
o-krezol
p-krezol
rezorcyna
pirokatechina
hydrochinon
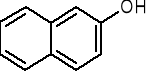
β-naftol
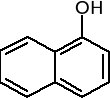
α-naftol
300 C
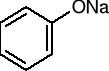
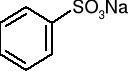
sulfonian sodu
fenolan sodu
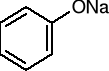
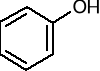
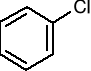
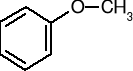
metoksybenzen
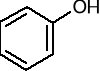
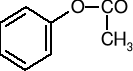
octan fenylu
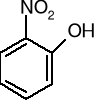
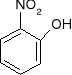
o-nitrofenol
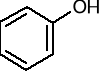
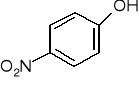
p-nitrofenol
NaOH
Wyszukiwarka
Podobne podstrony:
Fiz 10 P, Studia, Ogólne, Fiyzka, od romka, studia materiały, Fizyka lab, Termopary
semestr 1, Studia, Ogólne, Fiyzka, od romka, studia materiały, chemia
twardośc wody sciaga, Studia, Ogólne, Fiyzka, od romka, studia materiały, chemia
Ekstrakcja, Studia, Ogólne, Fiyzka, od romka, studia materiały, chemia
Składamy saczek, Studia, Ogólne, Fiyzka, od romka, studia materiały, chemia
C1, Studia, Ogólne, Fiyzka, od romka, studia materiały, chemia
Analiza miareczkowa jest metodą ilościowego oznaczania substancji, Studia, Ogólne, Fiyzka, od romka,
Fiz 10 P, Studia, Ogólne, Fiyzka, od romka, studia materiały, Fizyka lab, Termopary
test metale tabela, Studia, Ogólne, Fiyzka, od romka, fizyka, sprawozdania fizyka
cwicz8, Studia, Ogólne, Fiyzka, od romka
F 40 KONTAKTOWA R NICA POT, Studia, Ogólne, Fiyzka, od romka, Fizyka lab
Mikroskop2, Studia, Ogólne, Fiyzka, od romka, fizykaa, fizyka, fizyka
F 0X T, Studia, Ogólne, Fiyzka, od romka, Fizyka lab
F 55, Studia, Ogólne, Fiyzka, od romka, Fizyka lab
F 12, Studia, Ogólne, Fiyzka, od romka, Fizyka lab
F 44 WNIOSKI, Studia, Ogólne, Fiyzka, od romka, Fizyka lab
więcej podobnych podstron