PRZEMIANY FIZYCZNE I CHEMICZNE
Przemiana fizyczna - nie następuje zmiana materii
Przemiana chemiczna - następuje zmiana struktury elektronowej atomów lub cząsteczek i wynikająca stąd reorganizacja wiązań chemicznych, w wyniku czego z określonych substratów powstają charakterystyczne dla danego typu reakcji produkty
Reakcja - proces wyniku którego z substratów powstają produkty
Rodzaje podziałów:
Ze względu na podział reakcji
Reakcja syntezy. Wszystkie substancje łączą się i tworzą jeden produkt ![]()
; reakcja polimeryzacji z wielu cząstek jednej substancji powstaje polimer ![]()
Reakcja analizy. Reakcja rozkładu, jedna cząsteczka substratu rozkłada się na czynniki proste; dysocjacja termiczna ![]()
, fotoliza, radioliza
Reakcja wymiany. Reakcja wymiany może być pojedyncza ![]()
lub podwójna ![]()
Ze względu na efekt energetyczny
Reakcja egzotermiczna. Jeżeli energia układu w stanie końcowym jest mniejsza niż w początkowym, czyli układ wydziela ciepło do otoczenia ![]()
Reakcja endotermiczna. Jeżeli układ by zaszła reakcja musi zwiększyć swoją energię, czyli pobrać ciepło
Wymiana elektronów między reagentami
Utlenianie. Proces związany z utratą elektronów, czyli ze wzrostem ładunku dodatniego![]()
;![]()
Redukcja. Proces związany z pobraniem elektronów, czyli ze zmniejszeniem ładunku dodatniego
![]()
;![]()
;![]()
Ze względu na fazowość (3 stany skupienia; 2 ciecze, 2 ciała stałe itp.)
Umowna odwracalność reakcji
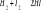
BUDOWA ATOMU
Materia ma budowę ziarnistą, nieciągłą gdyż dowolnie mała przestrzeń pomyślana w jej wnętrzu nie jest nią całkowicie wypełniona.
Atom- najmniejsza jednostka budowy pierwiastka chemicznego, ale już - bez naruszenia zasadniczych właściwości pierwiastka, zbudowany z jądra, w którego niezwykle małej objętości skupiona jest niemal cała masa atomu oraz elektronów znajdujących się w stosunkowo dużej przestrzeni otaczającej jądro, tworzących wokół jądra chmurę elektronową. Promienie jąder są rzędu ![]()
do ![]()
, a promienie atomów są rzędu ![]()
do ![]()
. Jądro składa się z Z protonów (Z- l. atomową) i N neutronów-l. nukleonów odpowiada względnej masie atomowej M- liczbą masową,
Nukleony - wspólna nazwa dla neutronów i protonów
Elektron cząstka o ładunku ujemnym o wartości ![]()
, tzn. -1, masa ![]()
Proton cząstka o ładunku dodatnim ![]()
, tzn. +1, masa ![]()
Neutron elektrycznie obojętna, masa ![]()
Fermiony - cząstki lub układy cząstek o spinie równym wielokrotności 1/2, ħ, (ħ = h/2π h — stała Plancka)
Neutrino - powstają podczas rozpadu jądra
Nuklidy - to zbiór atomów o tej samej wartości liczby atomowej i masowej(o tej samie liczbie nukleonów w jądrze)
Izotopy - jądra które należą do tego samego pierwiastka, czyli mają taka sama liczba atomową, a różnią się liczba masowa
Izobary - jądra o tej samej liczbie masowej
Izomery - jądra o tym samym składzie, a różniące się energia
Zakaz kwantowy - każdy elektron w atomie w stanie niepobudzonym ma tylko taką energię która da się zapisać za pomocą 4 liczb kwantowych
Zakaz Pauliego - dwa elektrony mogą zajmować ten sam orbital tylko wówczas, gdy ich spiny są przeciwne tj. zorientowane w przeciwnych kierunkach
Reguła Hunda - najkorzystniejsze energetycznie jest takie zapełnienie orbitali elektronami, przy którym liczba elektronów ze spinami swobodnymi tzn. elektronów nie sparowanych w obrębie danej wartości pobocznej liczby kwantowej l, jest jak największa
Rodzaje liczb kwantowych:
Główna liczba kwantowa - oznacza się za pomocą litery n, i może przyjmować wartość całkowitych liczb dodatnich 1,2,3,4… określa powłokę elektronową do której należy elektron oraz określa energią powłoki elektronowej, jak również związaną jest ściśle z długością wielkiej osi elipsy.
Poboczna (dodatkowa, orbitalna, azymutalna) liczba kwantowa - oznacza się literą l i może przyjmować n wartości 0,1,2,…,n-1 (stosuje się również oznaczenia literowe s,p,d,f…). Charakteryzuje podpowłokę do której należy elektron oraz uściśla wartość energii elektronu, a także określa małą os elipsy i kształt orbity
Magnetyczna liczba kwantowa - oznacza się literą m, może przyjmować wartość
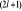
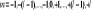
Określa niewielkie różnice energetyczne pomiędzy elektronami o tej samie liczbie kwantowej n i l oraz wzajemne ustawienie się orbitali w przestrzeni pod wpływem zewnętrznego pola magnetycznego. Przy braku zew. pola magnetycznego orbitale nie mają określonego kierunku w przestrzeni i nie różnią się energią, są zatem zdegenerowane.
Degeneracja orbitali - ozn. istnienie dwóch lub więcej stanów o tej samej energii. Stany p są trzykrotne, stany d pięciokrotnie, a stany f siedmiokrotnie zdegenerowane.
Rozmieszczenie elektronów (konfiguracja elektronowa) - kolejność rozmieszczania elektronów na powłokach i podpowłokach w atomie jest uwarunkowana energią przypisaną dla określonych poziomów oraz zakazem Pauliego. Pierwsze w kolejności obsadzane są poziomy o najniższej energii. Według zapisu mnemotechnicznego.
HYBRYDYZACJA
Hybrydyzacja - proces wymieszanie się orbitali. Hybrydyzacja może obejmować dwa albo większą liczbę orbitali s,p lub d. Z zastrzeżeniem jednak, że poziomy energetyczne orbitali wyjściowych nie mogą znacznie różnić się pomiędzy sobą.
Orbitale zhybrydyzowane - powstałe orbitale podczas hybrydyzacji
Typy hybrydyzacji:
Hybrydyzacja typu sp - kształtem przypomina orbital p lecz z jednej strony orbital jest tęższy, a z drugiej szczuplejszy. Osie orbitali tworzą kąt 180o np. cząsteczka
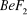
Hybrydyzacja typu sp2 - cząstka taka ma orbital, których osie tworzą między sobą kat 120o ma zatem postać trójkąta równobocznego i płaska np.
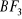
Hybrydyzacja typu sp3 - osie orbitali skierowane są od środka czworościanu foremnego ku jego narożom i tworzą kąty 109o28'
Hybrydyzacja typu sp3dn - np. cząsteczka
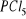
o hybrydyzacji sp3d ma konfigurację bipiramidy trygonalnej. Powstaje pięć orbitali o równej wartości energetycznej, z który trzy leżą na płaszczyźnie atomu centralnego kąt 120o a dwa są prostopadłe do tej płaszczyzny
WIĄZANIA ATOMOWE
Wiązanie jonowe (elektrowalencyjne) - wiązania jonowe występują w układach złożonych z atomów skrajnie różniących się elektroujemnością.. Podczas powstawania wiązania jonowego atom pierwiastka elektrododatniego oddaje, a atom pierwiastka elektroujemnego przyłącza elektrony. Tworzą się dwa jony o różnoimiennych ładunkach, przyciągające się dzięki działaniu sił elektrostatycznych np.
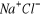
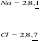

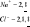
Konfiguracja oktetowa zostaje uzyskana przez przesunięcie elektronu od mniej do bardziej elektroujemnego atomu. Siły działające w wiązaniach jonowych są znaczne dlatego temp. topnienia i wrzenia tych związków jest stosunkowo duża. Wiążąca para elektronowa całkowici przesunięta jest do atomu bardziej elektroujemnego.
Wiązania jonowe tworzą:
a)pierwiastki gr. 1 i 2 oprócz H i Be z pierwiastkami gr. 16 i 17;
b) większość soli między metalem a resztą kwasową.
Wiązania atomowe (kowalencyjne) - wiązania kowalencyjne powstają, gdy łączą się z sobą pierwiastki elektroujemne o takich samych wartościach elektroujemności. Przykładem może być cząsteczka wodoru. Dwa atomy wodoru tworzą cząsteczkę, ich elektrony rozmieszczają się symetrycznie wokół obydwu jąder, tworząc parę elektronową. Każdy atom wykorzystuje wspólnie dwa elektrony i z tego powodu cząsteczka wodoru jest uboższa energetycznie niż dwa oddzielne atomy, a konfiguracja staje się podobna do konfiguracji helu. Podobnie powstają cząsteczki chloru bromu i innych, temp. topnienia i wrzenia związków z wiązaniem atomowym jest stosunkowo duża. Wiążąca para elektronowa znajduje się w jednakowej odległości od jąder atomów tworzących wiązanie.
Wolne elektrony - pary elektronów walencyjnych nie biorące udziału w wiązaniu
Atom może utworzyć tle wiązań ile ma niesmarowanych elektronów
Wiązania atomowe (niespolaryzowane) tworzą:
- H, N, O, F, Cl, Br, I; oraz w związkach atomy różnych pierwiastków o równych elektroujemnościach.
Wiązania atomowe (kowalencyjne) spolaryzowane - wiązanie atomowe spolaryzowane jest wiązaniem pośrednim między jonowym a atomowym; powstaje wówczas, gdy łączą się ze sobą atomy pierwiastków różniących się elektroujemnością, lecz nie tak znacznie jak w przypadku wiązania jonowego. Cechą charakterystyczną tego wiązania jest przesunięcie pary elektronowej wiążącej atomy w kierunku atomu pierwiastka bardziej elektroujemnego. Cząsteczki z wiązaniami kowalencyjnymi spolaryzowanymi z powodu nierównomiernego, niesymetrycznego w stosunku do środka cząsteczki, rozmieszczeniu ładunków wykazuje biegunowość. W cząsteczkach tych można wyróżnić biegun dodatni i ujemny. Przykładem może być kw. solny. Wspólna para elektronowa w cząsteczce

jest silniej przyciągana przez atom chloru niż przez atom wodoru, jest wiec przesunięta w kierunku atomu chloru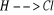
Dipol - cząsteczka o budowie polarnej tzn. cząsteczka dwubiegunowa
Moment dipolowy - posiada go cząsteczka dwubiegunowa ![]()
; gdzie q - ładunek, l - odległość pomiędzy środkami ciężkości odmiennych ładunków
Wiązania atomowe spolaryzowane tworzą:
-pierwiastki różniące się elektroujemnością nieznacznie; wyjątkiem jest H i F (różnica elektroujemności wynosi 1,9).
Wiązania koordynacyjne - wiązania koordynacyjne tym różnią się od wiązania atomowego lub atomowego spolaryzowanego, że para elektronowa tworząca wiązanie oddawana jest przez jeden atom z dwóch łączących się atomów. Przykładem jest tworzenie się jonu amonowego
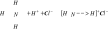
Azot w cząsteczce amoniaku mający wolną parę elektronową przyłącza (dokoordynowuje) do niej jon wodorowy. Sposób powst. tego wiązania jest inny niż trzech pozostałych wiązań między atomami wodoru z azotem, w który każdy atom wodoru oddaje do wiązania jeden własny elektron. Po utworzeniu jednak wiązania koordynacyjnego wszystkie cztery atomy wodoru w jonie amonowym stają się równocenne.
Związki koordynacyjne (zw. kompleksowe, kompleksy) - połączenia w których występują wiązania koordynacyjne
Ligandy - cząsteczki koordynowane np. NH3,H2O,CO,jony CL-,OH-
Akceptor - przyjmuje pary elektronowe np. BF3, jony metali Ag+,Cu2+
Liczba koordynacyjna akceptora - liczba par elektronowych przyjętych przez akceptor podczas tworzenia kompleksu, zwykle wynosi 2,4,6,8
Wiązania niezlokalizowane - w cz. związków o izolowanych wiązaniach wielokrotnych elektrony są zlokalizowane w określonej przestrzeni pomiędzy dwoma atomami węgla. W cz. o dłuższych łańcuchach węglowych, zawierających układ sprzężonych wiązań podwójnych, np. C=C-C=C-C=C- elektrony mogą przesuwać się wzdłuż łańcucha co prowadzi do wyrównania gęstości elektronowej w całym łańcuchu. Następuje tutaj delokalizacja elektronów. Przykładem może być cząsteczka butadienu
Delokalizację zaznacza isę w pierścieniu benzenowym za pomocą kółka.Wiązanie metaliczne - pojęcie stosowane jest dla scharakteryzowania wiązania chemicznego istniejącego pomiędzy atomami metalu w stanie stałym kiedy mamy do czynienia z tzw. Siecią metaliczną. Tworzy s i to wiązanie pod wpływem elektrycznego przyciągania między jądrami atomowymi i swobodnie poruszającymi się elektronami pochodzącymi z zewnętrznych powłok elektronowych atomów. Wytwarza się układ, w którym dodatnio naładowane jony metali zwane zrębami atomowymi otoczone są swobodnie przesuwającymi się elektronami, nazwanych gazem elektronowym. Przykładem jest sieć krystaliczna metalicznego litu w której każdy atom litu otoczony jest przez osiem innych atomów tego samego pierwiastka co oznacza, że na jeden elektron walencyjny atomu litu przypada osiem atomów sąsiednich.
Wiązania van der Waalsa (międzycząsteczkowe) - są wynikiem wzajemnego oddziaływania elektronów i jąder w cząsteczkach, polegają one na przyciąganiu się szybkozmiennych albo inaczej falujących dipoli. W wyniku ruchu elektronów walencyjnych gęstość ładunku ujemnego na zewnętrznej powłoce atomów ulega szybkim fluktuacjom wzbudzając podobną fluktuację w powłoce walencyjnej sąsiednich atomów. Powstają szybko zmienne dipole, które wzajemnie przyciągają się zwiększając, w miarę zbliżania się, wzajemną polaryzację elektronową. Siły van der Waalsa są stosunkowo małe w przypadku małych cząsteczek, ale przypadku dużych cząsteczek mogą nawet przewyższać siły wiązania chemicznego np., w smarach
Siły indukcji - działaja między jonem lub dipolem trwałym a dipolem indukowanym
Wiązania wodorowe - tworzy się pomiędzy atomem wodoru związanym z atomem o dużej elektroujemności, a atomem z wolnymi parami elektronowymi. Można je uważać za szczególny przypadek wiązań dipolowych lub jako wiązanie typu pośredniego między jonowym a atomowym albo jako wiązanie jonowe silnie spolaryzowane. Ma charakter kierunkowy.
HYDRATACJA
Reakcja chemiczna danej substancji z rozpuszczalnikiem, zwana solwatacją, polegającej na rozerwaniu (zniszczeniu) wiązań istniejących pomiędzy cząsteczkami lub atomami substancji rozpuszczonej i izolowaniu ich od siebie przez cząsteczki rozpuszczalnika. Reakcja solwatacji w przypadku wody jako rozpuszczalnika nosi nazwę reakcji hydratacji i polega na tym, że cząsteczki wody będące dipolami otaczają cząsteczkę rozpuszczonego związku.
STRUKTURY KRYSZTAŁÓW
1. Struktura regularna ( fluoryt, granit, piryt)
a = b= c
α = β = γ = 90º
2. Struktura tetragonalna (cyrkon)
a = b ≠ c
α = β = γ = 90º
3. Struktura rombowa (topaz)
a ≠ b ≠ c
α = β = γ = 90º
4. Struktura heksagonalna (korund)
a = b ≠ c
α = β = 90º γ = 120º
5. Struktura romboedryczna (turmalin)
a = b = c
α = β = γ ≠ 90º
6. Struktura jednoskośna ( kuncyt)
a ≠ b ≠ c
α = γ = 90º ≠ β
7. Struktura trójskośna (amazonit)
a ≠ b ≠ c
α ≠ γ ≠ β
DYSOCJACJA ELEKTROLITYCZNA
Elektrolity - substancje, które po stopieniu lub w roztworze rozpadają się na jony i w tym stanie przewodzą prąd elektryczny.
Dysocjacja elektrolityczna - pr. rozpadu substancji podczas rozpuszczania w wodzie na jony, jony naładowane dodatnie to kationy, a ujemnie to aniony.
Elektrolity - są to substancje których roztwory wodne przewodzą prąd elektryczny
Nieelektrolity - są to substancje których roztwory wodne praktycznie nie przewodzą prądu elektrycznego
Stopień dysocjacji elektrolitu - określa się stosunkiem liczby moli cząsteczek zdysocjowanych na jony do liczby moli cząsteczek substancji rozpuszczonej ![]()
gdzie x-liczba moli cząsteczek zdysocjowanych na jony, n-liczba moli cząsteczek substancji rozpuszczonej
Elektrolity mocne - są to takie związki które w niezbyt stężonym roztworze wodnym są całkowicie zdysocjowane na jony (stopień dysocjacji równy jest jedności) Należą do nich wszystkie sole, niektóre kwasy i zasady (H2SO4, HNO3, HCl, NaOH, KOH)
Elektrolity słabe - związki, które w roztworze wodnym tylko częściowo dysocjują, np. kwasy CH3COOH, H2CO3, H2S, H3BO3, zasady NH4OH, C6H5NH2, C2H5N
Stała dysocjacji - jest to stała równowagi odwracalnego procesu dysocjacji elektrolitów słabych.![]()
; ![]()
Ta wartość liczbowa K jest charakterystyczna dla danego elektrolitu, określa ilościowo jego moc.
DYSOCJACJA WODY, pH ROZTWORU
Dysocjacja wody można zapisać ![]()
Stała równowagi tej przemiany wyraża się ![]()
można przyjąć ![]()
wielkość Kw nazywamy iloczynem jonowym wody, a ponieważ [H3O+]=[H+] to ![]()
Stężenia jonów wodorowych, z jakim się spotykamy w praktyce są małe 10-7 (czysta woda o temp. 25oC), 10-5 M itp. Dla ułatwienia wprowadzono pojęcie wykładnika stężenia jonów wodorowych pH równy ujemnemu logarytmowi stężenia jonów wodorowych ![]()
Ze wzrostem stężenia jonów wodorowych w roztworze wartość pH maleje. Roztwory kwaśne pH<7, roztwory zasadowe pH>7, roztwór obojętny pH=7
HYDROLIZA SOLI
Hydroliza - reakcja substancji z woda
W przypadku soli hydroliza jest procesem odwrotnym do reakcji zobojętniania ![]()
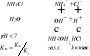

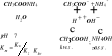
Stopień hydrolizy ![]()
- ułamek każdego mola rozpuszczonej soli, który ulega hydrolizie
Stała hydrolizy - ![]()
ROZTWORY BUFOROWE
Roztwory buforowe to roztwory, których pH nie zmienia się po dodaniu niewielkiej ilości mocnego kwasu lub zasady oraz podczas rozcięczania wodą. Roztwory buforowe składają się zwykle ze słabego kwasu lub zasady oraz ich soli ulegających hydrolizie ![]()
![]()
![]()
stężenia kwasu i soli nie mają wpływu na stężenie [H+]
ELEKRTOLIZA
Elektroliza - przemiany chemiczne zachodzące w przewodniku elektrolitycznym, związane z przepływem prądu i zobojętnianiem jonów na elektrodach
Podczas elektrolizy zachodzi trwały rozkład elektrolitu pod wpływem prądu w odróżnieniu od dysocjacji elektrolitycznej gdzie zachodzi rozpad określany stanem równowagi
Elektroliza stanowi najprostszy i najsilniejszy układ utleniająco-redukcyjny. Reduktorem jest katoda, gdyż dostarcza elektrony kationom, które się redukują. Utleniaczem jest anoda, gdyż odbiera elektrony od anionów, które przez to się utleniają
Jeśli w roztworze lub w stopie elektrolitu zanurzymy dwie płytki z metalu czyli dwie elektrody, które połączone są przewodami z biegunami źródła prądu stałego, to w polu elektrycznym utworzonym w przewodniku elektrolitycznym dodatnio naładowane kationy poruszają się w stronę ujemnie naładowanej elektrody zwanej katodą, a ujemnie naładowane aniony przesuwają się w stronę dodatnio naładowanej elektrody zwanej anodą. Katoda dostarcza elektrony kationom, które elektronizując się (czyli przyłączając elektrony) przechodzą w stan atomowy. Anoda odbiera elektrony od anionów, które przez to się deelektronizują przechodząc również w stan atomowy lub cząsteczkowy
KOROZJA
Korozja - proces niszczenia metali w wyniku reakcji elektrochemicznych i chemicznych zachodzących podczas zetknięcia się metalu z otaczającym je środowiskiem gazowym lub ciekłym. Nazwa korozja używana jest również do określenia przyczyn i skutków zjawiska niszczenia.
Podział ze względu na przyczynę:
Elektrochemiczna - korozja elektrochemiczna jest wynikiem działania lokalnych ogniw galwanicznych tworzących się na powierzchni metalu. W każdym przypadku istotnym składnikiem jest roztwór elektrolitu. W przypadku korozji atmosferycznej elektrolitem jest skondensowana wilgoć i woda opadowa zawierająca zawsze pewną ilość rozpuszczonych substancji tj. CO2, SO2, NO i inne
Chemiczna - korozja chemiczna polega na bezpośrednim ataku czynnika korozyjnego na metal lub stop. Charakteryzuje się tym, że przez metal podczas reakcji z czynnikiem korozyjnym (utleniaczem) nie przepływa prąd elektryczny. Wymiana elektronów miedzy metalem a utleniaczem przebiega w środowisku nie wykazującym przewodnictwa jonowego. Przykładem może być korozja w gazach w podwyższonej temp, w szczególności tzw. zendrowanie żelaza.
Podział ze względu na skutki zniszczenia
Równomierna - korozja rozprzestrzenia się na całej powierzchni przedmiotu równomiernie. Najmniej niebezpieczna
Miejscowa - zniszczenie obejmuje tylko pewne miejsce powierzchni przedmiotu zaznaczone w postaci plam, punktów i wżerów. Wpływa silnie na zmniejszenie wytrzymałości materiału
Międzykrystaliczna - zniszczenie występuje na granicach ziaren postępując w głąb materiału. Jest to najgroźniejszy rodzaj zniszczenia, powoduje silny spadek wytrzymałości i jest trudna do wykrycia na powierzchni.
Ochrona:
Dobór odpowiedniego metalu
Osłabienie agresywności środowiska, Sposób ten można stosować gdy ilość ośrodka atakującego jest ograniczona
Sposoby ochrony przed korozją:
- pokrywanie niemetalicznymi powłokami ochronnymi,
- produkowanie materiałów ze stopów nierdzewnych,
- dodawanie inhibitorów,
- Ochrona katodowa. Polega na połączeniu chronionej powierzchni (konstrukcji) z metalem mniej szlachetnym, tworzącym anodę (protektor) ogniwa, natomiast katodą jest obiekt chroniony. Połączenie takiej anody z konstrukcją chronioną wykonuje się przez bezpośredni styk (tzw. powłoki anodowe) lub za pomocą przewodnika. Za pomocą protektorów chroni się przed korozją duże obiekty stalowe (np. kadłuby statków, rurociągi i podziemne zbiorniki
KOLOIDY
Koloidy - zole są to układy o dużym stopniu rozdrobnienia 10-9m - 10-7m. Są stanem pośrednim pomiędzy roztworami rzeczywistymi, które są układami fizycznie jednorodnymi o rozdrobnieniu cząstkowym, a zawiesinami i mieszaninami niejednorodnymi. 8 podstawowych ukł. koloidalnych : f. rozpraszająca, oś. dyspersyjny, układ koloidalny: 1. gaz - ciecz - piana 2. gaz - c.stałe - piana st.
3. ciecz - gaz - aerozole 4. ciecz - ceicz - emulsja 5. ciecz - c.stale - piana stała
6. c.stałe - gaz - aerozole(pył, kurz) 7. c.stałe-ciecz-zole 8.c.stałe - c.stałe - zole stałe
Część układu tworzącą fazę ciągłą stanowi ośrodek dyspersyjny (rozpraszający), a drugą stanowi fazę zdyspergowaną (rozproszoną)
Cząstki fazy rozproszonej mogą mieć kształty blaszkowate, nitkowate oraz kuliste.
Podział ukł. koloidalnych ze względu na powinowactwo dwóch faz:
Zole liofilowe - bardzo trwałe ( warstwa solwatacyjna jest miarą trwałości zoli liofilowych Zole liofobowe - nie ma powinowactwa, brak wspólnych cech.
ze względu na wielkość cząsteczek:
Układy monodyspersyjne koloidy w których cząstki fazy rozproszonej mają jednakową wielkość oraz polidyspersyjne - cząstki mają różne wymiary.
Metody otrzymywania koloidów:
*Metoda dyspersyjna - rozdrabnianie aż do uzyskania rozdrobnienia koloidalnego (z zawiesin) osiąga się: Mechanicznie - młyn koloidalny Elektrycznie - łuk elektryczny; stosuje się do otrzymywania zoli metali, tlenków metali itp. Chemicznie - peptyzacja - proces odwrotny do koagulacji stosuję się tu peptyzatory (substancje o silnych właściwościach adsorpcyjnych), które rozdzielają silnie złączone cząstki
*Metody kondensacyjne - rozdrobnienie koloidalne osiąga się w wyniku łączenia pojedynczych cząsteczek chemicznych. Stosując procesy chemiczne:
Polimeryzacja Zmniejszenie rozpuszczalności - wlewanie do wody nasyconego roztworu siarki w alkoholu Redukcja Utlenianie - H2SS koloidalne
Wymiana - AgNO3+KIAgI+KNO3
Koagulacja - proces polegający na łączeniu się cząstek fazy rozproszonej koloidu w większe agregaty tworzące fazę ciagłą o nieregularnej strukturze. Do koagulacji można doprowadzić również przez ogrzewanie, przepływ prądu, zmianę pH lub starzenie się następujące wskutek pozostawienia zolu na długi czas.
WŁAŚCIWOŚCI UKŁADÓW KOLOIDALNYCH:
Ruchy Browna - koloidalne cząsteczki znajdują się w nieustannym chaotycznym ruchu Dyfuzja - ruch cząsteczek substancji pod wpływem różnicy stężeń pomiędzy różnymi częściami roztworu nie ulegają siłom samorzytnej sedymentacji
Rozproszenie światła - efekt Tyndalla ulegają koagulacji
DEFEKTY SIECI KRYSTALICZNYCH:
Defekty struktury krystalicznej są to każdego rodzaju odchylenia od
idealnej struktury. Najczęściej stosowana klasyfikacja dzieli
defekty w zależności od ich charakterystycznego wymiaru na:
Punktowe
Liniowe
Powierzchniowe
defekty punktowe odpowiadają za szybkość dyfuzji atomów w
sieci, Defekty punktowe — to wakanse (luki) i atomy międzywęzłowe
Wakans to brak atomu w węźle sieci krystaliczne Defekty
te powstają w wyniku drgań sieci o amplitudzie wzrastającej z
temperaturą, które powodują wypadanie pewnej liczby atomów ze
swoich położeń równowagi. Tworzy się zawsze para defektów atom
międzywęzłowy (wytrącony) — wakans. Mechanizm powstawania wakansów zależy od miejsca zajmowanego przez atom wytrącony z położenia
równowagi. W modelu Frenkla atom z węzła sieci zajmuje położenie
międzywęzłowe, natomiast w modelu Schottky`ego dokonuje on
wyjścia na swobodną powierzchnię kryształu.
defekty liniowe — za odkształcanie tworzyw metalowych pod
wpływem sił znacznie niższych od powodujących zniszczenie
(dekohezję) materiału, ale także za plastyczność metali, Dyslokacja krawędziowa — zaburzenie struktury kryształu powstające w wskutek utworzenia się dodatkowej półpłaszczyzny (lub wyjęcie takiej półpłaszczyzny), Dyslokacja śrubowa — defekt liniowy struktury krystalicznej spowodowany przemieszczeniem części kryształu wokół osi .
OGNIWA Ogniwo galwaniczne - ogniwo, w którym źródłem prądu są reakcje chemiczne zachodzące między elektrodą a elektrolitem. Dwie elektrody zanurzone w elektrolicie (półogniwa) tworzą ogniwo galwaniczne. Różnica potencjałów elektrod, gdy przez ogniwo nie płynie prąd, jest równa sile elektromotorycznej ogniwa (SEM). Ogniwo Daniella - ogniwo galwaniczne, w którym pierwsze półogniwo stanowi elektroda cynkowa zanurzona w roztworze siarczanu cynku ZnSO4, a drugie elektroda miedziana zanurzona w roztworze siarczanu miedzi CuSO4. W ogniwie tym oba półogniwa nie stykają się ze sobą bezpośrednio lecz są połączone kluczem elektrolitycznym, najczęściej wykonanym z roztworu chlorku potasu (KCl) w agar-agarze. Klucz elektrolityczny uniemożliwia mieszanie się roztworów elektrolitów oraz zapobiega gromadzeniu się nadmiaru ładunku ujemnego bądź dodatniego w zależności czy rozpatrujemy anodę czy katodę.
Klucz elektrolityczny rodzaj półprzepuszczalnej przegrody lub naczynia z elektrolitem spełniający rolę łącznika dwóch półogniw w ogniwie galwanicznym. Klucz elektrolityczny zapewnia przepływ prądu elektrycznego między półogniwami i jednocześnie uniemożliwia mieszanie się elektrolitów wchodzących w skład półogniw.
Półogniwo to struktura zawierająca przewodzącą elektrodę oraz otaczający ją przewodzący elektrolit oddzielony przez naturalnie występującą podwójną warstwę Helmholtza. Reakcja chemiczna wewnątrz tej warstwy chwilowo pompuje ładunek elektryczny pomiędzy elektrodą a elektrolitem, w wyniku czego powstaje napięcie elektryczne pomiędzy nimi.
Podział pół ogniw:
1.ze względu na typ reakcji elektrodowej:
a)metalowe - elektroda bierze udział w reakcji elektrodowej (metaliczna elektroda w roztworze jonów)
b)półogniwo red-oks - elektroda nie bierze udziału w reakcji elektrodowej. Jest to najczęściej układ elektroda metaliczna (platyna lub grafit) zanurzona w roztworze jonów w formie utlenionej i zredukowanej.
2.ze względu na budowę:
a)półogniwa pierwszego rodzaju - metal zanurzony w roztworze jonów.
b)półogniwa drugiego rodzaju - metal pokryty trudno rozpuszczaną solą tego metalu i zanurzony w roztworze elektrolitu z anionem takim, jak w soli.
c)półogniwo gazowe - metal w kontakcie z roztworem zamierającym rozpuszczony gaz i jego jony np. półogniwo wodorowe.
1) związki nieorganiczne |
2. związki organiczne
|
Wyszukiwarka
Podobne podstrony:
ochrona wlasnosci intelektualnej, Inżynieria Środowiska UP Wrocław I semestr, OWI
ergonomiasciaga, Inżynieria Środowiska UP Wrocław I semestr, Ergonomia
ochrona wlasnosci intelektualnej, Inżynieria Środowiska UP Wrocław I semestr, OWI
ściąga test I, Ogrodnictwo UP Wrocław, Semestr IV, Nawożenie
chemia- ściąga I, Inżynieria Środowiska PW semestr I, chemia, sesja
sciaga3, Inżynieria środowiska, I semestr, Biologia i ekologia, materiały na egzamin z biol
biola- sciaga !!!!!!!!!!!, Inżynieria Środowiska Politechnika Śląska Rybnik, Biologia, Semestr II, e
sciaga3, Inżynieria środowiska, I semestr, Biologia i ekologia, materiały na egzamin z biol
wyklady ze statyki sciaga, Inżynieria Środowiska, 5 semestr, Statyka budowli, wykład
hydro sciaga, Inżynieria Środowiska PŚk, Semestr 2, Hydrogeologia 1, wykłady
hydro sciaga, Inżynieria Środowiska PŚk, Semestr 2, Hydrogeologia 1, wykłady
sciaga3, Inżynieria środowiska, I semestr, Biologia i ekologia, materiały na egzamin z biol
Chemiczne środki ochrony roślin, Ogrodnictwo UP Wrocław, semestr V, Ochrona roślin - środki ochrony
napowietrzanie, Inżynieria Środowiska materiały, Studia, SEMESTR V, TECHNOLOGIA ŚCIEKÓW
kibleII-sciaga, Inżynieria środowiska, Inżynieria środowiska 1, Instalacje Sanitarne, Instalacje San
więcej podobnych podstron