Agnieszka Wróbel |
ANALIZA INSTRUMENTALNA |
11.01.2008 r. |
II CD L-8 |
Oznaczanie zawartości żelaza (III) metodą spektrofotometryczną za pomocą kwasu sulfasalicylowego |
ocena: |
I Podstawy teoretyczne:
Spektrofotometria w zakresie nadfioletu (z ang. UV- ultra-violet) i promieniowania widzialnego (ang. Vis-visible), czyli spektrofotometria UV-Vis jest jedną ze starszych metod analizy instrumentalnej. Przedmiotem badań są widma elektronowe. Przejścia elektronów między poszczególnymi stanami energetycznymi określają reguły wyboru:
1* aby nastąpiła absorpcja promieniowania, muszą istnieć takie dwa stany kwantowe, których różnica energii odpowiada energii hν promieniowania padającego
2* absorpcja promieniowania musi być związana ze zmianą momentu dipolowego cząsteczki μ. W sposób ilościowy warunek ten opisuje tzw. moment przejścia między stanami elektronowymi, które określają prawdopodobieństwo absorpcji dopasowanego fotonu.
Przejścia spełniające reguły wyboru są nazywane przejściami dozwolonymi. Miarą intensywności pasma absorpcji jest wartość molowego współczynnika absorpcji εmax przy długości fali w maksimum absorpcji λmax.
Wiązka promieniowania monochromatycznego po przejściu przez jednorodny ośrodek absorbujący o grubości b ulega osłabieniu według równania:
z którego, po przekształceniu otrzymujemy wzór:
gdzie A jest to zdolność pochłaniania promieniowania, czyli absorbancja.
Absorbancja jest proporcjonalna do grubości warstwy absorbującej, jeżeli wiązka promieniowania monochromatycznego przechodzi przez jednorodny ośrodek absorbujący i jest to I prawo absorpcji, natomiast II prawo absorpcji (prawo Lamberta- Beera) dotyczy absorpcji promieniowania przez roztwory: jeżeli współczynnik absorpcji rozpuszczalnika jest równy zeru, to absorbancja wiązki promieniowania monochromatycznego, po przejściu przez jednorodny roztwór, jest wprost proporcjonalna do stężenia roztworu c i do grubości warstwy absorbującej b. Prawo addytywności absorpcji, czyli III prawo absorpcji mówi nam, że absorbancja roztworu wieloskładnikowego równa jest sumie absorbancji poszczególnych składników.
Wykres zależności absorbancji od stężenia jest linią prostą, jeżeli roztwór spełnia II prawo absorbancji.
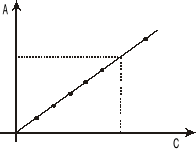
Liniowa zależność absorbancji od stężenia zgodna z prawem Beera zachowana jest jedynie dla niskich stężeń roztworów c<10-2 mol/l. Przy wyższych stężeniach może dojść do odchyleń od tego prawa wywołanych oddziaływaniami między cząsteczkami. Najlepiej jest tak dobierać stężenia badanych roztworów aby wartość absorbancji nie przekraczała 1. W nowoczesnych spektrofotometrach absorbancja może dochodzić nawet do 2,5.
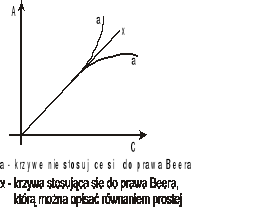
Przyczyną innych odchyleń od tego prawa mogą być również niedoskonałości aparaturowe (zbyt duża szerokość spektralna wiązki światła, zbyt duży poziom światła rozproszonego, niska czułość detektora itp.).
Wartość A jest zależna od długości fali λ promieniowania padającego. Wtedy zależność między A i λ jest określana mianem krzywej absorpcji.
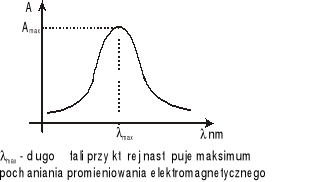
Wybór długości fali, przy której mierzy się absorbancję roztworu, zależy od kształtu widma absorpcji. Długość fali (λmax) odpowiadająca maksymalnej absorbancji (Amax) służy zazwyczaj do wyznaczania krzywej wzorcowej tego roztworu oraz do oznaczania jego stężeń nieznanych. Widmo absorpcji promieniowania danego rodzaju cząsteczek określa się w funkcji długości fali (λ).Kształt widma absorpcji dla danego rodzaju cząsteczek zależy od wielu czynników: stanu skupienia, temperatury, rozpuszczalnika, pH, obecności zanieczyszczeń.
Charakterystykę widma absorpcji stanowi liczba pasm absorpcji (maksimów), długość fali (lub częstotliwość) odpowiadająca maksimum oraz natężenie i kształt pasma absorpcji.
Spektrofotometry UV-Vis to przyrządy do badania absorpcji promieniowania elektromagnetycznego w zakresie nadfioletu i części widzialnej widma. Pierwotnie korzystano z kolorymetrii polegającej na porównywaniu intensywności zabarwienia dwóch roztworów, z których jeden był roztworem wzorcowym, a drugi roztworem badanym. Obecnie stosuje się spektrofotometry, których budowę przedstawia poniższy schemat:
Ze względu na sposób rejestracji spektrofotometry można podzielić na spektrofotometry:
punktowe
samorejestrujące
jednowiązkowe
dwuwiązkowe
klasyczne
z detekcją równoległą.
Ilościowe oznaczanie metodą spektrofotometrii UV-Vis jest metodą porównawczą. Dlatego konieczne jest posługiwanie się wzorcami i krzywymi kalibracyjnymi. Oznaczanie pojedynczego składnika przeprowadza się metodą porównywania z pojedynczym wzorcem (gdzie mierzymy absorbancję roztworu badanego i wzorcowego o znanym stężeniu przy tej samej długości fali i jednakowych kiuwetach), metodą porównywania z kilkoma wzorcami (czyli metodą krzywej wzorcowej) albo metodą dodatku wzorca.
II Wykonanie pomiaru:
1. Schemat aparatury pomiarowej:
Do pomiarów absorpcji światła używamy spektrofotometrów. Typowy aparat składa się z następujących elementów:
1. źródło promieniowania
2. monochromator (przed nim znajduje się regulator natężenia)
3. kiuweta
4. detektor
5. rejestrator/wskaźnik
Spektrofotometr Spekola pozwala na pomiar absorbancji w zakresie 365-750 nm. Źródłem światła jest lampa żarowa, a monochromatorem siatka dyfrakcyjna.
2. Przepis oznaczenia:
a) przygotowanie krzywej wzorcowej:
Podstawowy roztwór żelaza III (1mg Fe/cm3 rru)
Rozpuścić 0.8630g Fe(NH4)(SO4)2
12 H2O w wodzie destylowanej z dodatkiem 0.5 cm3 stężonego kwasu siarkowego i rozcieńczyć wodą w kolbie miarowej o poj. 100 cm3.
Roboczy roztwór żelaza (III)
5 cm3 roztworu podstawowego przenieść ilościowo do kolby miarowej o pojemności 100 cm3 i uzupełnić 0.01n kwasem siarkowym do kreski.
Wzorcowe roztwory żelaza (III)
Do kolbek miarowych o poj. 50 cm3 pobrać ilościowo 5, 7, 9, 11, 15, 20 cm3 roztworu roboczego. Do każdej kolbki dodać po 10 cm3 wody destylowanej, 1 cm3 roztworu kwasu azotowego V (1:1), 1 cm3 2n kwasu siarkowego oraz 10 cm3 5% roztworu kwasu sulfasalicylowego, a następnie uzupełnić wodą destylowaną do kreski. Roztwory dokładnie wymieszać i przygotować roztwór ślepej próby (mieszanina powyższych roztworów nie zawierająca roztworu roboczego).
b) pomiar absorbancji i wykonanie doświadczenia:
Pomiaru absorpcji promieniowania dokonujemy przy λ=510 nm, a każdy pomiar powtarzamy 3 razy. Roztwór otrzymany w kolbie miarowej dopełniamy wodą do objętości 100 cm3 i mieszamy. Pobieramy 20 cm3 do kolbki o pojemności 50 cm3, następnie dodajemy 10 cm3 wody destylowanej, 1 cm3 roztworu kwasu azotowego V (1:1), 1 cm3 2n kwasu siarkowego oraz 10 cm3 5% kwasu sulfasalicylowego. Uzupełniamy wodą destylowaną i mieszamy. Mierzymy absorbancję wobec ślepej próby.
3. Tablice wyników pomiarowych:
Absorbancja |
Stężenie |
|||
Pomiar I |
Pomiar II |
Pomiar III |
Średnia |
|
0.165 |
0.170 |
0.165 |
0.167 |
8.954*10-5 |
0.230 |
0.230 |
0.230 |
0.230 |
1.254*10-4 |
0.300 |
0.300 |
0.300 |
0.300 |
1.611*10-4 |
0.360 |
0.360 |
0.360 |
0.360 |
1.968*10-4 |
0.495 |
0.490 |
0.490 |
0.492 |
2.686*10-4 |
0.640 |
0.640 |
0.640 |
0.640 |
3.581*10-3 |
III Opracowanie wyników:
Ax: 0.335; 0.340; 0.340 => średnia wartość Ax=0.338
Do obliczenia stężenia badanej próbki korzystam ze wzoru A=K*c+C, gdzie K, C-parametry krzywej wzorcowej.
Równanie prostej y=ax+b, zatem K i C odpowiadają wartościom a i b, które obliczamy ze wzorów:
Wstawiając poszczególne dane do wzoru otrzymujemy, że współczynnik a=1769.325, a współczynnik b=0.0111. Na tej podstawie można obliczyć stężenie otrzymanej próbki:
=
=
Aby dowiedzieć się jaka była zawartość Fe(III) w roztworze badanym, korzystam ze wzoru m=c
250. Ponieważ stężenie podane jest w
, zatem należy przeliczyć wartości:
1 cm3 -
mmol Fe - x mg
1 mmol Fe - 55.845 mg
Stąd x=1.0318
mg Fe, zatem m=0.010318
2.58 mg
Analizując przebieg krzywej, można odczytać wartość stężenia dla badanej absorbancji, która oscyluje w granicach wyniku policzonego powyżej. Zatem masa Fe (III), liczona w analogiczny sposób, będzie taka sama jak obliczona.
źródło
promieniowania
monochromator
kiuweta
detektor
wskaźnik i
rejestrator
źródło musi pokryć
zakres 180-800 nm;
stosuje się lampy
deuterowe, wolframowo- halogenowe oraz wysokociśnieniowe lampy ksenowe
ma za zadanie wybrać wąskie pasmo o żądanej długości fali i przepuścić je przez komorę z badaną substancją. Składa się ze szczeliny wejściowej, kolimatora, elementu rozszczepiającego promieniowanie i szczeliny wyjściowej
komórka pomiarowa, w której umieszcza się badaną substancję. Powinna zapewnić dokładnie znaną grubość warstwy substancji, wykazywać odporność na działanie tych substancji oraz zapewnić w maksymalnym stopniu transmisję promieniowania
przetwarzają energię promieniowania elektromagnetycznego w energię elektryczną. Powinny charakteryzować się dobrą czułością i szerokim zakresem wskazań. Najczęściej są to fotokomórki, fotopowielacze albo fotodiody
pokazują rezultat danego procesu
Wyszukiwarka
Podobne podstrony:
sprawozdanie analityczna, Technologia chemiczna, Chemia analityczna, Laboratorium
Harmonogram laboratorium, Technologia chemiczna, Chemia analityczna, Laboratorium, Meteriały ogólne
Treść laboratorium, Technologia chemiczna, Chemia analityczna, Laboratorium, Meteriały ogólne
Analiza instrumentalna, Technologia chemiczna, Chemia analityczna, Laboratorium, Meteriały ogólne
analiza wagowa, Technologia chemiczna, Chemia analityczna, Laboratorium
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
Badanie równowagi fazowej w układzie trójskładnikowym 8.3, Technologia chemiczna, Chemia fizyczna, l
elektrolityzadania st, Technologia chemiczna, Chemia fizyczna, laboratorium
cwiczenie 34, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, chemia fizyczna
8.1 wykres, Technologia chemiczna, Chemia fizyczna, laboratorium
szybkość i mechanizm reakcji 6.1L(1), Technologia chemiczna, Chemia fizyczna, laboratorium
wagowa-zag kol, Technologia chemiczna, Chemia analityczna, analityczna
chemia analityczna instrukcje do lab, Technologia chemiczna, Chemia analityczna, analityczna
redox-zag kol, Technologia chemiczna, Chemia analityczna, analityczna
izomeria optyczna, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, chemia fizyczna
dyd tech22, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
więcej podobnych podstron