BUDOWA I EKSPLOATACJA
MASZYN I URZADZEN
1. PODSTAWOWE WIELKOSCI
WIELKOŚĆ FIZYCZNA jest to fizyczna właściwość ciała lub zjawiska, którą można odróżnić od innych właściwości jakościowo oraz określić ilościowo.
Rozróżnia się wielkości fizyczne:
skalarne,
wektorowe.
WARTOŚĆ WIELKOŚCI FIZYCZNEJ jest to ilość jednostek miar danej wielkości fizycznej.
WIELKOŚĆ SKALARNA jest to wielkość, do której określenia wystarcza jedna liczba tj. wartość np. objętość, temperatura, gęstość, praca, energia.
WIELKOŚĆ WEKTOROWA jest to wielkość, która posiada wartość, kierunek i zwrot np. siła, prędkość, przyspieszenie.
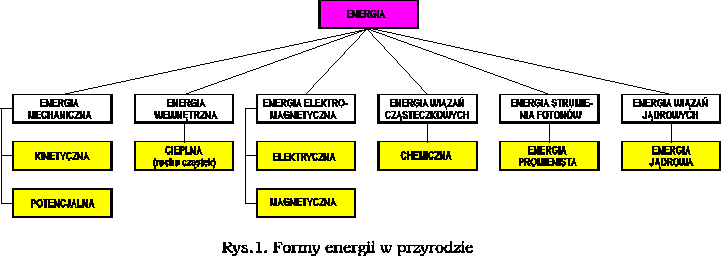
2. ENERGIA I JEJ RODZAJE
2.1. PODSTAWY
ENERGIA jest to uniwersalna wielkość skalarna umożliwiająca opisywanie wszelkiego rodzaju procesów i oddziaływań występujących w przyrodzie, a przekazywanie jej między układami przyjmować jedynie formę wykonywania pracy lub przepływu ciepła.
Energia, obok masy i informacji jest podstawowym składnikiem życia oraz procesów tworzenia produktów i ich dezintegracji.
Z fizycznego punktu widzenia istnieją jedynie dwa rodzaje energii:
energia potencjalna,
energia kinetyczna.
ENERGIA POTENCJALNA jest to energia jaką posiada ciało makroskopowe lub jego składnik, znajdujące się w polu potencjalnym. Pole potencjalne jest to przestrzeń, w każdym punkcie której na ciało działa charakterystyczna siła. Najczęściej spotykane są siły:
grawitacyjna,
elektryczna,
magnetyczna,
sprężystości.
ENERGIA KINETYCZNA jest to energia ciała, makroskopowego lub jego składnika, będąca efektem jego ruchu.
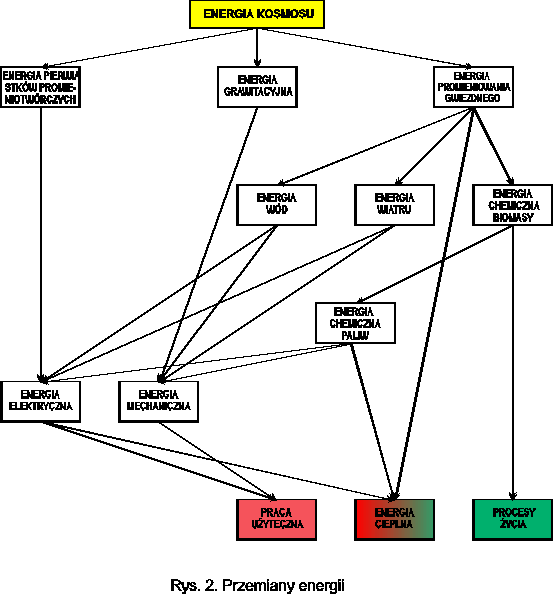
PIERWOTNYM ŹRÓDŁEM ENERGII w chwili obecnej są reakcje jądrowe zachodzące wewnątrz gwiazd czyli dla Ziemi słońca.
2H + 3H 4He + n + E
Energią rządzą określone zasady, z których najważniejsze to:
Zasada zachowania energii mówiąca, że energia w warunkach ziemskich nie ginie lecz zmienia swoją formę.
Zasada równoważności masy i energii Einsteina wyrażona zależnością:
![]()
gdzie: c - prędkość światła w próżni.
3) Zasada wzrostu entropii, mówiąca że suma entropii (Q/T) wszystkich ciał, biorących udział w dowolnym procesie wymiany energii rośnie:
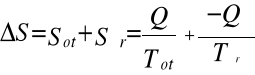
>0
.
W celu umożliwienia obliczeń praktycznych oraz realizacji różnych procesów, dla ciał makroskopowych przyjęto pojęcia różnych rodzajów energii.
Podstawową jednostką ilości wszystkich rodzajów energii jest:
1 J = 1N . 1m
Energia kosmosu po przetransformowaniu za pomocą różnych przemian jest wykorzystywana przez człowieka do:
Realizacji procesów życiowych w łańcuchu pokarmowym: producenci → konsumenci → reducenci (destruenci)
Pracy użytecznej w formie technologii produkcji różnych przedmiotów
Ciepła potrzebnego do utrzymania temperatury, optymalnej dla przebiegu procesów życiowych.
2.2. ENERGIA MECHANICZNA
Energia kinetyczna jest energią ciał będących w ruchu. W przyrodzie występują jedynie dwa rodzaje ruchu: ruch postępowy i ruch obrotowy. Dlatego też równanie opisujące ilość energii ciała posiada dwie postacie:
dla ruchu postępowego
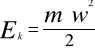
gdzie: m - masa ciała, kg
w - prędkość liniowa, m/s,
dla ruchu obrotowego:
![]()
gdzie: I - moment bezwładności ciała, kg.m2,
![]()
ω - prędkość kątowa ciała, rd/s.
Energia potencjalna jest to energia położenia, którą posiadają ciała będące w spoczynku. Energia ta może być wywołana:
usytuowaniem ciał w polu potencjalnym np. polu grawitacyjnym ziemi i wówczas określana jest zależnością:
![]()
gdzie: r - odległość od środka ziemi, m,
g - przyspieszenie ziemskie, m/s2.
działaniem sił sprężystości ciał stałych:
![]()
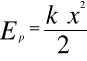
gdzie: k - współczynnik sprężystości charakteryzujący wielkość
energii przyciągania cząsteczek danego tworzywa, N/m,
x - wielkość odkształcenia, m.
działaniem sił odpychania cząstek sprężonego płynu:
![]()
gdzie: P - ciśnienie gazu, Pa,
ΔV - zmiana objętości podczas sprężania płynu, m3.
nierównomiernym rozkładem sił przyciągania międzycząstecz-
kowego w cieczy na powierzchni styku faz: gazowej i ciekłej czyli
t.zw. napięcia powierzchniowego:
![]()
gdzie: σ - napięcie powierzchniowe cieczy, N/m,
A - pole powierzchni zetknięcia się cieczy z gazem, m2.
2.3. ENERGIA ELEKTRYCZNA
Jest to energia pola elektrycznego, wytwarzanego przez ładunki elektryczne.
Istnieje wiele różnych form energii elektrycznej. Najbardziej rozpowszechniona jest energia prądu elektrycznego. Energię tą określa się zależnością:
![]()
gdzie: U - napięcie czyli różnica potencjałów, V,
I - natężenie prądu, A.
2.4. ENERGIA CIEPLNA
Jest to energia ruchu atomów i cząsteczek zawartych w materii o temperaturze większej od zera bezwzględnego, drgających lub poruszających się względem siebie.
![]()
gdzie: c - ciepło właściwe materii, z której jest zbudowane ciało, czyli ilość
ciepła potrzebna do ogrzania jednostki materii o 1 K, J/kg.K,
J/kmol.K, J/mn3.K.
T - temperatura bezwzględna ciała, K.
2.5. ENERGIA CHEMICZNA
Jest to sumaryczna energia wiązań międzyatomowych w cząsteczce ciała, wynikająca z energii zewnętrznych powłok atomów. W praktyce energię tą określa się jako ciepło lub oddane podczas reakcji chemicznych np. ciepło spalania:
![]()
![]()
gdzie: ΔEchCO2, ΔEchC, ΔEchO2 - energie cząsteczek substratów i produktu
spalania, J/kg (J/kmol, J/mn3).
2.6. ENERGIA PROMIENISTA
Jest to energia fal elektromagnetycznych przenoszona bez udziału materii.
Każde ciało, którego temperatura jest większa od zera bezwzględnego emituje fale elektromagnetyczne odczuwane jako ciepło. Energię promienistą tych fal określa się za pomocą wzoru Stefana-Boltzmanna:
![]()
gdzie: σ = 5,67. 10-8 W/m2.K4 - stała promieniowania ciała doskonale
czarnego,
ε - emisyjność ciała, (-),
T - Temperatura bezwzględna K.
2.7. ENERGIA JADROWA
Jest to energia wiązań nukleonów w jądrze atomu.
![]()
gdzie: Z - liczba atomowa pierwiastka,
N - ilość neutronów w jądrze,
mp - masa protonu,
mn - masa neutronu,
mj - masa jądra atomu.
3. GAZ JAKO NOSNIK ENERGII W MASZYNACH
Gaz jest podstawowym nośnikiem energii w maszynach energetycznych. Parametrami stanu gazu są:
ciśnienie P, [Pa, bar],
temperatura T, [K, 0C],
objętość właściwa (objętość 1 kg) v, [m3/kg].
Rozróżnia się:
ciśnienie bezwzględne, mierzone od poziomu próżni,
ciśnienie względne, mierzone od ciśnienia otoczenia.
Rys.3. Rodzaje ciśnień
Dla celów praktycznych rozróżnia się:
gazy doskonałe,
gazy półdoskonałe,
gazy rzeczywiste.
Gaz doskonały ma następujące własności:
stosuje się do prawa Boyle'a-Mariotte'a (PV = const),
stosuje się do prawa Gay-Lussaca (V/T = const),
stosuje się do prawa Awogadra (gdy P,V,T = const to n = const).
ma stałe ciepło właściwe.
Gaz półdoskonały stosuje się do wymienionych trzech praw, ale jego ciepło właściwe nie jest stałe i zależy od temperatury.
Gaz rzeczywisty nie stosuje się do powyższych praw.
Stan gazu doskonałego i półdoskonałego, z wystarczającą dokładnościa opisuje równanie stanu gazu doskonałego.
Równanie stanu gazu doskonałego jest to związek pomiędzy parametrami gazu (T,P,V) będącego pod niewielkim ciśnieniem i posiadającego temperaturę wyższą od jego temperatury parowania. Równanie to dla dowolnej ilości kilomoli gazu ma następującą postać:
![]()
1-sza postać
gdzie: R — uniwersalna stała gazowa, której wartość wynosi
8314 J/kmol.K,
n — ilość kilomoli gazu,
P — ciśnienie bezwzględne gazu, Pa,
T — temperatura bezwzględna gazu,
V — objętość gazu, m3.
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
||||||
Ponieważ 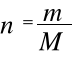
to po wstawieniu 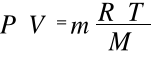
a dzieląc przez V
otrzymuje się: 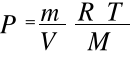
i po uwzględnieniu 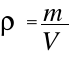
otrzymuje się 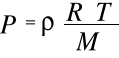
i ostatecznie zależność gęstości od parametrów stanu gazu:
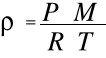
2-ga postać
Gęstość gazu jest podstawową własnością fizyczną materii.
Stan gazu rzeczywistego opisywany jest za pomocą wielu równań, z których najczęściej używanym jest:
![]()
![]()
gdzie: z - współczynnik ściśliwości, dla danego gazu, odczytywany z tablic.
Gazy rzeczywiste można traktować jako półdoskonałe gdy ich ciśnienie nie przekracza 2 bar, a temperatura jest co najmniej o 20 K wyższa od temperatury skraplania pod ciśnieniem normalnym.
Objętość gazu zależy od jego temperatury i ciśnienia . Aby uzyskać możliwość porównywania własności różnych gazów ustalono normalne fizyczne warunki parametrów stanu gazów:
Pn = 101325 Pa i Tn = 273 K
W tych warunkach 1 mn3 dowolnego gazu jest to ilość gazu jaka zajmuje objętość 1 m3. Jest to więc jednostka ilości materii. W warunkach normalnych:
1 kmol dowolnego gazu = 22,42 mn3 = M kg
W praktyce najczęściej występują roztwory gazowe tj. mieszaniny różnych gazów. Skład roztworów gazowych określa się:
za pomocą udziałów molowych
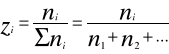
za pomocą udziałów masowych
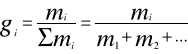
za pomocą udziałów objętościowych
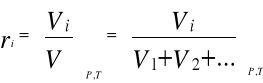
Zależności pomiędzy poszczególnymi rodzajami udziałów są następujące:
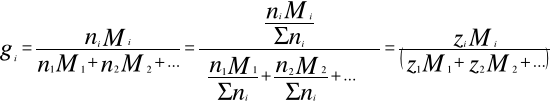
![]()
Prawo Daltona mówi, że każdy składnik roztworu gazowego zachowuje się tak, jak gdyby sam znajdował się w przestrzeni zajętej przez roztwór. Do prawa tego stosują się gazy doskonałe i półdoskonałe.
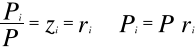
![]()
4. CIEPŁO WŁASCIWE
Drugą, obok gęstości, najważniejszą własnością materii jest ciepło właściwe. Ciepło właściwe jest to ilość ciepła potrzebna do ogrzania jednostki ilości materii o 1 K. Jednostką ilości materii może być:
1 kmol, 1kg — dla wszystkich stanów skupienia,
1 mn3 — tylko dla gazów.
Rozróżnia się ciepło właściwe:
molowe — (Mc) — J/kmol.K,
masowe — c — J/kg.K,
objętościowe — C — J/mn3K.
Gazy mogą być ogrzewane lub ochładzane pod stałym ciśnieniem (w przypadku przepływu w kanałach i rurociągach) lub w stałej objętości (w zbiornikach zamkniętych). Podczas ogrzewania gazu pod stałym ciśnieniem konieczne jest doprowadzenie do jednostki materii gazu większej ilości energii cieplnej niż w przypadku ogrzewania w stałej objętości. Jest to spowodowane podstawową własnością materii, która podczas ogrzewania zwiększa swoją objętość. Dotyczy to praktycznie gazów, gdyż zmianę objętości ciał stałych i cieczy można pominąć z niewielkim błędem. Dlatego też w przypadku gazów rozróżnia się ciepło właściwe:
pod stałym ciśnieniem: (Mc)p, cp, Cp,
w stałej objętości: (Mc)v, cv, Cv.
Zależności łączące poszczególne rodzaje ciepeł wynikają z powyższych równań:
![]()
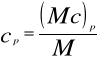
i 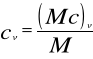
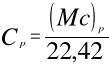
i 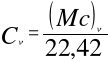
Ciepło właściwe dla ciał stałych, cieczy oraz gazów półdoskonałych i rzeczywistych nie jest stałe lecz zmienne wraz z temperaturą.
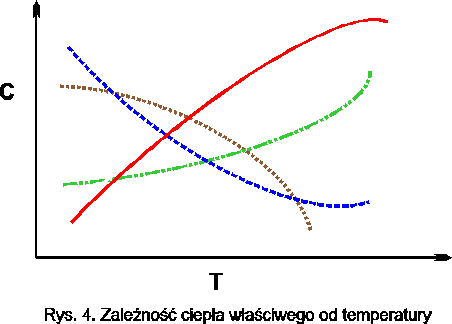
Rys.5. Zależność ciepła właściwego od temperatury
Wartości ciepła właściwego dla różnych substancji wyznacza się doświadczalnie i zestawia w tablicach. Aby uniknąć nadmiernej ilości tablic i umożliwić łatwe korzystanie z nich przyjęto jako dolną temperaturę, od której ogrzewa się daną substancję „0 0C” lub „0 K” zaś górną podaje się w tablicy. Zestawione w ten sposób wartości ciepła właściwego są ciepłem właściwym średnim dla danego zakresu temperatur.
Tabl.2. Średnie ciepło właściwe pod stałym ciśnieniem (Mc)p
Temperatura |
CO |
O2 |
CO2 |
H2 |
N2 |
CH4 |
C2H6 |
C3H8 |
|
oC |
K |
kJ/kmol.K |
|||||||
0 |
273 |
29,123 |
29,274 |
35,860 |
28,617 |
29,115 |
34,738 |
49,530 |
68,329 |
100 |
273 |
29,262 |
29,877 |
40,206 |
29,128 |
29,199 |
39,281 |
62,170 |
88,928 |
200 |
473 |
29,647 |
30,815 |
43,689 |
29,241 |
29,471 |
45,029 |
74,873 |
108,396 |
300 |
573 |
30,254 |
31,832 |
46,515 |
29,299 |
29,952 |
50,941 |
86,290 |
124,976 |
400 |
673 |
30,974 |
32,758 |
48,860 |
29,396 |
30,576 |
56,622 |
96,636 |
139,379 |
500 |
773 |
31,707 |
33,549 |
50,815 |
29,559 |
31,250 |
61,856 |
105,805 |
152,065 |
600 |
873 |
32,402 |
34,202 |
52,452 |
29,793 |
31,920 |
66,620 |
113,868 |
163,034 |
700 |
973 |
33,025 |
34,746 |
53,826 |
30,099 |
32,540 |
70,929 |
120,936 |
172,664 |
800 |
1073 |
33,574 |
35,203 |
54,977 |
30,472 |
33,101 |
74,747 |
126,755 |
180,451 |
900 |
1173 |
34,055 |
35,584 |
55,952 |
30,869 |
33,599 |
78,168 |
131,964 |
187,401 |
1000 |
1273 |
34,470 |
35,914 |
56,773 |
31,284 |
34,043 |
81,195 |
136,753 |
193,765 |
Ilość ciepła pobraną podczas ogrzewania lub oddaną podczas chłodzenia oblicza się z zależności:
dla gazów doskonałych
![]()
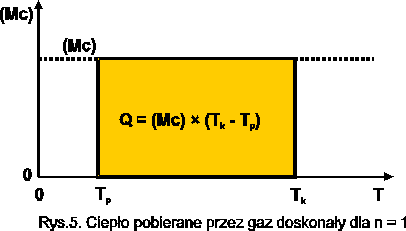
Rys.6. Ciepło pobrane przez gaz doskonały przy n = 1
dla gazów półdoskonałych, ciał stałych i cieczy:
![]()
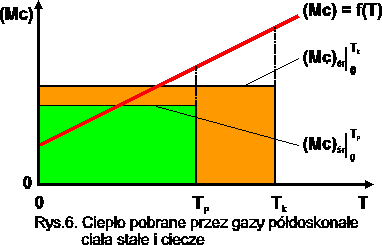
Rys.7. Ciepło pobrane przez gazy półdoskonałe,
ciała stałe i ciecze
5. BILANS ENERGETYCZNY
Bilans energetyczny jest najważniejszym pojęciem w życiu i technice. Dlatego też istotnym jest zrozumienie jego pojęcia i właściwe stosowanie w praktyce.
Przedmiot lub kilka przedmiotów, które chce się rozpatrywać, otacza się w myśli błoną zwaną osłoną kontrolną. Otrzymuje się w ten sposób układ ciał oddzielony osłoną od innych ciał. Ponieważ osłona istnieje tylko w naszej myśli, to może przez nią przepływać energia oraz masa w postaci gazów, cieczy lub ciał stałych.
Suma energii wszystkich ciał zamkniętych wewnątrz osłony nazywa się energią układu Eu.

Rys.8. Osłona kontrolna
Do układu w osłonie kontrolnej doprowadza się pewną ilość energii Ed i równocześnie wyprowadza z układu mniejszą ilość energii Ew . Część energii doprowadzonej zatrzymała się w układzie. Wskutek tego suma energii układu wzrosła.
-
Stosując zasadę zachowania energii otrzymuje się:
![]()
Jest to bilans energetyczny układu, który w postaci wykresu Sankey'a przedstawiono na rys. 9.
Rys.9 Bilans energetyczny układu
Podczas przepływu przez materię energia może zamieniać się w:
bezpośrednio w inny rodzaj energii,
ciepło przekazywane do otoczenia,
pracę .
Ciepło i praca są to dwie współwystępujące formy przekazywania energii w materii. Zjawisko to szczególnie wyraźnie uwidacznia się dla gazów. We wszystkich procesach jednostkowych, w których uczestniczą gazy (i nie tylko) bilans energetyczny przybiera postać:
![]()
gdzie: ΔU - przyrost energii wewnętrznej (cieplnej) materii,
Q - ciepło doprowadzone do materii,
L - praca wykonana przez materię.
Powyższą formę bilansu energetycznego nazywa się pierwszą zasadą termodynamiki.
Praca wykonana przez układ materialny może mieć różny charakter lub składać się z kilku różnych prac. Jeden z rodzajów pracy związany jest z budową materii i występuje zawsze, w każdym procesie pod stałym ciśnieniem. Jest to praca objętościowa:
![]()
Tak więc w omawianym przypadku pierwsza zasada termodynamiki przybiera postać:
![]()
10
Wyszukiwarka
Podobne podstrony:
system oceny zgodnoÂci, Szkoła Przemek, Zarządzanie bezpieczeństwem pracy dr.krauze, FW ZZIP 12 Zar
Bezpieczeństwo pracy w wybranych gałęziach gospodarki, Szkoła Przemek, Bezpieczeństwo w wybr gał gos
Przesyłam pytania, Szkoła Przemek, ekologia
Manual LeftHand zadanie na 3 dni M, Szkoła Przemek, ekologia
tox 2011, Szkoła Przemek, toksykologia
Transport energii, Szkoła, Fizyka 02
profilaktyka bhp, Szkoła Przemek, Zarządzanie bezpieczeństwem pracy dr.krauze, FW ZZIP 12 Zarzadzan
GOTOWY, Szkoła Przemek, Projekt Ergonomia
Tematy na zaliczenie Paliwa i Energia, Szkoła PŁ, paliwa i energia PŁ
system ochrony pracy, Szkoła Przemek, Zarządzanie bezpieczeństwem pracy dr.krauze, FW ZZIP 12 Zarza
Odnawialne źródła energii, szkola technikum, polski mowtywy
BPiE w g+-rn. - test, Szkoła Przemek, Bezpieczeństwo w wybr gał gosp, FWD
PRZEMIANA MATERII I ENERGII, Szkoła PSWIS, Dietetyka, DIETETYKA
WYKLAD zasoby energii, Szkoła, Semestr III, technologia maszyn energetycznych, Materiały Skiepki
więcej podobnych podstron