Identyfikacja bakterii z rodzaju Streptococcus w oparciu o ich właściwości biochemiczne (test API 20 Strep)
Test API 20 Strep jest wystandaryzowanym zestawem zawierającym 20 testów biochemicznych, który daje szerokie możliwości. Umożliwia on identyfikację grup lub gatunków większości paciorkowców i enterokoków oraz najbardziej powszechnych spokrewnionych drobnoustrojów. Niewątpliwie metoda ta przy użyciu odpowiednich kodów stanowi jak dotąd najdoskonalszą i najbardziej uniwersalną metodę identyfikacji bakterii.
Charakterystyka testu API
Test API składa się z 20 miniprobówek z tworzywa wtopionych w pasek również wykonany z tworzywa. W każdej miniprobówce znajduje się odwodniony substrat i wskaźnik umożliwiający odczytanie reakcji.
Oznaczenie polega na dodaniu zawiesiny paciorkowców do wszystkich probówek i po inkubacji dodaniu do niektórych probówek odpowiednich odczynników. Zmiany barwy zawartości probówek umożliwiają określenie, jakie substraty są rozkładane, czy też jaki rodzaj aktywności enzymatycznej występuje. Określenie grupy lub gatunku dokonuje się na podstawie załączonego przez producenta klucza diagnostycznego.
Wykonanie ćwiczenia
Przygotowanie paska
Przygotować komorę inkubacyjną (podstawkę i pokrywkę) i nanieść około 5 ml destylowanej lub demineralizowanej wody na podstawkę w kształcie plastra miodu, w celu wytworzenia komory wilgotnej;
Wyjąć pasek z indywidualnego opakowania;
Umieścić pasek w komorze inkubacyjnej.
Przygotowanie inokulum
Do probówki dodać 2 ml wody destylowanej;
Używając wymazówkę zebrać wszystkie bakterie, które wyrosły na płytce z przygotowaną hodowlą bakteryjną;
Przygotować gęstą zawiesinę bakteryjną. Zawiesinę tę użyć natychmiast po sporządzeniu.
Napełnianie paska
Zawiesinę nanieść do pierwszej części paska (testy od VP do ADH), unikając tworzenia pęcherzyków (nachylić lekko pasek do przodu i trzymać końcówkę pipety przy ściance wgłębienia):
- Do testów od VP do LAP nanieść po około 100 μl do każdej mikroprobówki;
- Dla testu ADH: napełnić wyłącznie probówkę;
Dla drugiej części paska (testy od RIB do GLYG):
- Otworzyć ampułkę API GP Medium i przenieść do niej resztęzawiesiny (około 0,5 ml). Dobrze wymieszać;
- Nanieść tę nową zawiesinę wyłącznie do probówek;
Napełnić wgłębienia podkreślonych testów (od ADH do GLYG) olejem mineralnym, aby utworzył się menisk wypukły;
Przykryć podstawkę pokrywką;
Inkubować w 36oC ± 2oC w warunkach tlenowych przez 4 - 4½ godziny, aby dokonać odczytu.
Tabela Odczytów
|
AKTYWNE SKŁADNIKI |
|
|
|
|||||
|
|
|
|
|
|
||||
|
Pirosiarczan sodu |
1,9 |
Wytwarzanie acetoiny (Voges Proskauer) |
VP1 + VP2 / odczekać 10 min(3) |
|||||
|
|
|
|
Bezbarwny |
Różowo-Czerwony |
||||
HIP |
Kwas hipurowy |
0,4 |
Hydroliza (kwas hipurowy) |
|
|||||
|
|
|
|
Bezbarwny/blado niebieski |
Ciemno niebieski/fioletowy |
||||
ESC |
Eskulina Cytrynian sodu |
1,16 0,152 |
β-glukozydaza hydroliza (eskulina) |
4 godz. |
24 godz. |
4 godz. |
24 godz. |
||
|
|
|
|
Bezbarwny Blado żółty |
Bezbarwny Blado żółty Jasno szary |
Czarny Szary |
Czarny |
||
PYRA |
β-naftyloamid kwasu piroglutaminowego |
0,0256 |
Arylamidaza pirolidonylu |
ZYM A + ZYM B / 10 min (od PYRA do LAP)(1) Jeśli to konieczne, odbarwić w silnym świetle |
|||||
|
|
|
|
Bezbarwny lub bardzo blado pomarańczowy |
Pomarańczowy |
||||
αGAL |
6-bromo-2-naftylo-αD-galaktopiranozyd |
0,0376 |
α-galaktozydaza |
bezbarwny |
fioletowy |
||||
βGUR |
Naftol ASBI kwasu glukurunowego |
0,0537 |
β-glukuronidaza |
bezbarwny |
Niebieski |
||||
βGAL |
2-naftylo- βD-galaktopiranozyd |
0,0306 |
β-galaktozydaza |
Bezbarwny lub bardzo blado fioletowy |
Fioletowy |
||||
PAL |
2-naftylo fosforan |
0,0244 |
Fosfataza alkaliczna |
Bezbarwny lub bardzo blado fioletowy |
Fioletowy |
||||
LAP |
L-leucyno- |
0,0256 |
Leucyno aminopeptydaza |
Bezbarwny |
Pomarańczowy |
||||
|
L-arginina |
1,9 |
Dihydrolaza argininy |
Żółty |
Czerwony |
||||
|
|
|
|
4 godz. |
24 godz |
4 godz |
24 godz. |
||
|
D-ryboza |
1,4 |
Zakwaszanie (ryboza) |
Czerwony |
Pomarańczowy/ |
Pomarańczowy/ |
Żółty |
||
|
L-arabinoza |
1,4 |
Zakwaszanie (arabinoza) |
Czerwony |
Pomarańczowy/ |
Pomarańczowy/ |
Żółty |
||
MAN |
D-mannitol |
1,36 |
Zakwaszanie (mannitol) |
Czerwony |
Pomarańczowy/ |
Pomarańczowy/ |
Żółty |
||
SOR |
D-sorbitol |
1,36 |
Zakwaszanie (sorbitol) |
Czerwony |
Pomarańczowy/ |
Pomarańczowy/ |
Żółty |
||
LAC |
D-laktoza (wołowa) |
1,4 |
Zakwaszanie (laktoza) |
Czerwony |
Pomarańczowy/ |
Pomarańczowy/ |
Żółty |
||
TRE |
D-trehaloza |
1,32 |
Zakwaszanie (trehaloza) |
Czerwony |
Pomarańczowy/ |
Pomarańczowy/ |
Żółty |
||
INU |
Inulina |
5,12 |
Zakwaszanie (inulina) |
Czerwony |
Pomarańczowy/ |
Pomarańczowy/ |
Żółty |
||
RAF |
D-rafinoza |
3,12 |
Zakwaszanie (rafinoza) |
Czerwony |
Pomarańczowy/ |
Pomarańczowy/ |
Żółty |
||
AMD |
Skrobia(2) |
2,56 |
Zakwaszanie (skrobia) |
Czerwony |
Pomarańczowy/ |
Pomarańczowy/ |
Żółty |
||
GLYG |
glikogen |
1,28 |
Zakwaszanie (glikogen) |
Czerwony lub pomarańczowy |
Jasno żółty |
||||
W trakcie drugiego odczytu po 24 godzinach inkubacji, może pojawić się w probówkach osad po dodaniu odczynników ZYM A i ZYM B. Jest to normalne zjawisko, które nie powinno być brane pod uwagę.
Zakwaszenie skrobi jest często słabsze niż innych cukrów.
Bardzo różowy kolor pojawiający się po 10 minutach należy uważać za wynik negatywny.
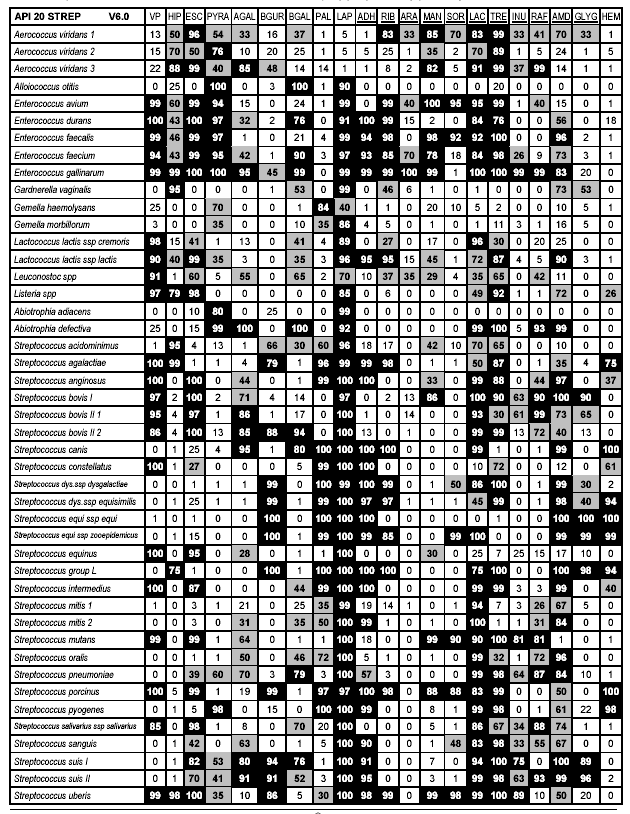
Tabela identyfikacyjna
Wyszukiwarka
Podobne podstrony:
7877
7877
praca-magisterska-wa-c-7877, Dokumenty(2)
7877
7877
więcej podobnych podstron