Chemia i technologia wód i ścieków
Krzysztof Lichota
I rok II0 Ochrony Środowiska
Oznaczanie związków refrakcyjnych w wodzie metodą spektroskopii elektronowej UV - VIS
Związki refrakcyjne to grupa substancji organicznych, które łatwo przedostają się do wód powierzchniowych. Występują one w wodzie w małych stężeniach, jednak nawet śladowe ich ilości są bardzo toksyczne dla środowiska. Posiadają one niebezpieczną cechę, którą jest zdolność do kumulacji w organizmach żywych.
Źródła pochodzenia związków refrakcyjnych:
ścieki przemysłowe i miejskie (węglowodory alifatyczne i aromatyczne, fenole, WWA, pestycydy, ftalany, PCB i wiele innych)
spływy powierzchniowe z pól uprawnych i terenów miejskich (np, pestycydy, węglowodory alifatyczne i aromatyczne, WWA)
opady atmosferyczne
uzdatnianie i oczyszczanie ścieków (podczas chlorowania w reakcje wchodzą kwasy humusowe)
Związki refrakcyjne występujące w wodzie możemy podzielić na kilka głównych grup:
Pochodne ropy naftowej
Powstają one w procesie destylacji frakcyjnej ropy naftowej. Do najczęściej występujących związków należą: alkany, alkeny, cykloalkany, węglowodory aromatyczne (np. benzen, toluen), związki zawierające tlen (np. kwas stearynowy, fenol), zw. zawierające azot (np. pirydyna). Innym zagrożeniem dla wód powierzchniowych są związki powstające podczas procesu rafinacji ropy naftowej, do których możemy zaliczyć: oleje mineralne, benzynę, naftę, smary, wazelinę, parafinę, asfalt. duży problem stanowią oleje, które mogą pogorszyć smak i zapach wody, a w wyższych temperaturach mogą prowadzić do śmierci organizmów dennych.
Pestycydy
Są to substancje (naturalne, lub syntetyczne), stosowane do zwalczania szkodników. Stosowane są głównie w rolnictwie, ochronie zdrowia i leśnictwie. Możemy je podzielić ze względu na zastosowanie (są to m.in. insektyydy, fungicydy, herbicydy, rodentocydy, bakteriocydy, defolianty, i wiele innych), oraz ze względu na budowę chemiczną (związki chloroorganiczne, związki fosforoorganiczne karbaminiany, pochodne kwasu fenoksyoctowego, pochodne triazyny, oraz pestycydy mocznikowe). Pestycydy mogą być bezpośrednio wprowadzone do wód, lub też dostawać się do nich wraz ze ściekami w efekcie spływu powierzchniowego. Dużym problemem pestycydów, jest ich odkładanie się (kumulowanie) w organizmach żywych, oraz ich silne właściwości toksyczne.
Związki powierzchniowo czynne
Możemy tu zaliczyć syntetyczne środki pieniące, emulgujace, piorące, czyszczące, itp. Ze względu na specyficzna budowę, środki powierzchniowo czynne rozpuszczają się częściowo w fazie organicznej, a częściowo w fazie wodnej. Ze względu na budowę możemy je podzielić na kationowe (służą do dezynfekcji, produkcji kosmetyków, oraz w medycynie), anionowe (np. sulfonowany olej palmowy, alkilobenzenosulfonian sodowy), niejonowe
(np. etoksylany alkilofenoli, etoksylany alkoholi wielowodorotlenowych), amfoteryczne
(np. polipeptydy służące do wyrobu kosmetyków). Związki powierzchniowo czynne przyczyniają się do wzrostu eutrofizacji wód powierzchniowych, oraz wpływają niekorzystnie na pracę oczyszczalni ścieków.
Rozjaśniacze fluorescencyjne
Grupa tych związków znajduje najczęściej zastosowanie podczas barwienie tekstyliów, papieru, tworzyw sztucznych, itp. Rozjaśniacze fluorescencyjne posiadają zdolność pochłaniania światła w nadfiolecie i emisji światła niebieskiego o większej długości fali. Należą tutaj w większości produkty sprzęgania kwasu sulfo-aminostilbenowego i pochodnych chlorku cyjanuru. Ich toksycznośc jest bardzo mała, a stężenie w wodzie niewilkie i pochodzi głównie z zakładów przemysłowych.
Halogenowane węglowodory alifatyczne
Są to związki, które powstają w reakcji halogenów z węglowodorami. Dostają się one do wód wraz ze ściekami przemysłowymi, podczas chlorowania wody i ścieków, a także z rur wykonanych z PCV. Należą do nich m.in. chloroform, dibromochlorometan, bromodichlorometan, bromoform., czterochlorek węgla, chlorek winylu i wiele innych. Stężenie halogenowanych weglowodorów alifatycznych w wodzie jest niskie, jednak wykazują one zdolność do kumulowania się w organizmach żywych. Wykazano także, ze związki te maja zdolności rakotwórcze.
Chlorowane związki aromatyczne
Ta grupa związków cechuje się znaczna toksycznością. Do chlorowanych związków aromatycznych możemy zaliczyć: polichlorowane bifenyle (PCB - stosowane przy produkcji farb ochronnych, smarów, tworzyw sztucznych, itp. Rozkładają się w środowisku nawet 15lat) polichlorowane trifenyle (PCT - o podobnych właściwościach jak PCB), chlorowane benzeny.
Wielopierścieniowe węglowodory aromatyczne (WWA)
Cechą tej grupy związków jest to, iż zawierają w swojej cząsteczce kilka pierścieni aromatycznych. Powstają one najczęściej podczas przeróbki paliw, węgla i ropy naftowej. Dlatego też najczęściej do wód przedostają się wraz ze ściekami z przemysłu petrochemiczngo. Innym źródłem WWA jest spływ powierzchniowy z dróg (podczas ścierania się opon samochodowych). Są one niebezpieczne ze względu na właściwości mutagenne i kancerogenne. Możemy do tej grupy zaliczyć: benzo(a)piren, benzo(b)fluoranten, benzo(a)antracen, antracen, czy fenantren.
Ftalany
Są to dwu estry kwasu ftalowego (np. ftalan dimetylu, ftalan dietylu). Wykorzystywane są do produkcji tworzyw sztucznych, np. PCV. Nie wykazują właściwości toksycznych, jednak w środowisku wodnym rozkładają się bardzo powoli.
Fenole
Ostatnia grupę związków refrakcyjnych w wodzie stanowią fenole. Są to związki aromatyczne z jedną (lub więcej) grupa wodorotlenową. Przedstawicielem jest fenol, jednak w wodzie występują także jego pochodne, np. krezole, butylofenol, fenole dwuwodorotlenowe, oraz wielowodorotlenowe. Toksyczność tych związków jest znacząca, wykazują działanie bakteriobójcze (szczególnie fenol), jednak są niebezpieczne także dla człowieka.
Istnieje wiele metod służących oznaczeniu związków refrakcyjnych w wodzie. Możemy do nich zaliczyć, m.in. metody pomiaru wskaźników ogólnego zanieczyszczenia wód (np. sucha pozostałość po prażeniu, biochemiczne zapotrzebowanie na tlen, chemiczne zapotrzebowanie na tlen, całkowita zawartość węgla organicznego, ogólne zapotrzebowanie na tlen, metoda pomiaru absorbancji w nadfiolecie), metody pomiaru stopnia biodegradacji związków organicznych, metody pomiaru indywidualnych związków organicznych (np. chromatografia gazowa, HPLC, metody spektrofluorometryczne, metody spektrofotometryczne, chromatografia gazowa w połączeniu ze spektrometrią masową).
Jedną z metod (wykorzystana przez nas w ćwiczeniu) jest spektroskopia elektronowa
UV - VIS. Cechą charakterystyczną tej metody jest stosunkowo dobra czułość i precyzja oznaczeń, a także wysoka selektywność. Zaletą spektroskopii elektronowej UV - VIS jest niewątpliwie szybkość i prostota wykonania. Zasada metody polega na wzbudzeniu elektronów wieloatomowej cząsteczki i ich przejścia na wyższy poziom energetyczny. Grupa odpowiedzialna za absorpcję promieniowania określana jest mianem grupy chromoforowej. W skład aparatu do spektroskopii elektronowej wchodzi:
W ćwiczeniu oznaczaliśmy następujące związki:
błękit bromofenolowy
zieleń bromokrezolową
błękit bromotymolowy
erioglaucynę
fenol
oranż metylowy
Przy długości fali światła w zakresie 330 - 1100nm.
Wzory strukturalne oznaczanych związków:
błękit bromofenolowy:
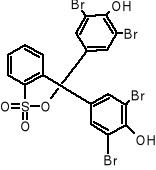
chromofory - 3 pierścienie aromatyczne
gr. auksochromowe - podstawniki -OH i Br
błękit bromotymolowy:
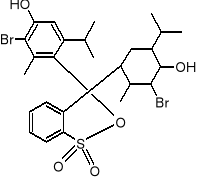
chromofory - 3 pierścienie aromatyczne
gr. auksochromowe - podstawniki -OH i Br
oranż metylowy:
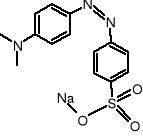
chromofory - 2 pierścienie aromatyczne
gr. auksochromowe - chromofor azowy
zieleń bromokrezolowa:
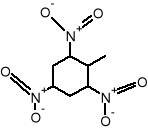
chromofory - pierścienń aromatyczny
gr. auksochromowe - podstawniki OH i Br
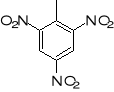
TNT
Wyznaczenie krzywych kalibracyjnych do oznaczenia fenolu:
nr próbki |
stężenie [mol/dm3] |
absorbancja przy długości fali światła |
|
|
|
212nm |
269nm |
1. |
0,51 |
0,073 |
|
2. |
1,02 |
0,406 |
0,122 |
3. |
2,55 |
0,796 |
0,224 |
4. |
3,06 |
1,382 |
0,378 |
5. |
3,57 |
1,584 |
0,434 |
6. |
4,08 |
1,978 |
0,545 |
7. |
4,59 |
2,117 |
0,591 |
|
Badana próbka |
||
|
1,311 |
0,324 |
|
Widma absorpcyjne badanych związków:
1
źródło
światła
monochromator
detektor
rejestrator
kuweta
Wyszukiwarka
Podobne podstrony:
sciagi, zootechnika, Toksykologia, toksykologia ściągi
toksykologia duza, zootechnika, Toksykologia, toksykologia ściągi
ściąga toksyki egz, zootechnika, Toksykologia, toksykologia ściągi
toksykologia 4
Analiza toksykologiczna
Toksykologia sądowo lekarska
TOKSYKOLOGIA 8
5 Toksykokinetyka i toksykodynamika
Poradnik Toksykologia
salicylany, V ROK, TOKSYKOLOGIA, notatki, kolos 1
Mechanizmy absorpcji trucizn, TOKSYKOLOGIA, Toksykologia
Kw szczawiowy, WNOŻCiK wieczorowe, semestr V, toksykologia
TOXYKIwieczorowi, toksykologia żywności SGGW
więcej podobnych podstron