Łukasz Cekała
Anita Barczak
Data wykonania ćwiczenia: 30.11.2012
Ćwiczenie numer 10
Badanie procesów elektrodowych.
Wstęp teoretyczny
Metody potencjometryczne wykorzystują zależność między stężeniem (a ściślej aktywnością) oznaczanego jonu w roztworze i potencjałem elektrycznym odpowiedniej elektrody. Ponieważ potencjał elektrody względem roztworu nie jest dostępny bezpośrednim pomiarom, wykonuje się pomiar siły elektromotorycznej (SEM) ogniwa, którego jednym półogniwem jest elektroda wskaźnikowa, której potencjał zależy od stężenia oznaczanego jonu, a drugim - elektroda porównawcza, której potencjał ma wartość stałą. Obie elektrody są w kontakcie z badanym roztworem. Metody potencjometryczne polegają więc na pomiarze siły elektromotorycznej (SEM) ogniwa złożonego z dwóch elektrod zanurzonych do badanego roztworu. Mierzona SEM zależy w określony sposób od stężenia w roztworze oznaczanego składnika. Za zmianę SEM odpowiedzialna jest jedna z elektrod, elektroda wskaźnikowa.
Metody potencjometryczne dzielą się na dwie grupy:
Metody bezpośrednie polegające na wyznaczeniu stężenia oznaczanego składnika na podstawie wartości SEM ogniwa, którego kalibracji dokonano za pomocą próbek wzorcowych. Należą tu pomiary pH roztworów oraz oznaczenia za pomocą elektrod jonoselektywnych.
Metody pośrednie czyli miareczkowe stosowane są do wyznaczania punktu końcowego miareczkowania - jest to tzw. miareczkowanie potencjometryczne. W miareczkowaniu tym wyznacza się zmiany SEM odpowiedniego ogniwa spowodowane dodawaniem mianowanego roztworu odczynnika miareczkującego.
Rodzaje elektrod:
W pomiarach potencjometrycznych bardzo ważną rolę odgrywają elektrody, które ze względu na mechanizm działania można podzielić na cztery grupy:
Elektrody pierwszego rodzaju, czyli elektrody odwracalne w stosunku do kationu; są to elektrody składające się z metalu lub gazu w równowadze z roztworem zawierającym jony tego metalu.
Elektrody drugiego rodzaju, są to elektrody odwracalne w stosunku do anionu tworzącego z metalem elektrody trudno rozpuszczalny związek.
Elektrody trzeciego rodzaju, elektrody te tworzą metale w równowadze z roztworem nasyconym dwoma trudno rozpuszczalnymi elektrolitami o tym samym anionie. Kation jednego z elektrolitów jest kationem metalu elektrody, drugi kation znajduje się w roztworze w nadmiarze.
Elektrody utleniająco-redukujące, w elektrodach tych obojętny chemicznie metal (Pt, Au) jest zanurzony w roztworze zawierającym substancje zarówno w formie utlenionej, jak i zredukowanej.
Ponadto osobną grupę stanowią elektrody jonoselektywne (ISE) zwane membranowymi. Wspólną ich cechą jest to, że:
- elektrodowo czynną częścią elektrody jest membrana,
- różnica potencjałów na granicy faz membrana/roztwór spowodowana jest reakcją wymiany jonowej między jonami z roztworu a jonami z membrany.
Potencjał elektrod pierwszego rodzaju ustala się zgodnie z następującym rozumowaniem. Metal M zanurzony do roztworu jego soli wykazuje tendencję przechodzenia do roztworu w postaci jonów Mn+. Tendencji tej przeciwstawia się dążenie jonów Mn+ do wydzielania się z roztworu w postaci zredukowanej M. W rezultacie ustala się równowaga między metalem zanurzonym w roztworze zawierającym jony tego metalu a tymi jonami.
Równowagę tę można zapisać równaniem:
M ↔ Mn+ + ne-
lub w postaci ogólnej:
red ↔ utl + ne-
przy czym „red” oznacza postać zredukowaną, „utl” - postać utlenioną, n - liczbę elektronów biorących udział w reakcji.
Zjawiska zachodzące na granicy faz metal - roztwór są źródłem potencjału, którego wielkość
określa równanie Nernsta:
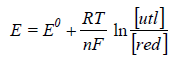
(1)
w którym E0 oznacza potencjał normalny elektrody, R - stałą gazową, T - temperaturę bezwzględną roztworu, n - liczbę elektronów biorących udział w reakcji, F - stałą Faradaya. (nawiasy kwadratowe oznaczają stężenia molowe).
Równanie (1) wyraża potencjał dowolnej elektrody. Jest to wielkość, której absolutnej wartości nie można ani zmierzyć, ani obliczyć teoretycznie. Można natomiast wyrazić liczbowo wielkość potencjału danej elektrody w stosunku do potencjału innej elektrody, mierząc siłę elektromotoryczną (SEM) ogniwa utworzonego z badanej elektrody i elektrody porównawczej. Za równy zeru został przyjęty umownie potencjał normalnej elektrody wodorowej i w stosunku do niego wyznacza się potencjały innych elektrod.
Równanie (1) można przekształcić, wprowadzając liczbowe wartości stałych R, T i F oraz zastępując logarytm naturalny logarytmem dziesiętnym:
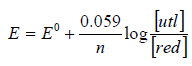
(2)
Bardziej ścisłe równanie, wyrażające potencjał elektrody, powinno zawierać aktywności zamiast stężeń. Gdy postacią zredukowaną jest metal elektrody, zgodnie z zasadą, że faza stała ma aktywność równą 1, uproszczony wzór Nernsta (2) przyjmie postać:
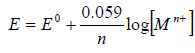
(3)
Jest to przypadek elektrody pierwszego rodzaju.
Powstawanie potencjału na granicy elektroda - roztwór dla elektrod pierwszego, drugiego, trzeciego i czwartego rodzaju jest wynikiem reakcji redoks. Powstawanie potencjału na granicy elektroda - roztwór w elektrodach jonoselektywnych, jak już wspomniano, jest wynikiem wymiany jonowej pomiędzy membraną a roztworem.
Elektrody wskaźnikowe
Pod pojęciem elektrody wskaźnikowej rozumiemy takie półogniwo, którego potencjał zależy zgodnie z równaniem Nernsta od stężenia (ściślej aktywności) oznaczanego jonu. Jako elektrody wskaźnikowe mogą być użyte wszystkie wymienione już elektrody, a więc elektrody I, II, III rodzaju, elektrody utleniająco-redukujące oraz elektrody jonoselektywne (ISE).
Elektrody porównawcze
Dobra elektroda porównawcza powinna posiadać następujące właściwości:
- stałość potencjału na przestrzeni długiego czasu w warunkach pomiaru;
- odtwarzalność potencjału i brak histerezy temperaturowej;
- łatwość sporządzenia z materiałów i odczynników dostępnych w każdym laboratorium;
- mały opór elektryczny;
- odporność mechaniczną niezbędną przy częstym użyciu.
Jako elektroda porównawcza największe znaczenie teoretyczne ma normalna elektroda wodorowa (NEW). Jest to blaszka platynowa pokryta czernią platynową, omywana wodorem pod ciśnieniem 760 mm Hg i zanurzona w roztworze kwasu solnego o aktywności równej 1: Pt, H2 (760 mm Hg) H+ | (aH+). Reakcje zachodzące na tej elektrodzie można przedstawić równaniem analogicznym do równania opisującego procesy zachodzące na elektrodach metalowych.
H2 ↔ 2H+ + 2e
Nie jest ona jednak wygodna w użyciu i w praktyce stosuje się najczęściej nasyconą elektrodę kalomelową (NEK) i chlorosrebrową. Obie są elektrodami drugiego rodzaju.
Elektroda kalomelowa
Elektrodę kalomelową stanowi drut platynowy będący w kontakcie z rtęcią metaliczną pokrytą warstwą chlorku rtęci(I) Hg2Cl2 (kalomelu), zanurzoną w nasyconym roztworze chlorku potasu. Półogniwo takie można zapisać: Hg, Hg2Cl2(s)|nas. KCl.
Przemiany zachodzące na elektrodzie można przedstawić równaniem:
Hg2Cl2 + 2e ↔ 2Hg + 2Cl−
Elektrody jonoselektywne
Elektrodami jonoselektywnymi nazywa się elektrody, których potencjał zależy liniowo od logarytmu aktywności danego jonu w roztworze (w określonym przedziale stężeń). Zależność prostoliniowa utrzymuje się na ogół w zakresie kilku rzędów stężenia (3 - 4). Wspólną ich cechą jest to, że na ich potencjał ma wpływ nie tylko stężenie jonu oznaczanego, lecz także stężenia innych jonów. Elektrody te są zaopatrzone w membranę jonowymienną, która oddziela odpowiednie półogniwo od roztworu badanego. Na potencjał elektrody membranowej składa się potencjał międzyfazowy na granicy faz membrana-roztwór, uwarunkowany wymianą jonową między roztworem i membraną, oraz potencjał dyfuzyjny, wynikający z procesów zachodzących wewnątrz membrany, szczególnie w jej warstwie przylegającej do roztworu.
Elektrody jonoselektywne różnią się szczegółami konstrukcyjnymi, m.in. stanem skupienia fazy tworzącej membranę. Elektrody te dzielimy na:
- elektrody ze szklanymi membranami - elektrody szklane,
- elektrody ze stałymi membranami, (membrany homogeniczne - monokrystaliczne i heterogeniczne - polikrystaliczne),
- elektrody z membranami ciekłymi,
- elektrody z podwójnymi membranami - elektrody czułe na gazy i elektrody enzymatyczne.
Elektroda szklana
Elektroda szklana - jonoselektywna elektroda czuła na jony wodorowe, jest to półogniwo, w którym membrana jest wykonana ze specjalnego gatunku szkła sodowego. Zwykle jest to wąska rurka szklana zakończona cienkościenną membraną w kształcie bańki. Wewnątrz znajduje się roztwór buforowy o dokładnie znanym pH, zawierający chlorki. W roztworze tym jest zanurzona porównawcza (wyprowadzająca) elektroda wewnętrzna o stałym potencjale, zwykle chlorosrebrowa, która posiada wyprowadzenie na zewnątrz. W przypadku elektrody szklanej różnica potencjałów między szkłem i roztworem stykającym się z nim, zależy od pH tego roztworu. Zależność ta daje się wyrazić wzorem słusznym dla odwracalnej elektrody wodorowej (równanie 4).
![]()
(4)
gdzie: E0sz - potencjał normalny charakterystyczny dla danego rodzaje szkła.
Elektroda szklana zawiera dwie powierzchnie graniczne szkło - roztwór i gdyby E0sz było jednakowe dla obu tych powierzchni, to różnica potencjałów między roztworami po obu stronach szklanej membrany zależna byłaby tylko od stosunku aktywności jonów wodorowych w tych roztworach.
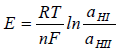
(5)
Potencjał elektrody szklanej zależy jedynie od aktywności jonów wodorowych w roztworze, do którego elektroda została zanurzona. Zależność tę wyraża wzór analogiczny do wzoru (4), w którym E0sz jest stał zależną od rodzaju elektrody wewnętrznej i pH elektrolitu wewnętrznego. Jeżeli elektrodę szklaną zanurzyć do roztworu takiego jaki znajduje się wewnątrz elektrody i jako elektrodę porównawczą zastosować elektrodę taką samą jak we wnętrzu bańki, to SEM utworzonego ogniwa zgodnie ze wzorem (5) powinna równać się zeru. Praktycznie okazuje się jednak, że występuje pewna niewielka SEM równa ± 2 mV. Wielkość ta jest nazwana potencjałem asymetrii, który spowodowany jest nieidentycznością powierzchni zewnętrznej i wewnętrznej szklanej membrany (E0sz różne dla obu powierzchni). Potencjał asymetrii ulega zmianom w okresie eksploatacji elektrody i dlatego elektrodę szklaną należy kalibrować we wzorcowych roztworach buforowych o znanych wartościach pH, sporządzając krzywą kalibracyjną, która jest charakterystyką elektrody.
Wyznaczenie charakterystyki elektrody szklanej polega na ustaleniu dla niej zależności SEM od pH szeregu wzorcowych roztworów buforowych tj. określeniu zakresu jej stosowalności i nachylenia. Jeżeli zależność ta przebiegałaby w myśl równania (4), to charakterystyka elektrody byłaby linią prostą w całym zakresie pH. Faktycznie dla najczęściej stosowanych elektrod prostoliniowość występuje w zakresie pH 1 - 9 a często do 12 pod warunkiem, że roztwór nie zawiera zbyt dużo soli metali alkalicznych. Odchylenie od prostoliniowości w roztworach silnie kwaśnych i silnie alkalicznych wynika z niesłuszności wzoru (4) w tych warunkach. Odstępstwa od tego wzoru związane są ze zmianą aktywności wody jako rozpuszczalnika w stężonych roztworach oraz z dochodzenia do głosu innych mechanizmów ustalania się różnicy potencjałów między szkłem i roztworem niż za pośrednictwem samych tylko jonów wodorowych.
Nachylenie charakterystyki elektrody określa zmianę potencjału danej elektrody spowodowaną dziesięciokrotną zmianą aktywności (stężenia) jonu na który czuła jest dana elektroda. Dla elektrody szklanej jest to zmiana jej potencjału na jednostkę pH [mV/pH]. Dla elektrod czułych na jony jednowartościowe teoretyczne nachylenie charakterystyki, tzw. nernstowskie nachylenie wynosi 59,15 mV na dekadę zmiany aktywności (stężenia) tych jonów w temperaturze 25°C (298 K).
Elektroda chinhydronowa
Elektroda chinhydronowa to półogniwo zbudowane z elektrody platynowej zanurzonej w roztworze chinhydronu, czyli równomolowym roztworze chinonu i hydrochinonu.
Elektroda chinhydronowa jest odwracalna względem jonów hydroniowych i jest elektrodą redoks, na której cząstkową reakcją potencjałotwórczą jest wymiana elektronów i protonów między chinonem a hydrochinonem wg reakcji:
Elektroda antymonowa
Elektroda antymonowa - elektroda stosowana w potencjometrii jako elektroda wskaźnikowa czuła na jony wodorowe (pH), zbudowana z metalicznego antymonu (pręcik Sb), którego powierzchnia pokrywa się - wskutek utleniania w powietrzu - warstwą tlenku Sb2O3; elektroda jest czuła na zmiany pH w zakresie pH = 3-8.
Na granicy między badanym roztworem i powierzchnią elektrody ustala się równowaga:
Klasyczne równanie Nernsta w postaci:
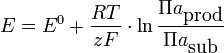
gdzie:
R - stała gazowa,
F - stała Faradaya,
T - temperatura, K
a - aktywności produktów i substratów w roztworze upraszcza się w tym przypadku do postaci:
Możliwość uproszczenia wynika z założeń:
aktywność reagentów stałych (Sb i Sb2O3) jest równa jedności,
temperatura T = 298 K,
stężenie jonów wodorowych jest na tyle małe, że aktywność (a) można zastąpić wartością stężenia [H+].
Potencjał standardowy elektrody antymonowej wynosi 0,152 V.
Zaletą elektrody jest łatwość przygotowanie i trwałość (używanie nie wymaga specjalnej ostrożności). Wadą jest zależność potencjału od takich czynników, jak stan powierzchni elektrody (np. sposób oczyszczania) lub intensywność mieszania roztworu. Trudność dokładnego odtworzenia wartości potencjału nie ogranicza możliwości stosowania elektrody do obserwacji zmian potencjału E (np. zachodzących w czasie miareczkowania potencjometrycznego).
Doświadczenie
Na początku stworzyliśmy 8 roztworów buforowych (o znanym pH), zgodnie z instrukcją przedstawioną na zajęciach. Następnie zmierzyliśmy za pomocą elektrod: szklanej, chinhydronowej i antymonowej ich SEM. Wtedy też rozlaliśmy Zadanie 1, Zadanie 2 i Zadanie 3 do oddzielnych probówek i również zmierzyliśmy ich SEM.
Tabele z wynikami pomiarów:
pH roztworu |
SEM (mW) ogniwa z elektrodą |
||
buforowego |
szklaną |
chinhidronową |
antymonową |
1,81 |
16,5 |
261,7 |
-220,8 |
2,21 |
23 |
90,8 |
-250,2 |
3,29 |
-53,4 |
174,2 |
-339 |
4,56 |
-106,1 |
238,3 |
-403,4 |
5,72 |
-188,8 |
102,7 |
-480,5 |
6,8 |
-230,3 |
63,1 |
-515,9 |
7,96 |
-311,2 |
-29,5 |
-593 |
9,15 |
-376,9 |
-103,9 |
-633,9 |
SEM (mW) ogniwa z elektrodą |
||
szklaną |
Chinhidronową |
antymonową |
-291,6 |
-22,7 |
-555,9 |
-154,4 |
46,7 |
-345,8 |
-188,9 |
41,6 |
-476,7 |
Wykres E (mV) = f (pH) dla wszystkich elektrod na wspólnym wykresie.
Wartości E0 dla poszczególnych ognich oraz nachylenie charakterystyk elektrod
E0 odczytane z wykresu
E0 |
||
Elektroda z ogniwem |
||
szklanym |
Chinhidrynowym |
antymonowym |
132,4069 |
302,024 |
-136,38 |
Nachylenie charakterystyk elektrod
Wzór:
|
Elektroda z ogniwem |
||
|
szklanym |
chinhidrynowym |
antymonowym |
|
64,03696 |
22,27846 |
46,64075 |
|
49,50539 |
95,57647 |
51,50215 |
|
56,47626 |
38,85228 |
61,58655 |
|
52,30415 |
13,97456 |
58,55696 |
|
56,15505 |
34,84685 |
60,1608 |
|
53,33925 |
35,13588 |
55,81173 |
|
55,72951 |
41,64874 |
57,36429 |
|
55,66196 |
44,36328 |
54,37374 |
|
55,40107 |
40,83457 |
55,74962 |
Przykładowe obliczenia:
pH badanych roztworów wyznaczone graficznie oraz obliczone ze wzoru
Aby wyznaczyć pH graficznie należy wykorzystać równanie prostej dla elektrody z danym ogniwem i wyznaczyć x (czyli pH)
Wzór:
Drugą metodą było wyznaczenie pH z poniższego wzoru
Wzór:
pH elektrody z ogniwem |
|||||
szklanym |
szklanym |
szklanym |
|||
Graficznie |
Ze wzoru |
Graficznie |
Ze wzoru |
Graficznie |
Ze wzoru |
7,6958806 |
7,6534069 |
8,324754 |
7,952184 |
7,422254 |
7,525069 |
5,205650366 |
5,1769203 |
6,545588 |
6,252644 |
3,705109 |
3,756434 |
5,831837998 |
5,799652 |
6,676334 |
6,377538 |
6,021027 |
6,104432 |
Przykładowe obliczenia:
pH otrzymanego graficznie:
pH otrzymanego ze wzoru:
Wnioski:
Charakterystyki elektrod: szklanej i antymonowej wyraźnie wykazują charakter liniowy. Charakterystyka elektrody chinhydronowej zaś wykazuje charakter liniowy dopiero od wartości pH=4,56. Jest to związane ze zwiększającym się stopniem dysocjacji roztworu chinhydronu.
Zadane było wyznaczenie pH badanych roztworów - zarówno metodą graficzną jak i obliczeniową ze wzoru, wyniki wyszły bardzo zbliżone do siebie. Nie wyszły identyczne z powodu uśrednionego wcześniej nachylenia charakterystyki elektrody (wartość k), która nie tyczyła się stricte danego pH roztworu.
Znaczący wynik przy pH dla Zadania 2 przy elektrodzie antymonowej może być spowodowany niedokładnością sprzętu pomiarowego (pojawienie się innych tlenków antymonu niż Sb2O3) oraz brakiem precyzji pomiaru. Reszta wyników nie odbiega zbyt dużo od siebie nawzajem, co świadczy o poprawnym wykonaniu doświadczenia.
Wyszukiwarka
Podobne podstrony:
Sprawozdanie - Spektrofotometr 2, fizyczna, chemia fizyczna, Fizyczna, laborki, sprawozdanie 10, spr
Wyznaczanie charakterystyki elektrod, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki spr
Korelacja liniowa, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
Fizyczna ćw 4, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
Dane, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
Fizyczna ćw 6, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
Sprawozdanie ćwiczenie II, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania f
Aneta Kosinska sprawozdanie z fizy, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki spraw
doswiadczenie5 grajek, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyc
Spr5, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
cw 2, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
zbiorcze-krioskopia, semestr4, fizyczna, laborki, Sprawozdania
lepkość(1), semestr4, fizyczna, laborki, Sprawozdania
zbiorcze-StałaMetodąPodziałuNernstaJod, semestr4, fizyczna, laborki, Sprawozdania
trójkąt Gibbsa, semestr4, fizyczna, laborki, Sprawozdania
zbiorcze-krioskopia, semestr4, fizyczna, laborki, Sprawozdania
20, Mechanika i Budowa Maszyn PWR MiBM, Semestr I, Fizyka, laborki, sprawozdania z fizykii, fiza lab
więcej podobnych podstron