Oznaczanie żelaza (III) metodą spektrofotometryczną za pomocą kwasu sulfosalicylowego
Martyna Rączy
Katarzyna Rogus
Joanna Ruszel
Martyna Rączy |
Analiza Instrumentalna |
Katarzyna Rogus |
Oznaczanie żelaza (III) metodą spektrofotometryczną za pomocą kwasu sulfosalicylowego |
Joanna Ruszel |
|
|
Ocena: |
WSTĘP TEORETYCZNY
Spektrofotometria jest techniką instrumentalną, w której do celów analitycznych wykorzystuje się przejścia energetyczne zachodzące w cząsteczkach, spowodowane absorpcją promienia elektromagnetycznego w zakresie nadfioletu (UV, 200-380 nm.), widzialnym (VIS, 380-780 nm.) lub bliskiej podczerwieni (0, 78-30000 µm) . W analizie nieorganicznej zastosowanie znajduje głównie spektrofotometria UV i VIS.
Ugrupowania atomów z wielokrotnymi wiązaniami, stwarzającymi możliwość absorbowania światła nazywane są chromoforami. Do typowych chromoforów należą, np.: grupa ketonowa, etylenowa, nitrowa, azowa, nitrozowa oraz grupy aromatyczne.
Analiza ilościowa metodą spektrofotometrii, UV-VIS oparta jest na pomiarze absorbancji badanego roztworu przy określonej długości fali i wykorzystaniu prawa Lamberta-Beera.
Drugie prawo Bourgera-Lamberta-Beera, ( na którym opieramy się w naszym doświadczeniu) dotyczy absorpcji w roztworach jednoskładnikowych. W roztworze takim znajdują się dwa rodzaje cząsteczek: cząsteczki substancji rozpuszczonej i cząsteczki rozpuszczalnika. Kiedy współczynnik absorpcji rozpuszczalnika jest równy zeru, wartość absorbancji A wiązki monochromatycznej przechodzącej przez roztwór jednoskładnikowy jest wprost proporcjonalna do stężenia roztworu c i do grubości warstwy absorbującej l:
Prawo Beera stwierdza, że absorbancja jest proporcjonalna do stężenia substancji
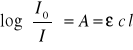
Prawa te opisuje równanie:
Gdzie: ε - molowy współczynnik absorpcji [wielkość charakterystyczna dla danej substancji przy danej długości fali, wyrażana w dm3/mol cm], c - stężenie molowe [mol/dm3], l - droga optyczna [cm].
ODCZYNNIKI I ROZTWORY
SIARCZAN (VI) ŻELAZA (III) I AMONU Fe(NH4)(SO4)2·12H2O
ROZTWÓR WZORCOWY ŻELAZA (1mg/cm3)
KWAS SIARKOWY
5% ROZTWÓR KWASU SULFOSALICYLOWEGO
APARATURA
Podstawowymi elementami aparatury spektrofotometrycznej UV/VIS są:
Źródło promieniowania ( lampa wodorowa, deuterowa, wolframowa, ksenonowa,)
Monochromator (siatka dyfrakcyjna, pryzmat)
Kuweta, w której umieszczony jest badany roztwór
Detektor (fotopowielacz, fotokomórka)
Układ pomiarowy ( galwanometr, mikroprocesor)
Blokowy schemat spektrometru
W doświadczeniu użyto spektrometru „SPEKOL 11” wyprodukowany przez firmę Carl Zeiss z Jeny. Dzięki temu urządzeniu jesteśmy w stanie dokonać pomiarów absorbancji w zakresie 340-850 nm. Aparatura wyposażona jest w lampę żarową, która zapewnia źródło światła, dzięki zastosowane siatce dyfrakcyjnej aparat emituje monochromatyczne światło konieczne do przeprowadzenia doświadczenia. Jako wyposażenie dodatkowe oferowane są przystawki do pomiarów fluorescencyjnych, nefelometrycznych, kuli całkującej itp.

okienko wskaźnikoweKlawiatura do wprowadzania danych do pamięci
Klawiatura do wyboru rodzaju pomiaru
Zmieniacz próbek
Uchwyt do przesuwania fotokomórki
Obudowa fotokomórek
Wyłącznik sieciowy
Pokrętło do zmiany długości fali
Dźwignia włączająca filtr rozpraszający światło lub przysłony na szczelinę
PRZEBIEG OZNACZENIA
Przygotowanie krzywej wzorcowej:
Podstawowy roztwór żelaza (III) (1mg/cm3 roztworu)
Rozpuszczono 0, 8630g Fe(NH4) (SO4)2·12H2O w wodzie destylowanej z dodatkiem 0,5cm3 stężonego kwasu siarkowego i rozcieńczono roztwór wodą w kolbie miarowej do pojemności 100cm3
Roboczy roztwór żelaza (III)
5cm3 roztworu podstawowego przeniesiono do kolby miarowej o poj. 100ml i uzupełniono
0,005 M H2SO4 do kreski
Wzorcowe roztwory żelaza (III)
Do kolbek miarowych o pojemności 50cm3 pobrano ilościowo: 5, 7, 9, 11, 15, 20 cm3 roztworu roboczego. Do każdej kolbki dodano po 10 cm3 wody destylowanej, 1 cm3 roztworu HNO3 (1: 1), 1 cm3 2n H2SO4 oraz 10 cm3 5% roztworu kwasu sulfosalicylowego, a następnie uzupełnić wodą destylowaną do kreski. Roztwory dokładnie wymieszać. Przygotować również roztwór ślepej próby.
Ustalenie diagnostycznej długości fali promieniowania.
Na spektrometrze SPECOL ustalamy długość fali odpowiadającą maksymalnej absorpcji promieniowania dla roztworu o największym stężeniu, używając roztworu ślepej próby, jako odnośnika
Pomiary absorbancji roztworów wzorcowych
Wykonujemy pomiary absorpcji promieniowania dla roztworów wzorcowych żelaza (III).Przy ustalonej długości fali λ=510 nm. Dla każdego stężenia wykonujemy trzy powtórzenia.
WYKONANIE OZNACZENIA BADANEJ PRÓBKI
Otrzymany roztwór w kolbie miarowej dopełniono do objętości 100cm3 i wymieszano. Pobrano 20cm3 do kolbki o pojemności 50cm3 a następnie dodano 10cm3 wody destylowanej, po 1cm3 roztworu HNO3 (1: 1) i roztworu H2SO4 2n oraz 10cm3 5% kwasu sulfosalicylowego. Kolejno uzupełniono wodą destylowaną do kreski i dobrze wymieszano. Absorbancję roztworu zmierzono stosując, jako odnośnik ślepą próbę przy tej samej długości fali.
TABLICA WYNIKÓW
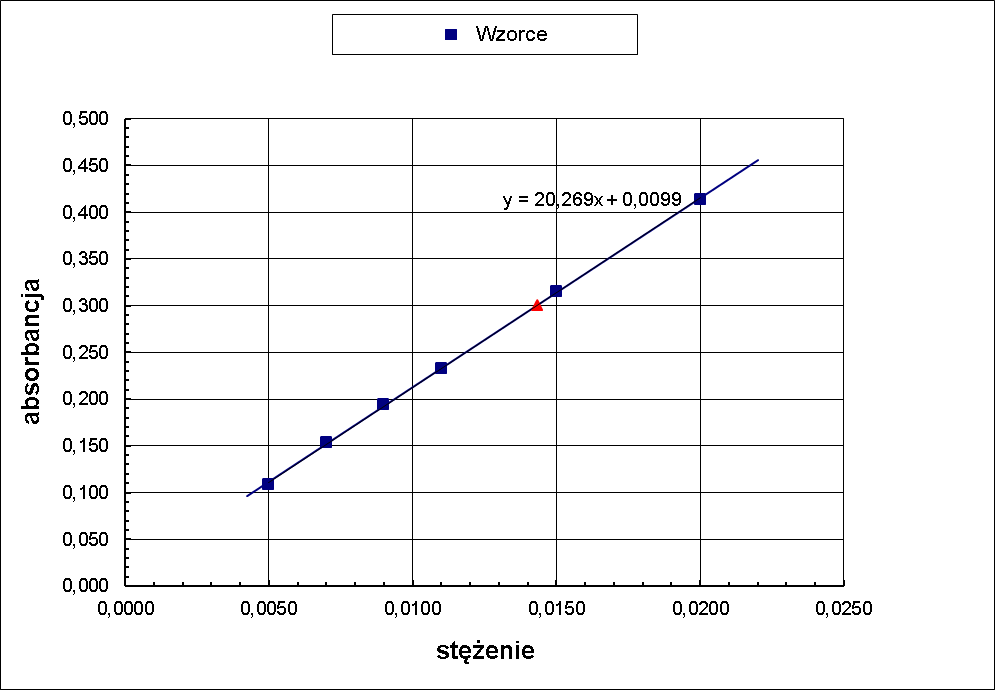
Krzywa wzorcowa
Stężenie |
ABSORBANCJA |
|||
|
I pomiar |
II POMIAR |
III POMIAR |
ŚREDNIA |
0,005 |
0,109 |
0,108 |
0,108 |
0,108 |
0,007 |
0,153 |
0,152 |
0,154 |
0,153 |
0,009 |
0,195 |
0,194 |
0,194 |
0,194 |
0,011 |
0,234 |
0,234 |
0,234 |
0,234 |
0,015 |
0,316 |
0,314 |
0,314 |
0,315 |
0,020 |
0,414 |
0,414 |
0,414 |
0,414 |
Matematyczna postać krzywej wzorcowej: korelacja danych 1,000
ABSORBANCJA= 20,26899 x stężenie + 0,0099
ABSORBANCJA |
|||
I POMIAR |
II POMIAR |
III POMIAR |
ŚREDNIA |
0,303 |
0,299 |
0,300 |
0,301 |
Wykres:
Opracowanie wyników
Stężenie substancji w próbce: 0,014338 ± 0,0001274 mg/ml
Stężenie w kolbie 50cm3
C= 0,014338 × 50 = 0,7169 mg/cm3
Zawartośc żelaza w badanym roztworze uwzględniając objętość kolby - 100cm3 i objętośc badanej próbki- 20cm3
c =0,7169 mg/cm3 - w próbce 20cm3
m = (0,7169×100)/20 = 3,5845 mg
WNIOSKI
Dzięki analizie spektrofotometrycznej oraz technice krzywej wzorcowej jesteśmy w stanie wyznaczyć stężenie nieznanej, otrzymanej do analizy próbki żelaza (III). Następnie dzięki stężeniu ilość tegoż żelaza (III).
Otrzymane przez nas wyniki przedstawiają się następująco:
Stężenie 0, 014338 mg/ml
Masa Fe (III) 3,5845 mg
Otrzymane przez nas wyniki świadczą o poprawnym wykonaniu doświadczenia. Niedokładne wartości wyników mogą być spowodowane błędną interpretacją lub niedokładnością urządzeń pomiarowych.
Wyszukiwarka
Podobne podstrony:
7131 TSCM 52 2 parte (1 5)
7131
7131
7131
7131
7131
7131
7131
7131 TSCM 52 2 parte (1 5)
7131
więcej podobnych podstron