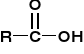
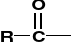
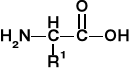
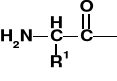
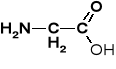
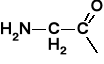
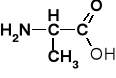
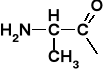
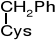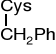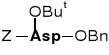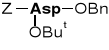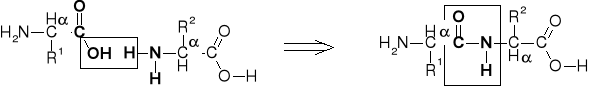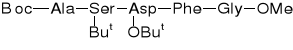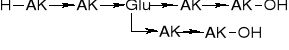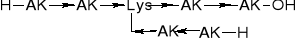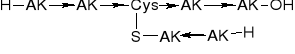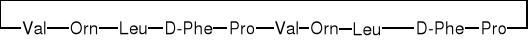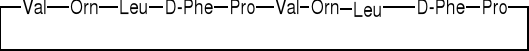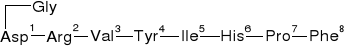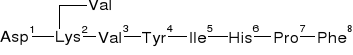AMINOKWASY I PEPTYDY
Tabela 1. Reprezentatywne aminokwasy i ich reszty aminoacylowe |
|||
|
|
|
|
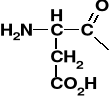
K. karboksylowy [R=CH3 - k. octowy; acetic acid] |
Grupa acylowa; acyl [R=CH3 - acetyl] |
K. aminokarboksylowy |
Grupa aminoacylowa; aminoacyl
|
|
|
|
|
Glicyna |
Glicyl |
Alanina |
Alanyl |
|
|
|
|
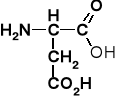
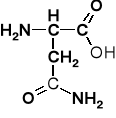
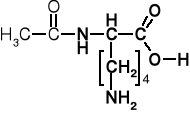
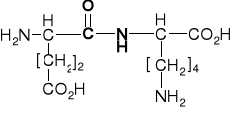
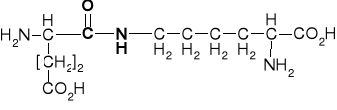
K. asparginowy |
aspartyl |
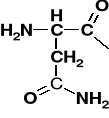
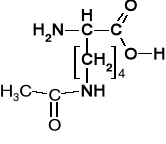
Aspargina |
Asparaginyl |
Tabela 2. Symbole reszt i pochodnych aminokwasowych |
||
STRUKTURA |
SKRÓT |
NAZWA |
|
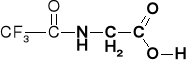
Tfa-Gly
|
N -trifluoroacetylo-glicyna
|
|
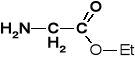
Gly-OEt
|
ester etylowy glicyny
|
|
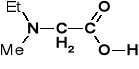
EtMe-Gly
|
N-etylo-N-metylo-glicyna
|
|
|
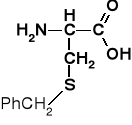
S-benzylocysteina
|
|
|
|
|
|
|
|
|
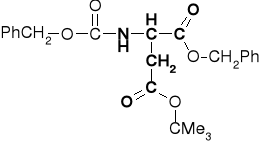
Ester α-benzylowy-β-tert-butylowy kwasu N-benzyloksy-karbonylo- asparaginowego |
|
|
|
|
|
|
|
|
N-α-acetylolizyna |
|
|
N-ε-acetylolizyna |
|
|
|
|
|
|
3. PEPTYDY |
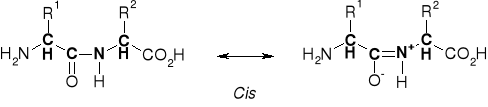
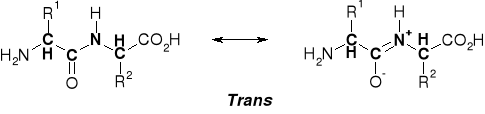
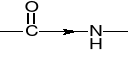
3.1. WIĄZANIE PEPTYDOWE |
|
3.1.1. TYPY WIĄZANIA PEPTYDOWEGO |
|
|
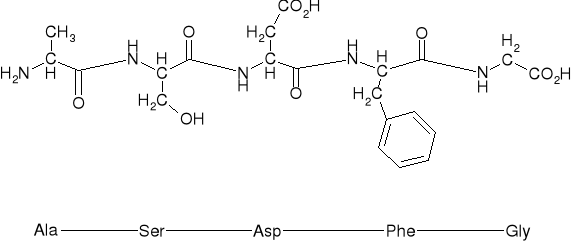
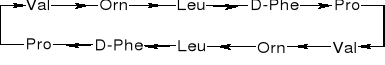
3.2. STRUKTURA PIERWSZORZĘDOWA PEPTYDU [LICZBA I SEKWENCJA AK W PEPTYDZIE]
|
|||||
Gly-Ala |
Ala-Gly |
||||
Gly-Ala-Ser |
Ala-Gly-Phe |
||||
|
|||||
Alanylo- |
-serylo- |
-aspartylo- |
-fenyloalanylo- |
-glicyna |
|
|
|||||
Ala |
|
Gly |
|||
N-końcowy |
(wg. Bayley'a) |
C-końcowy |
|||
początkowy |
(wg. Fromageout'a) |
końcowy |
|||
|
|||||
3.4. Nomenklatura peptydów |
|
Ala-Ser-Asp-Phe-Gly |
Sekwencja pentapeptydu |
Ala-(Ser,Asp)-Phe-Gly |
Sekwencja (Ser,Asp) w pentapeptydzie nie znana |
-Ala-Ser-Asp-Phe-Gly- |
Sekwencja pięciu AK w peptydzie |
Nomenklatura peptydów wg. Greenstein'a & Winitz'a |
||
H-Ala-Ser-Asp-Phe-Gly-OH |
||
H2+-Ala-Ser-Asp-Phe-Gly-OH |
|
H2+-Ala-Ser-Asp-Phe-Gly-O- |
H2+-Ala-Ser-Asp-Phe-Gly-O- |
|
H-Ala-Ser-Asp-Phe-Gly-O- |
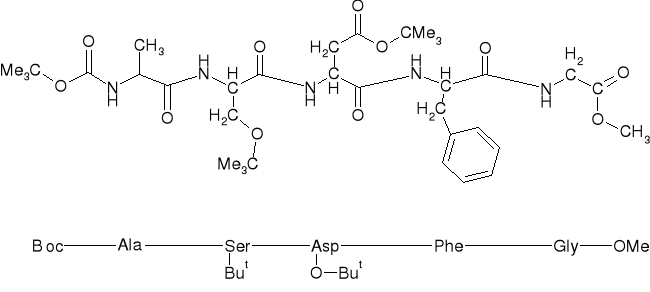
4. ZAPISY SEKWENCJI PEPTYDU BLOKOWANEGO |
|
|
|
|
|
|
Boc-Ala-Ser(But)-Asp(OBut)-Phe-Gly-OMe |
|
|
5. ZAPIS SEKWENCJI (STRUKTURY PIERWSZORZĘDOWEJ) PEPTYDU |
|
Ala-Ser-Asp-Phe-Gly |
Sekwencja pentapeptydu |
|
|
-Ala-Ser-Asp-Phe-Gly- |
Sekwencja pięciu AK w pentapeptydzie |
|
|
Ala-Ser-(Tyr, Phe, Arg, Pro)-Phe-Gly |
Sekwencja (AK) nie znana |
|
|
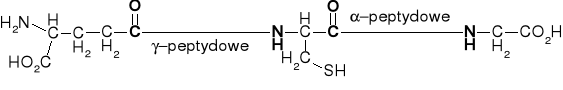
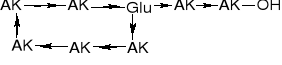
6. WIĄZANIA α-, γ- & ω-PEPTYDOWE |
|||||
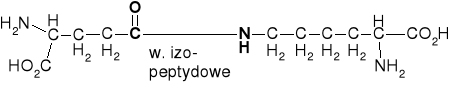
GLUTAMYLOLIZYNA |
|||||
|
|||||
|
|
|
|||
γ-Glutamylo-Nε-lizyna |
|||||
|
|
||||
|
|
lub |
|
||
Glutamylolizyna |
α-Glutamylo-Nε-lizyna |
||||
|
|||||
Glutation (zredukowany) |
|||||
|
lub |
|
|||
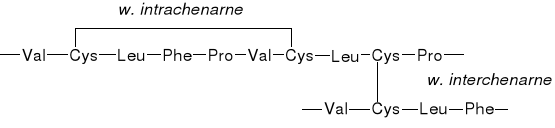
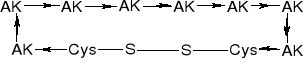
WIĄZANIA DISIARCZKOWE |
|||||
|
|||||
7. PODZIAŁ PEPTYDÓW ZE WZGLĘDU NA STRUKTURĘ |
|
ZALEŻNIE OD SKŁADU PEPTYDU: |
|
1. PEPTYDY HOMEOMERYCZNE |
2. PEPTYDY HETEROMERYCZNE |
Złożone wyłącznie z aminokwasów |
Zawierają dodatkowe elementy strukturalne (np. hydroksykwasy, reszty kwasów tłuszczowych, itp.). Oprócz wiązań peptydowych zawierają w. estrowe, tioestrowe, di siarczkowe, etc. |
7.1. STRUKTURA PEPTYDÓW HOMEOMERYCZNYCH |
|
1.1. PEPTYDY HOMEOMERYCZNO-HOMODETYCZNO - wiązania peptydowe |
1.2. PEPTYDY HOMODETYCZNO-HETERODETYCZNE - wiązania peptydowe i inne |
1.1. PEPTYDY HOMEOMERYCZNO-HOMODETYCZNO |
|||
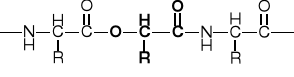
1.1.1. Peptydy liniowe |
1.1.2. Peptydy rozgałęzione |
1.1.3. Peptydy cykliczne |
|
1.1.1. Peptyd liniowy |
|||
|
|||
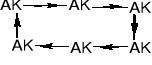
1.1.2. Peptyd rozgałęziony |
|||
|
|
||
1.1.3. Peptydy cykliczne |
|||
1.1.3.1. Peptydy cykliczne nie-rozgałęzione |
1.1.3.2. Peptydy cykliczne rozgałęzione |
||
|
|
||
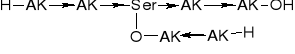
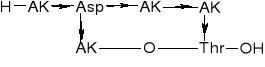
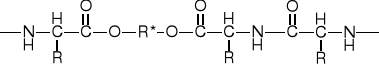
PEPTYDY HOMEOMERYCZNO-HETERODETYCZNE |
|
1. O-Peptyd liniowy |
2. S-Peptyd liniowy |
|
|
3. Peptyd cykliczny (disulfid) |
4. Peptyd cykliczny rozgałęziony (lakton peptydu) |
|
|
|
|
ZAPIS SEKWENCJI CYKLOPEPTYDU HOMEOMERYCZNEGO TYPU HOMODETYCZNEGO |
1.
|
2a.
|
2b.
|
|
|
|
2. PEPTYDY HETEROMERYCZNE |
|
2.1. DEPSIPEPTYDY (zawierające w. estrowe) Nazwa Depsipeptydy zaproponowal Szemiakin w 1953 roku. Jest kombinacją terminów depsyd (ester hydroksykwasu) i peptyd. |
|
|
|
2.2. PEPTOLIDY (zawierające hydroksykwasy) |
|
|
|
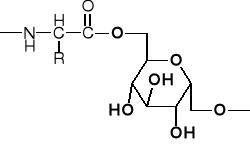
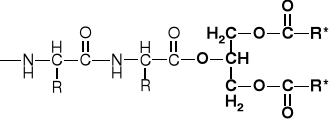
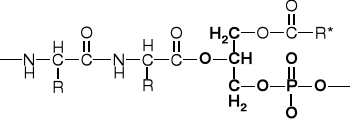
2.3. PEPTOIDY (np. lipo-, gliko-, fosfo-peptydy) |
|
|
|
GLIKO-PEPTYDY |
LIPO-PEPTYDY |
|
|
FOSFO-PEPTYDY |
|
8. PODZIAŁ PEPTYDÓW ZE WZGLĘDU NA EFEKT FIZJOLOGICZNY |
||
1. |
Hormony peptydowe |
|
|
Trzustki (insulina, glukagon) |
|
|
Tarczycy (andrenokortykotropina) |
|
|
Przytarczki (tyrokalcytonina) |
|
|
Przewodu żołądkowo-jelitowego - niegruczołowe hormony peptydowe (gastryna) |
|
2. |
Neuropeptydy |
|
|
Neurotransmitery |
|
|
Neuromodulatory |
|
|
Endogenne peptydy opiatowe |
|
9. NAZEWNICTWO PEPTYDÓW BIOLOGICZNIE/ FARMAKOLOGICZNIE WAŻNYCH
|
|
Angiotensyna II |
|
Angiotensyna - hormon peptydowy wchodzący w skład układu hormonalnego RAA, ktorego zadaniem jest kontrola stężenia jonow sodowych i potasowych w organizmie. Angiotensyny stymulują wydzielanie mineralokortykosteroidu aldosteronu. |
|
Asp1-Arg2-Val3-Tyr4-Ile5-His6-Pro7-Phe8 |
|
1. Wymiana reszty aminokwasowej |
|
Asp1-Arg2-Val3-Phe4-Ile5-His6-Pro7-Phe8 |
[Phe4]angiotensyna II |
Asp1-Lys2-Val3-Tyr4-Ile5-His6-Pro7-Phe8 |
[Lys2]angiotensyna II |
2. Przedłużenie łańcucha peptydu |
|
Arg-Asp1-Arg2-Val3-Tyr4-Ile5-His6-Pro7-Phe8 |
Arg-angiotensyna II; Arginyloangiotensyna II |
Asp1-Arg2-Val3-Tyr4-Ile5-His6-Pro7-Phe8-Met |
Angiotensylo-Met; Angiotensylo-metionina |
3. Włączenie dodatkowej reszty aminokwasowej (endo) |
|
Asp1-Arg2-Gly2a-Val3-Tyr4-Ile5-His6-Pro7-Phe8 |
Endo-Gly2a-angiotensyna II; Endo-2a-glicyloangiotensyna II; |
4. Opuszczenie reszty aminokwasowej (dez) |
|
Asp1-Arg2-Val3-Ile5-His6-Pro7-Phe8 |
Dez-Tyr4-angiotensyna II; Dez-4-tyrozyna-angiotensyna II |
5. Sekwencje cząstkowe |
|
Arg2-Val3-Tyr4-Ile5-His6-Pro7 |
Angiotensyna II- -(2-7)-heksapeptyd |
6. Podstawienie w łańcuchach bocznych |
|
|
Cβ1-Gly-angiotensyna II; Cβ1-Glicyloangiotensyna II |
Asp1-Lys2-Val3-Phe4-Ile5-His6-Pro7-Phe8 |
[Lys2]angiotensyna II |
|
Nε2-Val-[Lys2]angiotensyna II; Nε2-walilo-[Lys2]angiotensyna II |
11
Wyszukiwarka
Podobne podstrony:
BIO-HETEROCYKLE, biochemia, kolokwium - wyklad
Biochemia - kolokwium[1], Studia, Semestr III, Biochemia, Wykłady
BIOCHEMIA - VII - 13.11.2000, materiały medycyna SUM, biochemia, Kolokwium III, wykłady do II
07 -13.11.2000witaminy dalej i pierw śladowe, materiały medycyna SUM, biochemia, Kolokwium III, wykł
06 - 6.11.2000 witaminy dalej, materiały medycyna SUM, biochemia, Kolokwium III, wykłady do III kolo
Biochemia - VI - 6.11.2000, materiały medycyna SUM, biochemia, Kolokwium III, wykłady do III kolokw
PEPTYDY-GENERAL, CHEMIA UŁ, 3 rok, Biochemia
Biochemia TZ wyklad 12 integracja metabolizmu low
BIOCHEMIA KOLOKWIUM I POPRAWKA Nieznany (2)
węglowodany pytania, Medycyna ŚUM, Rok 2, Biochemia, Kolokwia, 5 Węglowodany
biochemia I koło wykładowe, 2 rok, Biochemia
Inhibitory enzymów jako leki, materiały medycyna SUM, biochemia, Kolokwium II
ABC A1, materiały medycyna SUM, biochemia, Kolokwium VI
biochemia kolokwium 1
Biochemia kolokwium 1
Biochemia TZ wyklad 3 enzymy low
węglowodany opracowanie, Medycyna ŚUM, Rok 2, Biochemia, Kolokwia, 5 Węglowodany
więcej podobnych podstron