34. Pojęcie ciepła. Ciepło bez zmian stanu skupienia. Ciepło przy zmianach temperatury i przy zmianach stanu skupienia
Ciepło jest to ta część energii wewnętrznej przekazywana od ciała cieplejszego do ciała chłodniejszego, która odbywa się w oparciu o mikroskopowy mechanizm zderzeń między cząsteczkami/atomami. Ciepło zawsze przepływa od ciała o wyżej temperaturze, do ciała o niższej temperaturze. Pojęcie ciepła nie jest wcale łatwe do zrozumienia. W szczególności warto zapamiętać, że żadne ciało ciepła nie "posiada". Ciepło może być tylko przekazywane.
Podczas ogrzewania (dostarczania ciepła) bez zmiany stanu skupienia dochodzi do wzrostu temperatury ciała. W przypadku odwrotnym - oziębiania - temperatura maleje.
Większość substancji (ciała stałe, ciecze, gazy) reaguje zmianą na dostarczone ciepło w sposób proporcjonalny - tzn. np. 2 razy większe dostarczone ciepło powoduje 2 razy większy przyrost temperatury. Rządzi tym wzór:
Q = m cw Δt
Q - ciepło pobierane/oddawane przez ciało podczas ogrzewania/oziębiania - układzie SI wyrażone w dżulach J
m - masa substancji - układzie SI wyrażone w kilogramach
cw - ciepło właściwe tej substancji - układzie SI wyrażone w J/Kg∙K
Δt = tkońc - tpocz (przy ogrzewaniu) przyrost temperatury - jednostka w układzie SI: kelwin K
Δt = tpocz - tkońc (przy oziębianiu) zmiana temperatury - jednostka w układzie SI: kelwin K
Uwagi:Powyżej zdefiniowane wartości dla Δt wiążą się z sytuacją, gdy wzór jest wykorzystywany do obliczeń w bilansie cieplny. Wtedy wartość ciepła powinna być podstawiana jako dodatnia. Jednak jest to tylko konwencja.
W przypadku gdy nie zachodzą żadne dodatkowe procesy, to najczęściej wyznaczane w tym wzorze ciepło jest równe po prostu zmianie energii wewnętrznej ogrzewanego ciała.
Ciepło Q
![]()
Po dostarczeniu określonej ilości ciepło Q do ciała o masie m jego temperatura wzrasta o ΔT
![]()
![]()
- ciepło właściwe ciała (bez zmiany stanu skupienia ) ![]()
Uwagi:
-ciepło jest to coś co przenosi się miedzy otoczeniem i układem w wyniku istnienia jedynie różnicy temperatur
-fachowo mówiąc, ciepło jest po prostu jedną z form energii (wyrażoną oczywiście w J) równoważną innym jej formom (energii mechanicznej , elektrycznej …),
-Czasami ciepło (energię) wyraża się w kaloriach (jedna kaloria to ilość ciepła potrzebna do podgrzania 1g wody z 14,5![]()
C do 15,5![]()
C):
1cal = 4,186
35. Przewodnictwo cieplne
Przewodnictwo cieplne czyli transport energii wskutek ruchu cząstek w kierunku obszaru o niższej T (dążenie do wyrównania temperatury). Równanie transportu ciepła ma postać j= -KdT/dx ,gdzie j -gęstość strumienia ciepła, dT/dx jest różnicą temperatur w warstwie ciała o grubości dx, a κ jest współczynnikiem przewodnictwa cieplnego.
36. I zasada termodynamiki
Wnioski:
- Ciepło Q i praca W to dwie równoważne formy energii, które po dostarczeniu do ciała mogą zmienić jego temperaturę
- Z temperaturą wiąże się pojęcie energii wewnętrznej ciała U [J] (w szczególności dla gazu doskonałego energia wewnętrzna zależy wyłącznie od temperatury (w skali Kelvina) i jest do niej proporcjonalna). Energia wewnętrzna jest miarą energii kinetycznej ruchu cząstek na poziomie mikroskopowym (ruchy postępowe, rotacyjne, oscylacyjne)
37. Model gazu doskonałego. Praca gazu.
Zatem czynimy następujące założenia dotyczące zachowania się gazu doskonałego:
• składa się z cząsteczek, które można traktować jako identyczne punkty materialne o określonych masach
• objętość cząsteczek jest pomijalna
• całkowita liczba cząsteczek jest bardzo duża,
• cząsteczki poruszają się chaotycznie i podlegają zasadom dynamiki Newtona,
• poza zderzeniami (ze ściankami naczynia i między sobą) cząsteczki nie podlegają żadnym oddziaływaniom,
zderzenia są idealnie sprężyste i nieskończenie krótkie.
38. Mikroskopowa interpretacja ciśnienia. Prawo Pascala.
- Ciśnienie - wielkość skalarna określona jako wartość siły parcia działającej prostopadle do powierzchni podzielona przez powierzchnię na jaką ona działa, p=Fp/S, jednostką jest Pascal Pa. Ciśnienie jest wywierane zarówno na ścianki naczynia jak i na dowolne przekroje płynów. Ciśnienie zmienia się z głębokością płynu: p=po+ϱgh , jest jednakowe dla punktów o tej samej głębokości, nie zależy od kształtu naczynia.
- Siły działające na ciało w cieczy są w każdym punkcie prostopadłe do powierzchni. Siły poziome wywołane przez ciśnienie równoważą się. Siły pionowe wywołane są przez ciśnienie i ciężar.
- 1 bar = 105 Pa 1 atm = 101325 Pa
Prawo Pascala - ciśnienie zewnętrzne wywierane na zamknięty płyn jest przekazywane (bez zmiany wartości) na każdą część płynu oraz na ścianki naczynia
39. Mikroskopowa interpretacja temperatury. Energia wewnętrzna. Zasada ekwipartycji energii
Zasada ekwipartycji energii - zasada termodynamiczna mówiąca (w oparciu o mechanikę statystyczną i przy założeniu obowiązywania mechaniki Newtona), że dostępna energia jaką dysponuje cząsteczka (np. gazu) rozkłada się "po równo" na wszelkie możliwe sposoby jej wykorzystania (tzw. stopnie swobody). Niezależnie od tego czy jest to stopień swobody związany z energią obrotu, ruchu postępowego czy związany z drganiami cząstek. Zgodnie z tym prawem średnia energia cząstki (energia o charakterze wewnętrznym - niezwiązana z ruchem całego układu) wynosi:
E = (f/2) *kT
gdzie:
T - temperatura układu w kelwinach,
K - stała Boltzmanna,
F - liczba stopni swobody cząsteczki:
f = 3 dla cząsteczek jednoatomowych (np. gazy szlachetne)
f = 6A-5 dla cząsteczek liniowych, (kolejno: ruchy postępowe, ruchy obrotowe, drgania wewnątrz cząsteczki)
f = 6A-6 dla cząsteczek nieliniowych,
f = 6 dla brył sztywnych
A - liczba atomów cząsteczki.
40. Równanie stanu gazu doskonałego. Przemiany gazowe,
RÓWNANIE STANU GAZU DOSKONAŁEGO - RÓWNANIE CLAPEYRONA
Równanie Clapeyrona pokazuje zależność pomiędzy trzema jego właściwościami, które pozwalaja opisać go oraz wpływają na jego zachowanie: ciśnieniem, temperaturą i objętością.
Z teorii kinetyczno-molekularnej wiemy, że:
p = (2N)/(3V) .Eśr
W fizyce jest wiele różnorakich stałych, niektóre z nich nie mają nawet nazwy. Podczas wyprowadzania równania Clapeyrona pojawi się ich kilka. Jedną z nich jest stała oznaczana symbolem C. Wyraża ona stosunek energii średniej cząsteczek gazu do jego temperatury:
C=Eśr / T
Zatem:
p = (2N)/(3V) .Eśr i Eśr = T . C =>p = (2NTC)/(3V)
Wprowadzamy kolejną stałą - k - zwaną stałą Boltzmana:
k = 2/3 . C
I po podstawieniu otrzymujemy:
p = (kNT) / V
Po obustronnym pomnożeniu przez V i podzieleniu przez T otrzymujemy:
(pV)/T = kN
Widać już, że iloraz iloczyny ciśnienia i objętości przez temperaturę (pV)/T jest zawsze stały, ponieważ k jest stałą, a i N=const (liczba cząsteczek nie ulega zmianie).
Rozpatrzmy teraz 1 mol gazu (mol to nie taki denerwujący owad, ale jednostka liczności materii, to powinno być na chemii :) Dla 1 mola gazu N = NA (NA - stałą Avogadro) - w jednym molu substancji jest zawsze tyle samo cząsteczek - 6,022 . 1023 - i to jest właśnie NA. Zatem można zapisać:
(pV)/T = kNA
Pojawia się już ostatnia stała w tym wyprowadzeniu, ale stała bardzo ważna - R - stała gazowa (R = 8,31 J / (mol . K)) :
R = kNA
Zatem po podstawieniu:
(pV)/T = R
Dla n moli gazu:
(pV)/T = nR
Po przekształceniu otrzymujemy równanie Clapeyrona:
pV = nRT
n = m/M jak wiadomo z chemii :) gdzie m to masa substancji, a M to masa molowe tej substancji. Zatem można zapisać jeszcze jedną postać tego równania:
przemiany gazowe, które nazywamy izotermiczną, izobaryczną, izochoryczną i adiabatyczną.
Przemiana izotermiczna jest nazywana również prawem Boyle'a - Mariotte'a. Jak sama 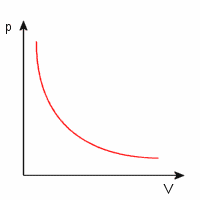
nazwa wskazuje, w przemianie tej temperatura nie ulega zmianie:
T = const
w związku z tym również:
pV = const
Wykres ten przedstawia zależność ciśnienia od objętości dla gazu w przemianie izotermicznej. Krzywa ta nazywa się izotermą.
Przemiana izohoryczna stałej masy gazu charakteryzuje się niezmiennością objętości. Przyrost ciśnienia jest 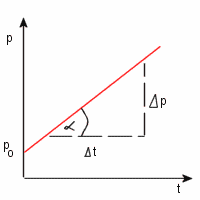
wprost proporcjonalny do przyrostu temperatury.
V = const
p / T = const
Równanie tej prostej, zwanej również izochorą można zapisać :
p = (Δp / Δt) . t + p0
przemiana izobaryczna zachodzi, gdy ciśnienie stałej masy gazu nie ulega zmianie. Przyrost objętości jest wprost proporcjonalny do przyrostu temperatury.
p = const
V / T = const
Równaniej tej prostej zwanej izobarą można zapisać:
V = (ΔV / Δt) . t + V0
41. Maszyny cieplne. Cykl Carnota. II zasada termodynamiki
Maszyna cieplna - zespół urządzeń energetycznych realizujący zamknięty cykl przemian ( obieg termodynamiczny ), w wyniku których następuje wymiana energii między układem mechanicznym, a dwoma zbiornikami ciepła o różnych temperaturach.
Silnik cieplny
Silnik cieplny to urządzenie, które zamienia energię termiczną (cieplną) w energię mechaniczną (praca) lub elektryczną
Pompa ciepła
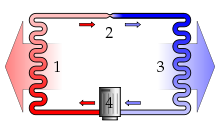
Schemat sprężarkowej pompy ciepła: 1) skraplacz, 2) zawór dławiący (lub kapilara), 3) parownik, 4) sprężarka.
Pompa ciepła to urządzenie, które ogrzewa obszar o temperaturze wyższej poprzez podnoszenie ciepła z obszaru o niższej temperaturze do tego obszaru[8].
Chłodziarka
Chłodziarka to urządzenie, którego celem jest obniżenie temperatury jakiegoś ciała do temperatury niższej od temperatury otoczenia
Druga zasada termodynamiki - Niemożliwa jest przemiana, której jedynym wynikiem byłaby zamiana na pracę ciepła pobranego ze źródła mającego wszędzie jednakową temperaturę. W układzie termodynamicznie izolowanym w dowolnym procesie entropia nigdy nie maleje, dS≥0.
Oznacza to, że nie możemy zbudować doskonałego silnika cieplnego, bo nie możemy wytwarzać pracy pobierając jedynie ciepło z jednego zbiornika bez oddawania pewnej ilości ciepła do zbiornika zimniejszego. Żadna cyklicznie pracująca maszyna nie może bez zmian w otoczeniu przenosić w sposób ciągły ciepła z jednego ciała do drugiego o wyższej temperaturze. Żadna cykliczna maszyna cieplna pracująca pomiędzy temperaturami T1 i T2 nie może mieć sprawności większej niż (T1 − T2)/T1.
Proces odwracalny - za pomocą bardzo małej (różniczkowej) zmiany otoczenia można wywołać proces odwrotny do niego tzn. przebiegający po tej samej drodze w przeciwnym kierunku.
Cykl Carnota -proces odwracalny, obieg termodynamiczny, złożony z dwóch przemian izotermicznych i dwóch przemian adiabatycznych. Wyznacza on granice możliwości zamiany ciepła na pracę. Do realizacji cyklu potrzebny jest czynnik termodynamiczny, który może wykonywać pracę i nad którym można wykonać pracę, np. gaz w naczyniu z tłokiem, a także dwa nieograniczone źródła ciepła, jedno jako źródło ciepła (o temperaturze T1) - górne źródło ciepła obiegu, a drugie jako chłodnica (o temperaturze T2) - dolne źródło ciepła obiegu. Cykl składa się z następujących procesów:
1 Sprężanie izotermiczne - czynnik roboczy styka się z chłodnicą, ma temperaturę chłodnicy i zostaje poddany procesowi sprężania w tej temperaturze (T2). Czynnik roboczy oddaje ciepło do chłodnicy.
2 Sprężanie adiabatyczne - czynnik roboczy nie wymienia ciepła z otoczeniem, jest poddawany sprężaniu, aż uzyska temperaturę źródła ciepła (T1).
3 Rozprężanie izotermiczne - czynnik roboczy styka się ze źródłem ciepła, ma jego temperaturę i poddawany jest rozprężaniu izotermicznemu w temperaturze T1, podczas tego cyklu ciepło jest pobierane ze źródła ciepła.
4 Rozprężanie adiabatyczne - czynnik roboczy nie wymienia ciepła z otoczeniem i jest rozprężany, aż czynnik roboczy uzyska temperaturę chłodnicy (T2).
Wnioski: W wyniku tych czterech procesów czynnik roboczy powraca do punktu wyjścia, dlatego mówimy, że cykl jest zamknięty (zgodnie z definicją obiegu). Podczas procesów sprężania siła zewnętrzna wykonuje pracę nad układem termodynamicznym, a podczas rozprężania układ wykonuje pracę. Ilość pracy wykonanej przez układ jest większa (gdy T1 > T2) od pracy wykonanej nad układem. Podczas cyklu ciepło jest pobierane ze źródła ciepła, część tego ciepła jest oddawana do chłodnicy, a część zamieniana na pracę.
42. Gazy rzeczywiste. Diagram fazowy
Gaz rzeczywisty - pojęcie termodynamiczne oznaczające gaz, który nie zachowuje się ściśle zgodnie z prawami ustalonymi dla gazu doskonałego. W praktyce są to wszystkie gazy istniejące w realnym świecie, aczkolwiek przybliżenie gazu doskonałego może w wielu warunkach być do nich z powodzeniem zastosowane. Przybliżenie to zawodzi jednak w skrajnych warunkach, oraz gdy istnieje potrzeba dokonania bardzo dokładnych obliczeń w warunkach zbliżonych do normalnych.
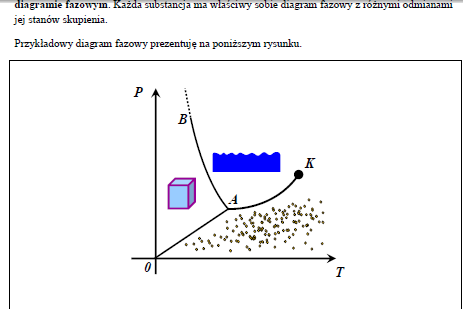
Diagram taki przedstawia się we współrzędnych P-T, gdyż jest to demonstracja indywidualnych właściwości danej substancji, niezależnie jaką jej objętość weźmiemy. Poglądowo narysowałem na nim obszary trzech stanów skupienia: ciała stałego, cieczy i gazu. Odpowiadają im następujące linie zmian faz:
0-A sublimacja / resublimacja (bezpośrednia zamiana ciała stałego w gaz i odwrotnie)
A-B- topnienie / krzepnięcie
A-K- parowanie / skraplanie
46. Prawo powszechnego ciążenia dla punktów materialnych (skalarnie i wektorowo),
Prawo Powszechnego Ciążenia - Każde dwa ciała o masach m1 i m2 przyciągają się wzajemnie siłą grawitacji wprost proporcjonalną do iloczynu mas, a odwrotnie proporcjonalną do kwadratu odległości między nimi. To jest prawo powszechne, ponieważ stosuje się do wszystkich sił grawitacyjnych; np. wyjaśnia spadanie ciał na Ziemię, ale też tłumaczy ruch planet.
47. Oddziaływanie grawitacyjne mas rozciągłych w przestrzeni
W przypadku oddziaływania dwóch ciał o budowie ciągłej należy zsumować siły istniejące między
wszystkimi parami fragmentów obu ciał.
Zatem w najbardziej ogólnym przypadku, dla ciał o skomplikowanej budowie, należy siły grawitacyjne obliczać metodą całkowania.
48. Natężenie pola grawitacyjnego. Przyspieszenie ziemskie
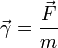
Natężenie pola grawitacyjnego - wektorowa wielkość fizyczna charakteryzująca pole grawitacyjne. Równa jest sile, z jaką dane pole grawitacyjne działa na jednostkową masę. Inaczej mówiąc natężenie pola grawitacyjnego można obliczyć dzieląc siłę grawitacyjną działającą na pewne ciało przez masę tego ciała
![]()
Przyspieszenie ziemskie - przyspieszenie grawitacyjne ciał swobodnie spadających na Ziemię, bez oporów ruchu.Pomijając przyspieszenie wywołane ruchem obrotowym ciała niebieskiego, przyjmuje się, że jest równe liczbowo natężeniu pola grawitacyjnego Ziemi. Jednostkami przyspieszenia ziemskiego są jednostki przyspieszenia:
![]()
Wartość przyspieszenia ziemskiego zależy od szerokości geograficznej oraz wysokości nad poziomem morza. Wraz z wysokością przyspieszenie maleje odwrotnie proporcjonalnie do kwadratu odległości do środka Ziemi i jest wynikiem zmniejszania się siły grawitacji zgodnie z prawem powszechnego ciążenia. Zmniejszanie się przyspieszenia ziemskiego wraz ze zmniejszaniem szerokości geograficznej jest spowodowane działaniem pozornej siły odśrodkowej, która powstaje na skutek ruchu obrotowego Ziemi. Ponieważ siła ta jest proporcjonalna do odległości od osi obrotu, stąd największą wartość osiąga na równiku. Ponieważ siła odśrodkowa ma tu zwrot przeciwny do siły grawitacji, przyspieszenie ziemskie na równiku osiąga najmniejszą wartość. Dodatkowe zmniejszenie przyspieszenia ziemskiego w okolicach równika spowodowane jest spłaszczeniem Ziemi (większą odległością od środka Ziemi).
49. Energia potencjalna ciała w polu grawitacyjnym. Potencjał grawitacyjny.
Potencjał pola grawitacyjnego - wielkość skalarna
równa stosunkowi energii potencjalnej punktu materialnego umieszczonego w rozpatrywanym punkcie pola do masy tego punktu materialnego.
Jeżeli źródłem pola grawitacyjnego jest ciało o symetrii sferycznej, np. jednorodna kula, jednorodna sfera, wówczas potencjał jest wyrażony wzorem
gdzie:
- potencjał pola grawitacyjnego,
- stała grawitacji,
- masa ciała będącego źródłem potencjału,
- odległość ciała próbnego od źródła pola.
Energia potencjalna w polu grawitacyjnym
Ciało o masie m umieszczone w danym punkcie pola ma energię potencjalną, która jest równa pracy, jaką wykonają siły pola, aby przenieść ciało z nieskończoności do tego punktu:
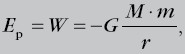
- gdzie M to masa ciała będącego źródłem pola.
Im dalej znajduje się ciało od źródła pola, tym jego energia potencjalna jest bliższa zeru.
Wyszukiwarka
Podobne podstrony:
307 (2), Politechnika Poznańska (PP), Fizyka, Labolatoria, fiza sprawka, optyka
Sprawozdanie 0, Politechnika Poznańska (PP), Fizyka, Labolatoria, sprawozdania fizyka
201 półprzewodniki i przewodniki, Politechnika Poznańska (PP), Fizyka, Labolatoria, fiza sprawka, el
Poprawki do cwiczenia nr 104, Politechnika Poznańska (PP), Fizyka, Labolatoria, fiza sprawka, mechan
Poprawki do cwiczenia nr 105, Politechnika Poznańska (PP), Fizyka, Labolatoria, fiza sprawka, mechan
Zagadnienia na egzamin z fizyki Elektrotechnika sem I - 2012-2013, Politechnika Poznańska, Elektrote
Cw 307, Politechnika Poznańska (PP), Fizyka, Labolatoria, sprawozdania fizyka
123, Politechnika Poznańska (PP), Fizyka, Labolatoria, fiza sprawka, elektromagnetyzm
Program dla elektrotechniki I-stopień- K Ciesielska 06-10-2013, Politechnika Poznańska, 2 rok, III,
ME-pytania egz(Elektrotechnika S-2014-2015), Politechnika Poznańska, 2 rok, IV, Maszyny el
cw 206 pareki, Politechnika Poznańska (PP), Fizyka, Labolatoria, sprawozdania fizyka
Cw 307 poprawione, Politechnika Poznańska (PP), Fizyka, Labolatoria, sprawozdania fizyka
Nr ćwiczenia 307, Politechnika Poznańska (PP), Fizyka, Labolatoria, fiza sprawka, optyka
[6]Ferroelektryk, Politechnika Łódzka, 2 rok, Fizyka Doświadczalna II
SCIAGA FIZA, POLITECHNIKA POZNAŃSKA, sem.1, fizyka
cw.202-sem ogniw metoda kompensacji, POLITECHNIKA POZNAŃSKA, sem.1, fizyka lab
[10]PromieniowanieGamma, Politechnika Łódzka, 2 rok, Fizyka Doświadczalna II
więcej podobnych podstron