Wykonujący: |
Temat: |
Data: |
Justyna Juszkiewicz Karol Krukowski Damian Krupiński Bartosz Jakimko |
Odsiarczanie szlamów pochodzących z rozbiórki akumulatorów
|
Wykonania: 11.04.2016 |
|
|
Oddania: 18.04. 2016 |
Wstęp teoretyczny:
Technologia przerobu zużytych akumulatorów z których pochodzi pasta i frakcja pośrednia polega na ich przetopie w piecach obrotowo wahadłowych wraz z następującymi dodatkami:
koksem
sodą
złomem żelaza
Pasta ta oraz frakcja pośrednia zawierają około 5-6% siarki siarczanowej. W celu pozbycia się siarki z tych materiałów stosujemy między innymi odsiarczanie pasty siarczanu ołowiu poprzez reakcję z wodorotlenkiem sodu lub węglanem sodu. Zabieg ten wykonujemy przed wytapianiem i czynimy go w celu zmniejszenia ilości wytwarzanego żużla i dwutlenku siarki emitowanej do atmosfery.
Odsiarczanie szlamów przyczynia się do zmniejszenia emisji dwutlenku siarki do atmosfery. Wpływa ono na zmniejszenie ilości wytworzonego żużla i zawartości ołowiu znajdującego się w nim co sprzyja wzrostowi stopnia uzysku. Proces ten ma również wpływ na ograniczenie dodatków do wytopu takich jak soda i złom żelaza oraz pozwala na stosowanie niższych temperatur w piecu oraz na skrócenie czasu wytopu co wpływa bezpośrednio na zmniejszenie energii procesu i obniżenie jego kosztów.
Akumulator magazynuje energię, zazwyczaj elektryczną. Jego użytkowanie składa się z dwóch faz: pierwsza z nich to faza ładowania (wówczas staje się on prądnicą), druga - rozładowywania.
Odzysk ołowiu ze złomowanych akumulatorów poprzez wytapianie może być przeprowadzane w na przykład w piecu obrotowo-wahadłowym. Wsadem do tego pieca są produkty segregacji akumulatorów wraz z dodatkami technologicznymi takim jak koksik (który jest reduktorem związków ołowiu), złom żelaza i soda, natomiast produktami otrzymanymi podczas przetopu są ołów surowy i żużel.
Podaż akumulatorów na rynku w Polsce sięga 60 tys. ton. Odpady te zawierają ponad 70% Pb
Schemat blokowy technologii przerobu złomu akumulatorowego
Cel ćwiczenia:
Celem ćwiczenia było odsiarczanie szlamów pochodzących z rozbiórki akumulatorów ołowiowych oraz wyliczenie stopnia uzysku Pb.
Przebieg ćwiczenia:
Przygotowano 70g szlamu akumulatorowego (zawartość Pb ok 75%), rozdrobnionego przy pomocy porcelanowego moździerza i przesypano do grafitowego tygla.
Odważono następujące substraty: - proszek żelaza- 8,4g
- węglan sodowy Na2CO3- 2,8 g
- koksik- 4g,
które następnie zostały dodane do szlamu i dokładnie wymieszane w grafitowym tyglu.
Tygiel został wstawiony do pieca grzewczego o tem. 1000ºC na 45min.
Po ostygnięciu i oczyszczeniu zważono powstały ołów. Jego masa wynosiła 41,24g.
Opracowanie wyników:
Zawartość Pb w szlamie:
70g - masa szlamu
75% - zawartość Pb w szlamie
70 [g] - 100%
x [g] - 75 %
x = 52,5 g - masa Pb w szlamie
Zawartość Pb w postci PbSO4 w szlamie:
70 [g] - 100%
x [g] - 43%
x = 30,1(g)
Stopień uzysku:
masa odlanego metalu - 41,24g
stopień uzysku Pb: (41,24/52,5)*100% = 78,5%
Obliczenie zmiany entalpii swobodnej
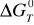
oraz lg Kp dla reakcji redukcji:ΔG0T.
Do wyliczenia potrzebnych wartości użyliśmy programu HSC Chemistry.
PbSO4 + 4CO(g) = PbS + 4CO2(g)
Tabela 1.
T |
deltaH |
deltaS |
deltaG |
K |
Log(K) |
K |
kcal |
cal/K |
kcal |
|
|
500,000 |
-74,055 |
0,129 |
-74,120 |
2,514E+032 |
32,400 |
550,000 |
-74,160 |
-0,072 |
-74,121 |
2,853E+029 |
29,455 |
600,000 |
-74,244 |
-0,217 |
-74,113 |
9,955E+026 |
26,998 |
650,000 |
-74,330 |
-0,355 |
-74,099 |
8,250E+024 |
24,916 |
700,000 |
-74,437 |
-0,514 |
-74,078 |
1,349E+023 |
23,130 |
750,000 |
-74,572 |
-0,700 |
-74,047 |
3,795E+021 |
21,579 |
800,000 |
-74,756 |
-0,937 |
-74,007 |
1,657E+020 |
20,219 |
850,000 |
-74,993 |
-1,223 |
-73,953 |
1,038E+019 |
19,016 |
900,000 |
-75,283 |
-1,555 |
-73,884 |
8,768E+017 |
17,943 |
950,000 |
-75,631 |
-1,931 |
-73,797 |
9,517E+016 |
16,979 |
1000,000 |
-76,036 |
-2,346 |
-73,690 |
1,277E+016 |
16,106 |
1050,000 |
-76,501 |
-2,800 |
-73,561 |
2,054E+015 |
15,313 |
1100,000 |
-77,027 |
-3,288 |
-73,409 |
3,857E+014 |
14,586 |
1150,000 |
-81,669 |
-7,371 |
-73,192 |
8,144E+013 |
13,911 |
1200,000 |
-82,253 |
-7,868 |
-72,811 |
1,827E+013 |
13,262 |
1250,000 |
-82,823 |
-8,334 |
-72,406 |
4,576E+012 |
12,660 |
1300,000 |
-83,380 |
-8,771 |
-71,978 |
1,264E+012 |
12,102 |
1350,000 |
-83,925 |
-9,182 |
-71,529 |
3,808E+011 |
11,581 |
1400,000 |
-79,934 |
-6,307 |
-71,105 |
1,262E+011 |
11,101 |
1450,000 |
-89,960 |
-13,259 |
-70,735 |
4,596E+010 |
10,662 |
1500,000 |
-90,298 |
-13,488 |
-70,066 |
1,620E+010 |
10,209 |
Wykres 1.
PbS+ Fe = Pb + FeS
Tabela 2.
T |
deltaH |
deltaS |
deltaG |
K |
Log(K) |
K |
kcal |
cal/K |
kcal |
|
|
500,000 |
0,671 |
4,985 |
-1,822 |
6,257E+000 |
0,796 |
550,000 |
0,900 |
5,423 |
-2,082 |
6,722E+000 |
0,827 |
600,000 |
1,204 |
5,945 |
-2,363 |
7,259E+000 |
0,861 |
650,000 |
2,420 |
7,966 |
-2,758 |
8,458E+000 |
0,927 |
700,000 |
2,460 |
8,025 |
-3,158 |
9,681E+000 |
0,986 |
750,000 |
2,465 |
8,033 |
-3,559 |
1,090E+001 |
1,037 |
800,000 |
2,439 |
7,999 |
-3,960 |
1,208E+001 |
1,082 |
850,000 |
2,324 |
7,859 |
-4,357 |
1,319E+001 |
1,120 |
900,000 |
2,186 |
7,702 |
-4,746 |
1,421E+001 |
1,153 |
950,000 |
2,031 |
7,534 |
-5,127 |
1,512E+001 |
1,180 |
1000,000 |
1,859 |
7,358 |
-5,499 |
1,592E+001 |
1,202 |
1050,000 |
1,675 |
7,179 |
-5,863 |
1,661E+001 |
1,220 |
1100,000 |
1,481 |
6,998 |
-6,217 |
1,719E+001 |
1,235 |
1150,000 |
1,280 |
6,820 |
-6,562 |
1,767E+001 |
1,247 |
1200,000 |
0,926 |
6,518 |
-6,896 |
1,803E+001 |
1,256 |
1250,000 |
0,930 |
6,522 |
-7,222 |
1,831E+001 |
1,263 |
1300,000 |
0,945 |
6,533 |
-7,548 |
1,858E+001 |
1,269 |
1350,000 |
0,972 |
6,554 |
-7,875 |
1,884E+001 |
1,275 |
1400,000 |
-3,506 |
3,324 |
-8,159 |
1,879E+001 |
1,274 |
1450,000 |
-3,523 |
3,312 |
-8,325 |
1,799E+001 |
1,255 |
1500,000 |
4,135 |
8,384 |
-8,441 |
1,698E+001 |
1,230 |
Wykres 2.
PbSO4 + Na2CO3 + CO(g) = Pb + Na2SO4 + 2CO2(g)
Tabela 3.
T |
deltaH |
deltaS |
deltaG |
K |
Log(K) |
K |
kcal |
cal/K |
kcal |
|
|
500,000 |
-2,898 |
36,418 |
-21,107 |
1,685E+009 |
9,226 |
550,000 |
-0,417 |
41,248 |
-23,104 |
1,518E+009 |
9,181 |
600,000 |
-0,617 |
40,901 |
-25,158 |
1,461E+009 |
9,165 |
650,000 |
0,202 |
42,287 |
-27,285 |
1,495E+009 |
9,175 |
700,000 |
-0,275 |
41,582 |
-29,382 |
1,494E+009 |
9,174 |
750,000 |
-0,750 |
40,920 |
-31,440 |
1,453E+009 |
9,162 |
800,000 |
-0,892 |
40,738 |
-33,482 |
1,405E+009 |
9,148 |
850,000 |
-1,134 |
40,445 |
-35,512 |
1,354E+009 |
9,132 |
900,000 |
-1,480 |
40,050 |
-37,525 |
1,297E+009 |
9,113 |
950,000 |
-1,931 |
39,563 |
-39,516 |
1,234E+009 |
9,091 |
1000,000 |
-2,487 |
38,992 |
-41,480 |
1,165E+009 |
9,066 |
1050,000 |
-3,151 |
38,345 |
-43,413 |
1,089E+009 |
9,037 |
1100,000 |
-3,924 |
37,626 |
-45,313 |
1,008E+009 |
9,004 |
1150,000 |
-15,928 |
26,988 |
-46,964 |
8,434E+008 |
8,926 |
1200,000 |
-11,224 |
31,067 |
-48,504 |
6,832E+008 |
8,835 |
1250,000 |
-12,263 |
30,218 |
-50,036 |
5,611E+008 |
8,749 |
1300,000 |
-13,324 |
29,386 |
-51,526 |
4,603E+008 |
8,663 |
1350,000 |
-14,407 |
28,569 |
-52,975 |
3,774E+008 |
8,577 |
1400,000 |
-15,512 |
27,765 |
-54,383 |
3,093E+008 |
8,490 |
1450,000 |
-26,226 |
20,330 |
-55,705 |
2,493E+008 |
8,397 |
1500,000 |
-27,279 |
19,616 |
-56,704 |
1,830E+008 |
8,262 |
Wykes 3.
Wnioski:
Otrzymany przez nas uzysk ołowiu wyniósł 78,5 %. Ten wynik świadczy o dobrze przeprowadzonym doświadczeniu. Można również zauważyć iż, odzysk ołowiu ze zużytych akumulatorów jest wydajnym procesem. Wynik uzyskany nie jest jednak doskonały, ponieważ część odlewanego metalu nie została usunięta z tygla i z kokili. Na wydajność procesu mogło też wpłynąć: brak całkowitego osuszenia mieszaniny PbCO3 + Na2SO4, długość wytopu ołowiu, dokładność wymieszania składników. Odzysk ołowiu ze zużytych akumulatorów jest bardzo wydajnym sposobem na recykling tego surowca.
Analizując wykresy możemy stwierdzić, że w przypadku reakcji PbSO4 + 4CO(g) = PbS + 4CO2(g) wraz ze wzrostem temperatury wzrasta również entalpia swobodna reakcji, natomiast wartość log K wtedy maleje. Natomiast w przypadku wykresów dla dwóch pozostałych reakcji -entalpia swobodna przyjmuje wartości malejące wraz ze wzrostem temperatury. Log K dla reakcji PbS+ Fe = Pb + FeS ma tendencję wzrostową, aż do temperatury ok. 1400 K gdzie zaczyna się delikatny spadek, zaś dla reakcji
PbSO4 + Na2CO3 + CO(g) = Pb + Na2SO4 + 2CO2(g) spada, gdy temperatura jest coraz wyższa.
VI Literatura:
1. Recykling Metali Nieżelaznych- Marian Kucharski.
Wyszukiwarka
Podobne podstrony:
538
538
kpk, ART 538 KPK, I KZP 1/09 - postanowienie składu 7 sędziów z dnia 20 października 2009 r
538
538
20030902215846id$538 Nieznany
538
538 - Kod ramki - szablon, RAMKI KOLOROWE DO WPISÓW
538 539
538
538
cb uninden pro 538
538
538 WYKLAD 4 - WSKAZNIKI, Zarządzanie, II rok, Analiza efektywności firm
bach 538
304 538 1 SM
regulamin czynnosci trybunalu stanu 538 0
538 539
więcej podobnych podstron